苦楝叶片抗氧化系统对Cd2+胁迫的响应1)
2015-03-07廖源林蔡仕珍邓辉茗龙聪颖陈彦青叶充熊磊王琰琳
廖源林 蔡仕珍 邓辉茗 龙聪颖 陈彦青 叶充 熊磊 王琰琳
(四川农业大学,成都,611130)
责任编辑:任 俐。
我国土壤重金属污染较严重。据统计,受污染的土地已达上万公顷,西南地区是污染的多发区,Cd2+污染概率最高,毒性较强[1]。土壤中的Cd2+进入植株体内会使染色体黏连、断裂或液化,核苷酸损伤,影响细胞的正常分裂,蛋白质变性[2-4];使叶绿体结构受到破坏,降低叶绿素含量,影响植物正常的光合作用[5-6];使体内活性氧过多的积累,导致膜质过氧化加剧,从而抑制植物生长,甚至导致植株死亡。在逆境条件下,植物通过启动自身的防御系统,主动避御逆境伤害,减轻逆境的氧化损伤,维持膜系统的完整性和稳定性,增加对逆境的适应性。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)以及抗坏血酸—谷胱甘肽(AsA-GSH)循环中抗氧化剂和相关的酶均在清除活性氧的过程中发挥着非常重要的作用。研究发现,SOD、CAT 和POD等保护酶在低浓度Cd2+胁迫中活性升高,利于清除植株体内过量的活性氧,维持活性氧的代谢平衡、保护膜结构,使植物在一定程度上忍耐、减缓或抵御逆境胁迫伤害[7]。也有研究发现,随Cd2+质量分数的增加,植物叶片POD 活性逐渐增加,CAT 活性逐渐减少,SOD 活性呈单峰曲线[8],即3 种酶的变化趋势不完全一致,而AsA 质量分数和GSH 质量摩尔浓度几乎都先上升后下降[9]。但在高质量分数Cd2+胁迫下,POD、CAT 和SOD 酶活性明显下降[10-15]。说明植物在耐受Cd2+的阈值内,抗氧化酶类通过活性的变化协同作用,以避御对植株体的伤害。对AsA-GSH 循环中关键酶在Cd2+胁迫下的动态变化的研究较少,对整个抗氧化系统的协同作用研究鲜见报道。
苦楝(Melia azedarach Linn.),又名苦苓、金铃子、森树等,为楝科(Meliaceae)楝属的落叶乔木,广布于亚洲热带和亚热带地区,是西南地区常见的乡土树种,具有生长快、耐瘠薄、耐烟尘、抗二氧化硫、对土壤要求不严等特点,观赏价值和药用价值高,宜作庭荫树及行道树,是工矿区绿化的优选树种。植株体内的苦楝素、苦楝醇和酚酸类等化合物是有效制药成分,叶中的类固醇和果实中的柠檬苦素类似物对癌症细胞有一定的毒害作用[16-17]。前人研究认为,苦楝具有一定的耐盐性[18-19]、耐寒性[20]及耐旱性[21]。而有关重金属对苦楝的生理影响尝未见报道。本试验通过重金属Cd2+对苦楝抗氧化酶系统影响的研究,尝试了解其对Cd2+的耐受机制,判断对Cd2+的耐受能力,以期为苦楝在重金属污染区推广运用提供科学依据和实践指导。
1 材料与方法
2014年1月份于四川温江7—8 龄实生树母株上采集种子,净种后选种粒饱满的优质种子,3月上旬播种在上口径15 cm、高15 cm 的塑料花盆中,播种基质为V(田园土)∶V(草炭)∶V(河沙)= 5 ∶3 ∶2,四川农业大学科研基地内保护地培养。
种植土Cd2+处理:将原土风干、碾碎、剔除杂物,过孔径5 mm 的钢筛后,w(原土)∶w(草炭土)∶w(沙)= 5 ∶1 ∶1 混合均匀,800 倍液多菌灵消毒后静置3 d,测定土壤的氮、磷、钾、有机质质量分数分别为0.47、0.69、3.72、43.05 g·kg-1,Cd2+质量分数为1.8 mg·kg-1。采取盆栽试验方式,栽培容器为上径×下径×高=34 cm×21 cm×27 cm 的白色聚乙烯塑料盆,盆底放置蓄水垫盘,每盆装土7 kg,土壤中的外源Cd2+质量分数梯度以Cd2+计,分别为0、30、60、90、120、150、180 mg·kg-1,用分析纯CdCl2·2.5H2O 配成溶液形式加入Cd2+,混合均匀,使土壤成黏稠状,在室内稳定半月后用于试验。
2014年8月1 号选取生长旺盛、长势基本一致、株高30~40 cm 的植株,移栽至Cd2+处理土壤的盆中,Cd2+质量分数梯度分别为0、30、60、90、120、150、180 mg·kg-1,试验每盆一株,每个处理10 盆,3个重复,共210 株。移栽后第1 周保证叶片不失水,1 周后正常管理,持续胁迫2 个月,处理期间每隔3 d 浇一次400 mL 清水,如有渗出液要反复回浇,直到没有渗出液为止。每隔20 d 取材一次,分别于20、40、60 d 09:00 开始取植物第3~5 片叶(从上到下)进行各项指标的测定。
抗氧化酶活性的测定:超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法,过氧化氢酶(CAT)活性测定采用紫外吸收法,过氧化物酶(POD)活性的测定采用愈创木酚法[22]。
ASA-GSH 循环的测定:抗坏血酸(ASA)质量分数和谷胱甘肽(GSH)质量摩尔浓度测定参照丁继军[23]的方法;抗坏血酸过氧化物酶(APX)活性测定参照Yoshiyuki et al.[24]的方法,单脱氢抗坏血酸还原酶(MDAR)的活性和脱氢抗坏血酸还原酶(DHAR)的活性测定参照Stasolla et al.[25]的方法,谷胱甘肽还原酶(GR)的活性参照Oliver et al.[26]的方法。
采用Excel 07 软件对试验所有原始数据进行初步计算,SPSS19.0 程序进行单因素方差分析和差异显著性检验(LSD),采用Excel 07 绘制相关图表。
2 结果与分析
2.1 Cd2+对苦楝叶片SOD、CAT、POD 活性的影响
由表1可知,随Cd2+处理质量分数增加SOD 活性呈快速增加后逐渐降低的趋势,CAT 活性呈迅速增加后急剧下降趋势,POD 活性呈缓慢上升后急剧下降趋势,三者活性均在Cd2+质量分数180 mg·kg-1处理60 d 时最低。其中20 d 和40 d 处理下,SOD、CAT 和POD 活性的峰值依次出现在Cd2+质量分数90、120、150 mg·kg-1处理时;与CK 相比,SOD活性增幅依次为6%~24%和4%~23%,CAT 活性依次为72%~178%和163%~337%,POD 活性为67%~99%和91%~129%。60 d 处理下,SOD 和CAT 活性的峰值出现在Cd2+质量分数60 mg·kg-1时,POD 活性的峰值则在Cd2+质量分数120 mg·kg-1时;与CK 相比,SOD、CAT 和POD 活性的增幅依次为1%~16%、126%~311%和60%~110%。
在一定质量分数范围内,SOD 和CAT 活性在Cd2+质量分数为30、60 mg·kg-1,POD 活性则在Cd2+质量分数为30、60、90 mg·kg-1时,均随处理时间的延长逐渐增加,20 d 处理均显著低于60 d 处理(p<0.05);SOD 活性在Cd2+质量分数为90、120 mg·kg-1、CAT 活性在120、150、180 mg·kg-1、POD 活性在120、150、180 mg·kg-1时,随处理时间的延长先升后降,以40 d 的最大,显著高于20 d 和60 d。SOD活性在Cd2+质量分数150、180 mg·kg-1时,随处理时间延长,各处理时间点之间差异不显著(p>0.05)。表明Cd2+诱导激活了SOD、CAT 和POD 活性,提高了活性氧的清除能力,而激活3 种酶活性达到最大值的Cd2+质量分数值不一致,3 种酶均有一定阈值,超过阈值活性下降,清除活性氧能力下降。3 种酶随处理时间延长的活性变化趋势不尽一致,活性变化幅度不同,体现了三者清除自由基时的协同作用机制,对提高苦楝的抗氧化能力,保护苦楝不受Cd2+伤害具有重要作用。
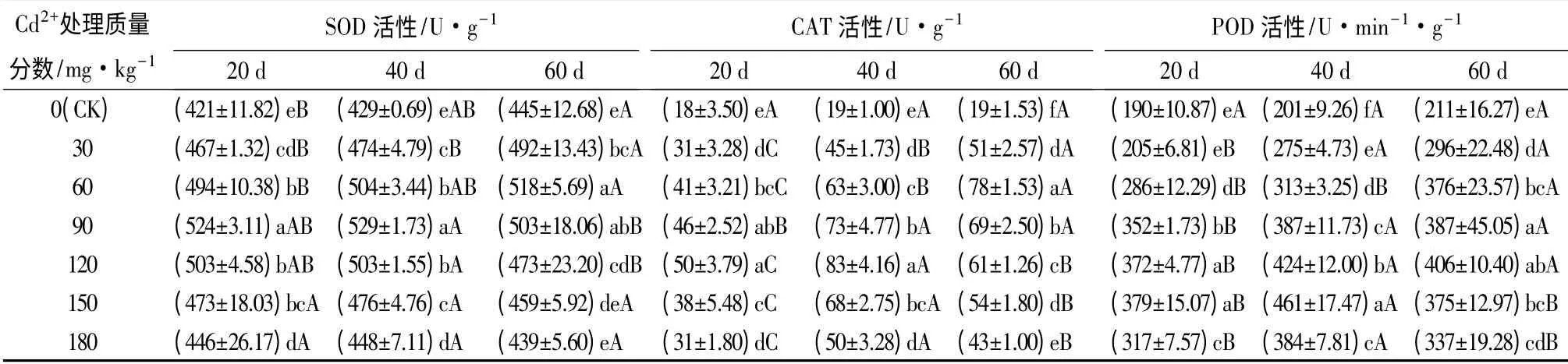
表1 重金属Cd2+对苦楝叶片SOD、CAT、POD 活性的影响
2.2 Cd2+对苦楝叶片AsA-GSH 循坏系统的影响
2.2.1 Cd2+对苦楝叶片AsA 质量分数和GSH 质量摩尔浓度的影响
AsA 是植物细胞内非酶促防御系统中具有多种抗氧化功能的有效抗氧化剂,对维持细胞的正常代谢具有重要作用。由表2可知,随Cd2+处理质量分数增加,AsA 质量分数均呈急剧升高后快速降低趋势,以Cd2+质量分数180 mg·kg-1处理60 d 最低,比CK 低35%。其中AsA 质量分数在20、40 d 处理时的峰值均出现在Cd2+质量分数90 mg·kg-1时,60 d处理的峰值则在质量分数60 mg·kg-1时;与CK 相比,20、40、60 d 处理的增幅分别为56%、67%和112%,降幅分别为22%、17%和35%。3 个处理时间条件下,当Cd2+质量分数30、60、90 mg·kg-1时,AsA 质量分数随处理时间的延长呈增加趋势,60 d处理显著高于20、40 d(p<0.05)。当Cd2+质量分数为120、150、180 mg·kg-1时,AsA 质量分数呈先升后降趋势,均以40 d 最大,120 mg·kg-1时各时间点之间差异不显著;150 mg·kg-1时40 d 显著高于20 d;180 mg·kg-1时,40 d 显著高于60 d(p<0.05)。
GSH 是植物细胞中一种重要的抗氧化剂,在AsA-GSH 循坏中参与AsA 的再生,其质量摩尔浓度对增强植物抗逆性具有重要作用。随Cd2+处理质量分数增加,GSH 质量摩尔浓度呈先逐渐增加后逐渐减少的趋势,其中处理20 d 的GSH 质量摩尔浓度峰值在Cd2+质量分数90 mg·kg-1时,较CK 增加20%,180 mg·kg-1时最低,比CK 少5%;处理40、60 d 的GSH 质量摩尔浓度峰值在质量分数120 mg·kg-1时,分别比CK 多37%、27%,180 mg·kg-1时,比CK 多14%、15%。当Cd2+质量分数为30、60、90 mg·kg-1时,GSH 质量摩尔浓度随处理时间的增加而减小,20 d 处理显著高于40、60 d 处理;Cd2+质量分数120、150 mg·kg-1时,随时间延长先升后降,以40 d的最大,60 d 的最低,60 d 处理显著低于20、40 d 处理。GSH 质量摩尔浓度增加表明其参与AsA 的再生,促进AsA-GSH 循坏。反之,会抑制AsA-GSH循坏。
2.2.2 Cd2+对苦楝叶片APX、MDAR、DHAR、GR 活性的影响
APX 是AsA-GSH 循环中的重要酶,逆境下,AsA 在APX 作用下与H2O2,尤其是叶绿体中的H2O2反应,使H2O2被还原成水,以清除H2O2毒性。由表2可知,随Cd2+处理质量分数增加,APX活性呈急剧升高后快速降低趋势。处理20、40、60 d时,APX 活性峰值均出现在Cd2+质量分数120 mg·kg-1时,最低值均出现在180 mg·kg-1时,各时间点的增幅分别比CK 高31%~62%、14%~57%和33%~82%。当Cd2+质量分数为30、60、90、120 mg·kg-1时,APX 活性除Cd2+质量分数60 mg·kg-1处理40 d时显著高于20 d 外,其余各处理质量分数在各时间点间差异均不显著(p>0.05);当Cd2+质量分数为150~180 mg·kg-1时,60 d 处理显著低于20 d 处理(p<0.05)。表明APX 活性升高,促进了活性氧的清除,尤其是Cd2+质量分数180 mg·kg-1处理60 d 时,APX 依然具有高于CK33%的活性,对促进AsA-GSH循环和高效清除H2O2具有重要作用。
GR 是清除植物细胞内部H2O2的酶催化系统,可维持细胞内总谷胱甘肽含量稳定,催化GSSG 还原为GSH,其活性大小直接决定GSH 的水平,限制ASA-GSH 循环的运行速率。GR 活性随Cd2+处理质量分数增加呈逐渐升高后快速降低的趋势,处理20、40、60 d 的GR 活性峰值均出现在Cd2+质量分数90 mg·kg-1时,分别比CK 高35%、33%和39%,Cd2+质量分数180 mg·kg-1时最低,依次比CK 降低9%、16%和15%。当Cd2+质量分数为30、60、90 mg·kg-1时,各时间点间GR 活性差异不明显(p>0.05),当质量分数为120、150、180 mg·kg-1时,20 d 处理显著高于60 d 处理(p <0.05)。表明低质量分数Cd2+诱导了GR 活性的增加,高质量分数(180 mg·kg-1)和长时间(60 d)胁迫对酶的活性产生了抑制作用。
MDAR 和DHAR 是AsA-GSH 循环中AsA 再生的2 个重要限速酶。处理20、40 d 时,MDAR 活性随Cd2+处理质量分数的增加呈逐渐升高后缓慢降低的趋势,处理60 d 时则呈逐渐降低趋势。其中处理20 d 的MDAR 活性峰值在Cd2+质量分数90 mg·kg-1时,处理40 d 的峰值在Cd2+质量分数30 mg·kg-1时,分别比CK 高28%和5%,最低值在Cd2+质量分数180 mg·kg-1时,20 d 和40 d 分别比CK 低25%和39%;Cd2+质量分数180 mg·kg-1处理60 d时较CK 下降了39%。当Cd2+质量分数为30、60、120、150 mg·kg-1时,MDAR 活性随处理时间延长先增加后降低,均以40 d 的最大,20 d 的最低;当Cd2+质量分数为90、180 mg·kg-1时,MDAR 活性随处理时间延长逐渐降低,20 d 处理显著高于60 d 处理(p<0.05)。
DHAR 活性随Cd2+处理质量分数增加均呈逐渐升高后逐渐降低趋势,处理20、40、60 d 的DHAR 活性峰值均出现在Cd2+质量分数90 mg·kg-1时,分别比CK 高44%、46%和51%,Cd2+质量分数180 mg·kg-1时最低,但仍分别比CK 高8%、4%和6%(p>0.05)。在同一Cd2+处理质量分数下,DHAR 活性随时间的延长先增加后降低,均以40 d 的最大,当Cd2+质量分数为30、60、90、120 mg·kg-1时,以20 d最低,当Cd2+质量分数为150、180 mg·kg-1时60 d的最低,各时间点之间差异不显著(p>0.05)。

表2 重金属Cd2+对苦楝叶片ASA 质量分数、GSH 质量摩尔浓度及APX、MDAR、DHAR、GR 活性的影响
从上述ASA-GSH 循环系统中ASA 质量分数、GSH 质量摩尔浓度及关键酶活性的变化情况表明,一定质量分数的Cd2+胁迫处理能使苦楝ASA-GSH循环中抗氧化剂质量分数(质量摩尔浓度)升高,酶活性增加,而高质量分数的Cd2+会降低抗氧化剂质量分数(质量摩尔浓度)及酶活性;ASA-GSH 循环中抗氧化剂与抗氧化酶起到协同抗氧化的作用,以减轻Cd2+胁迫带来的伤害;ASA-GSH 是Cd2+胁迫下苦楝清除活性氧和自由基的重要途径。
3 结论与讨论
在正常条件下,植物细胞进行代谢的过程中,有多种途径可产生活性氧,如线粒体、叶绿体和质膜上的电子传递至分子氧的过程均会产生活跃且具毒性的活性氧[27]。因植物具有抗氧化保护系统,活性氧的产生与消除保持着平衡,植物不会受到氧化伤害,而在逆境胁迫条件下,植物产生的活性氧超出了清除系统的清除能力,活性氧产生和消除间的平衡被打破,导致活性氧大量积累,植物受到氧化伤害。
重金属胁迫对植物的毒害机理之一就是导致过量的活性氧的产生与积累,当活性氧超过正常水平时,即对植物产生氧化伤害。三大保护性酶SOD、CAT、POD 在逆境下对活性氧自由基的清除具有重要的作用。SOD 将胁迫产生的超氧阴离子歧化成H2O2,CAT 和POD 将H2O2脱毒分解成H2O 和O2。前人研究表明,随处理时间延长,低浓度Cd2+(<1.0 mg·L-1)使金鱼藻体内SOD、CAT 活性均呈先上升后下降趋势,而高浓度Cd2+(>2.0 mg·L-1)使二者活性均显著下降[28]。说明低质量分数Cd2+诱导了抗氧化酶活性的升高,而高质量分数Cd2+或长时间的胁迫则使酶活性降低[29],酶活性存在一个阈值,在一定Cd2+处理质量分数和处理时间内,酶活性得以提高和维持,超过这个质量分数范围,活性则下降[30]。本试验中,20、40 d 处理下,SOD、CAT、POD活性的峰值依次出现在Cd2+质量分数90、120、150 mg·kg-1处理时,60 d 处理下,SOD、CAT 活性的峰值出现在Cd2+质量分数60 mg·kg-1时,POD 活性的峰值则在Cd2+质量分数90 mg·kg-1时。且SOD 活性较CAT、POD 活性提前达到峰值水平,活性的变化幅度较CAT、POD 活性的小,但保持相对较高的水平,说明SOD 作为消除活性氧的先锋,在使苦楝叶片免受氧化伤害中起着重要作用,三大酶活性峰值所对应的Cd2+处理质量分数不同,体现了三者在苦楝受到Cd2+胁迫时,共同协作清除胁迫产生的超氧阴离子等活性氧,以减轻逆境带来的氧化伤害的生理机制。20、40 d 处理下Cd2+胁迫质量分数大于120 mg·kg-1时,以及60 d 处理下Cd2+质量分数大于60 mg·kg-1时,SOD、CAT 活性均下降,表明胁迫产生的活性氧自由基超出了2 种酶清除的能力范围。POD 活性峰值处理为20、40 d 处理下Cd2+质量分数150 mg·kg-1,60 d 处理下Cd2+质量分数90 mg·kg-1,由于POD 的双重生理功能,一方面参与消除羟基自由基,另一方面逆境加剧及叶片衰老初期参与活性氧的生成和叶绿素的降解,并引发膜质过氧化作用,所以其活性的提高即表明其清除H2O2能力的增强,也预示着植物受氧化程度的加剧及组织的老化[31-32]。因此,推测20、40 d 处理下Cd2+胁迫质量分数大于120 mg·kg-1,以及60 d 处理下Cd2+质量分数大于60 mg·kg-1,苦楝叶片活性氧自由基的产生和积累超过了3 种保护性酶的清除和调节能力,植物体会产生氧化伤害。
ASA-GSH 循环系统是清除活性氧自由基的重要途径,可将H2O2还原成H2O 和O2,使细胞内活性氧水平降低[33]。其中,抗氧化剂ASA 可直接或在APX 催化下与活性氧反应,在被氧化的同时将活性氧还原,GSH 除了能直接清除自由基外,还通过与GSH-PX-RX 酶系共同抑制脂质过氧化的启动和终止脂质过氧化的发展[22]。在ASA-GSH 循环中,APX 氧化ASA 使ASA 质量分数降低,MDAR 和DHAR 再生ASA 使其质量分数增加。Okmanen[34]等在拟南芥中发现,ASA 质量分数不足时,APX 活性低,因此,高活性APX 与高质量分数ASA 一致。在低浓度镉胁迫下,ASA 具有还原和络合重金属的作用,能清除植物体内受重金属胁迫产生的活性氧。但重金属浓度超过一定界限时,ASA 质量分数下降,APX 活性降低[35]。本试验中,Cd2+质量分数为30、60、90 mg·kg-1时,处理20、40 d,以及Cd2+质量分数为30、60 mg·kg-1时,处理60 d,ASA 质量分数急剧上升至峰值,APX 活性也快速升高,加速了活性氧的清除速率。而3 个处理时间点下APX 活性均在Cd2+质量分数120 mg·kg-1才达到峰值,滞后于ASA 质量分数峰值,说明ASA 质量分数在峰值后至Cd2+质量分数≤120 mg·kg-1条件下下降的原因可能是APX 活性升高加速ASA 分解造成的。而在Cd2+质量分数为150~180 mg·kg-1条件下,ASA质量分数和APX 活性的降低可能是ASA-GSH 循环受到抑制。MDAR 和DHAR 是ASA-GSH 循环中ASA 再生的两个重要酶,前人研究认为,MDAR 还原MDHA 是ASA 再生的主要途径[22,36-37]。本研究中,MDAR 活性远高于DHAR 活性,说明在苦楝叶片中MDAR 是再生ASA 的主要酶,这与前人研究结果一致。
GR 活性影响着细胞内GSH 质量摩尔浓度,且与植物对逆境的抵抗能力密切相关[38],GR 活性随Cd2+处理质量分数增加先升高后降低,GSH 质量摩尔浓度也先升后降。GSH 质量摩尔浓度在植物螯合肽合成酶催化下在细胞质中聚合形成植物螯合肽(PC),PC 具很强的重金属亲和力,能与重金属离子(如Cd2+)螯合形成无毒的化合物,从而降低植物细胞内游离的重金属离子质量分数,减轻重金属对植物的毒害[39]。本试验中,3 个处理时间下,GR 活性峰值均出现在Cd2+质量分数90 mg·kg-1时;而GSH质量摩尔浓度峰值在处理20 d 时,出现于Cd2+质量分数90 mg·kg-1,处理40、60 d 时出现于质量分数120 mg·kg-1时,表明适度Cd2+处理,质量分数为30、60、90 mg·kg-1,ASA-GSH 循环处于高效工作状态。
综上认为,20、40 d 处理下Cd2+质量分数分别为30、60、90 mg·kg-1,以及60 d 处理下Cd2+质量分数分别为30、60 mg·kg-1时,苦楝同时启动了大幅度提高SOD、CAT、POD 活性清除活性氧自由基机制和加速ASA-GSH 循环系统高效运行清除活性氧自由基机制,二者协同作用,维持体内活性氧的产生和清除的动态平衡,使苦楝不会受到氧化伤害;20、40 d处理下Cd2+质量分数在90~120 mg·kg-1,60 d 处理下Cd2+质量分数在60~90 mg·kg-1,主要由CAT、POD 和ASA-GSH 循环系统担任活性氧自由基的清除作用,共同抵御Cd2+胁迫带来的氧化伤害,氧化伤害不严重,属于苦楝能耐受的范围;20、40 d 处理下Cd2+质量分数在150~180 mg·kg-1,60 d 处理下Cd2+质量分数在120~180 mg·kg-1,SOD、CAT、POD活性和ASA-GSH 循环均受到一定程度的抑制,且质量分数越大,抑制作用越明显,但在60 d 处理下Cd2+质量分数为180 mg·kg-1时,除SOD 略低于CK外,CAT 和POD 活性分别为CK 的126%和60%,GSH 质量摩尔浓度比CK 高15%,APX 活性比对照高33%,表明保护性酶系统和ASA-GSH 循环并没有因胁迫而完全被破坏,只是受到了较大程度的抑制,表明苦楝受到相应程度的氧化伤害,对Cd2+胁迫具有较强的耐受能力。由此可以认为,苦楝对Cd2+胁迫的耐受范围为20、40 d 处理下Cd2+质量分数低于150 mg·kg-1,60 d 处理下低于120 mg·kg-1。
[1] 宋伟,陈百明,刘琳.中国耕地土壤重金属污染概况[J].水土保持研究,2013,20(2):293-298.
[2] Samantaray D P S,Rout G R.Studies on cadmium toxieity in plants:Areview[J].Environmental Pollution,1997,98:29.
[3] Gong Jiming,Lee D A,Schroeder J I.Long-distance root-to-shoot transport of phytochelatins and cadmium in Arabidopsis[J].Proc Natl Acad Sci USA,2003,100(17):1118-1164.
[4] Rosas I,Carbajal M E,Gomez-Arroyo S,et al.Cytogenetic effects on cadmium accumulation on water hyacinth (Eichornia crassipes)[J].Environmental Reseach,1984,33:386-395.
[5] Zhou Yuqin,Su Zhenhuang,Yu Shilong,et al.The physiological response and sub-cellular localization of lead and cadmium in Ⅰris pseudacorus L.[J].Ecotoxicology,2009,19(1):69-76.
[6] Shi Gangrong,Cai Qingsheng.Photosynthetic and anatomic responses of peanut leaves to cadmium stress[J].Photosynthetic,2008,46(4):627-630.
[7] Liang Yongchao,Chen Qin,Liu Qian,et al.Exogenous silicon(Si)increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley (Hordeum vulgare L.)[J].Journal of Plant Physiology,2003,160(10):1157-1164.
[8] 严重玲,林鹏,王晓蓉.烟草叶片膜保护酶系统对土壤Hg,Cd,Pb 胁迫的响应[J].实验生物学报,2002,35(3):170-172.
[9] 丁继军,潘远智,刘柿良,等.土壤重金属镉胁迫对石竹幼苗生长的影响及其机理[J].草业学报,2013(6):77-85.
[10] 高家合,王树会.镉胁迫对烤烟生长及生理特性的影响[J].农业环境科学学报,2006,25(5):1167-1170.
[11] 许娜,蒋安民,储俊,等.铅、镉胁迫下鱼腥草抗氧化酶响应研究[J].合肥工业大学学报:自然科学版,2014,37(7):865-870.
[12] Hu Yanling,Ge Ying,Zhang Chunhua,et al.Cadmium toxicity and translocation in rice seedlings are reduc by hydrogen peroxide pretreatment[J].Plant Growth Regul,2009,59(1):51-61.
[13] Mediouni C,Ben AW,Houlné G.Cadmium and copper induction of oxidative stress and antioxidative response in tomato(Solanum lycopersicon)leaves[J].Plant Growth Regul,2009,57(1):89-99.
[14] Zhang Shanshan,Zhang Huimin,Qin Rong,et al.Cadmium induction of lipid peroxidation and effects on root tip cells and antioxidant enzyme activities in Vicia faba L.[J].Ecotoxicology,2009,18(7):814-824.
[15] Nouairi I,Ammar W B,Youssef N B,et al.Antioxidant defense system in leaves of Indian mustard (Brassica juncea)and rape(Brassica napus)under cadmium stress[J].Acta Physiol Plant,2009,31:237-247.
[16] Wu Shibiao,Ji Yanping,Zhu Jingjing.Steroids from the leaves of Chinese Melia azedarach and their cytotoxic effects on human cancer cell lines[J].Steroids,2009,74:761-765.
[17] Akihisa T,Pan Xin,Nakamura Y.Limonoids from the fruits of Melia azedarach and their cytotoxic activities[J].Phytochemistry,2013,89:59-70.
[18] 王家源.苦楝种苗耐盐胁迫的生理响应机制研究[D].南京:南京林业大学,2013.
[19] 张子晗,王家源,喻方圆.盐胁迫对两种源苦楝种子萌发特性的影响[J].南京林业大学学报:自然科学版,2014,38(5):107-112.
[20] 王家源,郭杰,喻方圆.不同产地苦楝苗木抗寒性差异[J].林业科技开发,2011,25(3):67-69.
[21] 陈吉虎.5 树种的苗期抗旱特性研究[D].泰安:山东农业大学,2003.
[22] 王学奎.植物生理生化实验原理和技术[M].2 版.北京:高等教育出版社,2006.
[23] 丁继军.外源ASA、GSH 对土壤Cd 胁迫下石竹幼苗抗性生理的影响及其机理[D].雅安:四川农业大学,2013.
[24] Yoshiyuki N,Kozi A.Hydrogen peroxide is scavenged by ascrorbate-specific peroxidase in spinach chloroplasts[J].Plant Cell Physiol,1981,22(5):867-880.
[25] Stasolla C,Yeung E C.Ascorbic acid metabolism during white spruce somatic embryo maturation and germination[J].Physiologia Plantarum,2001,111(2):196-205.
[26] Oliver C,Knörzer J B,Boger P.Alterations in the antioxidative system of suspension-cultured soybean cells (Glycine max)induced by oxidative stress[J].Physiologia Plantarum,1996,97(2):388-396.
[27] 杜秀敏,殷文璇,赵彦修,等.植物中活性氧的产生及清除机制[J].生物工程学报,2001,17(2):121-125.
[28] 程飞,张颖,方元平,等.金鱼藻抗氧化系统对镉胁迫的响应[J].安徽农业科学,2012,40(23):11791-11793,11867.
[29] Mediouni C,Ben AW,HoulnéG.Cadmium and copper induction of oxidative stress and antioxidative response in tomato (Solanum lycopersicon)leaves[J].Plant Growth Regul,2009,57:89-99.
[30] 袁祖丽,吴中红.镉胁迫对烟草(Nicotiana tabacum)根抗氧化能力和激素含量的影响[J].生态学报,2010,30(15):4109-4118.
[31] 陶巧静,付涛,项锡娜,等.模拟酸雨对西洋杜鹃生理生态特性的影响[J].生态学报,2014,34(8):2020-2027.
[32] 郭慧媛,马元丹,王丹,等.模拟酸雨对毛竹叶片抗氧化酶活性及释放绿叶挥发物的影响[J].植物生态学报,2014,38(8):896-903.
[33] Schützendüble A,Nikolova P,Rudolf C.Cadmium and H2O2induced oxidative stress in Populus canescens roots[J].Plant Physiology and Biochemistry,2002,40:577-584.
[34] Okmanen E,Hoikio E,Sober J.Ozone-induced H2O2accumulation in field-grown aspen birch is linked to foliar ultrastructure and peroxisomal activity[J].New Phytol,2004,161(3):791-799.
[35] 袁祖丽,吴中红,刘秀敏.镉胁迫对烤烟叶片抗氧化系统的影响[J].河南农业科学,2008(7):43-46.
[36] Valentina M,Micha V,Micha G,et al.Activities of SOD and the aseorbate-glutathione cycle enzymes in subcellular compartments in leaves and roots of cultivated tomato and its wild salt-tolerant relative Lycopersicon pennellii[J].Physiologia Plantarum,2000,110(1):42-50.
[37] 罗娅,汤浩茹,张勇.低温胁迫对草莓叶片SOD 和AsA-GSH循环酶系统的影响[J].园艺学报,2007,34(6):1405-1410.
[38] 鲁丽丽,刘耕,李君,等.外源GSH 对NaCl 胁迫下二色补血草盐害缓冲机理的研究[J].山东师范大学学报:自然科学版,2006,21(2):108-111.
[39] 李志刚,许自成,苏永士,等.植物谷胱甘肽研究进展[J].江西农业学报,2010,22(4):118-121.
