4克苏市主要行道树叶面滞尘对种矮牵牛叶片直接诱导不定芽再生体系建立1)
2015-03-07平璐顾德峰韦正乙仲晓芳王云鹏林春晶邢少辰
平璐 顾德峰 韦正乙 仲晓芳 王云鹏 林春晶 邢少辰
(吉林农业大学,长春,130118) (吉林省农业科学院农业生物技术研究所)
责任编辑:任 俐。
矮牵牛(Petunia hybrid Vilm)属于茄科,碧冬茄属,多年生草本植物,因花色丰富而极具观赏价值,有“花坛皇后”的美誉。在我国东北地区,常作为1~2年生栽培花卉,用于园林植物景观搭配的材料[1]。矮牵牛的栽培历史悠久,品种丰富多样,1849年就人工培育出了复瓣杂交品种,之后又陆续培育出四倍体大花品种和小花及矮化品种[2-3]。1930年,日本首次培育了F1代的杂交矮牵牛品种[4]。而后通过花药离体培养和低温处理等方法进行矮牵牛的单倍体育种研究[5-8]。由于矮牵牛具有明显的杂种优势,国内科技工作者在矮牵牛杂种优势研究和杂交品种培育方面也取得了明显进展,如采用射线诱变,配合单株系选方法,筛选自交系和不育系,并在此基础上进行杂交,获得不同花色的矮牵牛杂种一代品种6 个[9-11]。
除了常规育种外,基因工程也为矮牵牛育种开辟了一个新途径。由于矮牵牛具有生长周期短、基因变异性状易于识别、适合农杆菌遗传转化等多种优势[4,12-13]。自Horsch et al.[14]1985年首次获得矮牵牛转基因植株后,矮牵牛作为受体被广泛用于基因工程领域,用于多种性状改良。在花色性状改良方面,利用矮牵牛无色突变体转化来自玉米的二氢槲皮素还原酶基因,已经获得砖红色矮牵牛品系,转化查尔酮还原酶基因获得了黄色矮牵牛品系[15-16];在改善矮牵牛的诱导率和抗逆性方面,异戊烯基转移酶Ⅰpt 基因可以提高不定芽的诱导频率,而经过芯片表达谱筛选出的B-box 型锌指蛋白基因PhBBX8可能与非生物逆境有关[13,17]。将源于百脉根的Bio基因及其突变基因经过农杆菌介导转入矮牵牛,发现转基因后代植株的叶片明显变窄,甚至只剩下主叶脉,说明该基因可调控叶片的发育[18]。研究发现,源于拟南芥的AtGA2OX1 基因转入矮牵牛中,可以产生矮化植株,其效果与喷施多效唑的效果一致,为矮化育种提供技术支持[19]。在提高矮牵牛抗病性上,发现转乙烯受体突变基因ETR1-1 可以提高矮牵牛叶片对灰霉病的抗性[20]。将与衰老相关的SAG12-ⅠPT 基因转化到矮牵牛中,发现该基因的表达能够明显延迟矮牵牛叶片的衰老,开花数量和生物量也均有增加[21]。
与传统的细胞核转化不同,叶绿体转化具有独特优势,如外源基因的高表达量,没有基因沉默现象等,因而为植物的性状遗传改良和生物反应器研究开辟了新途径[22]。作为叶绿体转化的受体,区别核转化受体的一个明显特点就是需要其具有较高的不定芽诱导频率,以便有更大的机会获得同质化转基因植株。2004年,Zubko et al.[23]利用Gus 基因首次建立了矮牵牛稳定的叶绿体遗传转化体系,后续未见其他报道。本研究通过在筛选培养基中添加双丙氨膦和壮观霉素,配合3 种不同质量浓度的激素,开展抗性培养基参数优化试验,希望在4 种矮牵牛品种中获得不定芽诱导频率表现良好的材料,为后续的矮牵牛叶绿体遗传转化奠定材料基础,进而推动矮牵牛遗传性状的改良。
1 材料与方法
本研究选用4 种不同花色的矮牵牛品种,分别为‘Pink Vein’、‘Peppermint’、‘Red’和‘Pink’(图1)。上述品种由吉林省农业科学院农业生物技术研究所植物生物反应器工程实验室保存。

图1 4 种不同花色的矮牵牛品种
试验设计:以4 种不同花色的矮牵牛品种作为材料,选取3 种诱导激素(6-BA、NAA、IBA)中的任意2 种激素,按照不同质量浓度设定为1 组,共设计9 组激素配比(表1),每1 组设置5 次重复,每次重复接种16 个外植体。运用DPS 软件分析叶片外植体直接诱导不定芽的情况,从中筛选出最优培养基及受体材料。在此基础上,选择2 种筛选剂,每1 种筛选剂添加到一组最优培养基和受体材料组合中,设置5 个质量浓度梯度处理,每组接种16 个叶片外植体,处理14 d,每2 d 统计1 次外植体黄化或褐化个数,通过筛选效果选出最优筛选剂及筛选的最优质量浓度。
再生培养基中3 种激素质量浓度的优化:以MS作为矮牵牛再生的基础培养基,附加不同质量浓度、不同组合方式的6-BA、NAA 及IBA3 种激素。培养基中琼脂为0.6%、蔗糖为3%,pH=5.8(表1)。

表1 矮牵牛不定芽诱导培养基中3 种激素的组合
两种抗性培养基的筛选:两种抗性培养基包括在培养基中添加不同质量浓度的双丙氨膦(Bialaphos-sodium,缩略为Bar)和壮观霉素(Spectinomycin,缩略为Spe),利用确定的矮牵牛品种‘Pink’进行抗性筛选。在双丙氨膦质量浓度的选择上,本研究参照烟草、水稻、玉米等植物的筛选条件[24-26],在品种‘Pink’最适的再生培养基中,添加5 种不同质量浓度的Bar 进行筛选,质量浓度梯度设置为0、1、2、3、4、5 mg·L-1。在抗生素壮观霉素质量浓度的选择上,参照甜菜、郎柿、菊苣等植物的筛选标准[27-29],在品种‘Pink’最适再生培养基中,添加5种不同质量浓度的Spe 进行抗性筛选,质量浓度梯度设置为0、50、75、100、125、150 mg·L-1。
矮牵牛再生体系的建立:本试验选取4 种不同花色的矮牵牛品种作为受体材料,每个品种的种子分别用10%的过氧化氢(H2O2)杀菌10 min,再用无菌水冲洗4~6 次,然后加入无菌水将种子完全淹没,4 ℃条件下过夜。次日,倒掉无菌水,分别加25%的次氯酸钠(NaClO),灭菌30 min。最后用无菌水冲洗6~8 次,接种到MS 培养基中,4 ℃条件下暗培养12 h,次日进行光照培养。培养条件:温度24 ℃,湿度40%,光照强度2 500 lx,光照培养18 h/d,暗培养6 h/d,待矮牵牛种子萌发并长成10 cm 左右的幼苗,用于再生。
选取上述4 个矮牵牛品种中长势好的无菌苗,剪取中层叶片,去除叶脉后切成大小约1 cm×1 cm的方形叶块,近轴面朝上平铺在添加了不同质量浓度激素的MS 培养基上,每个培养基按照4×4 方式均匀摆放叶块。每组处理80 个外植体,每皿16 个,一个处理设置5 次重复。每2 周左右更换一次培养基,直至诱导出不定芽。待不定芽长至1 cm 左右,统计出芽数。将不定芽移栽到分别添加不同激素的生根培养基中,生根成苗。
Bar 与Spe 对矮牵牛不定芽诱导的影响:取长势较好的无菌苗中层叶片,按前述的4×4 叶块摆放方式,分别均匀地平铺在含不同质量浓度Bar 和Spe的培养基上,培养基中同时添加3 种激素,并分别设置不同质量浓度。每种激素处理16 个外植体叶块,约2 周后统计外植体不定芽的诱导情况,分别确立Bar 及Spe 筛选的最适临界质量浓度。
数据统计分析:采用DPS 数据处理系统软件,首先对9 种激素组合的处理结果进行单因素比较分析,按照不定芽诱导的频率,确定4 个不同矮牵牛品种的最适培养基,然后进行多重比较,确定诱导不定芽的最适矮牵牛品种。根据不同激素质量浓度与不同品种不定芽诱导数进行方差分析,选择出适用于叶绿体遗传转化的矮牵牛受体品种,以及利用Bar和Spe 作为筛选剂的抗性筛选培养基。
2 结果与分析
2.1 不同培养基对矮牵牛不定芽诱导的影响
2.1.1 适合不同品种不定芽诱导的培养基
诱导培养基通过9 个激素组合和5 次重复处理,对比分析4 种不同花色品种的矮牵牛不定芽诱导率,从而确定不同品种诱导不定芽的最适培养基(表2)。
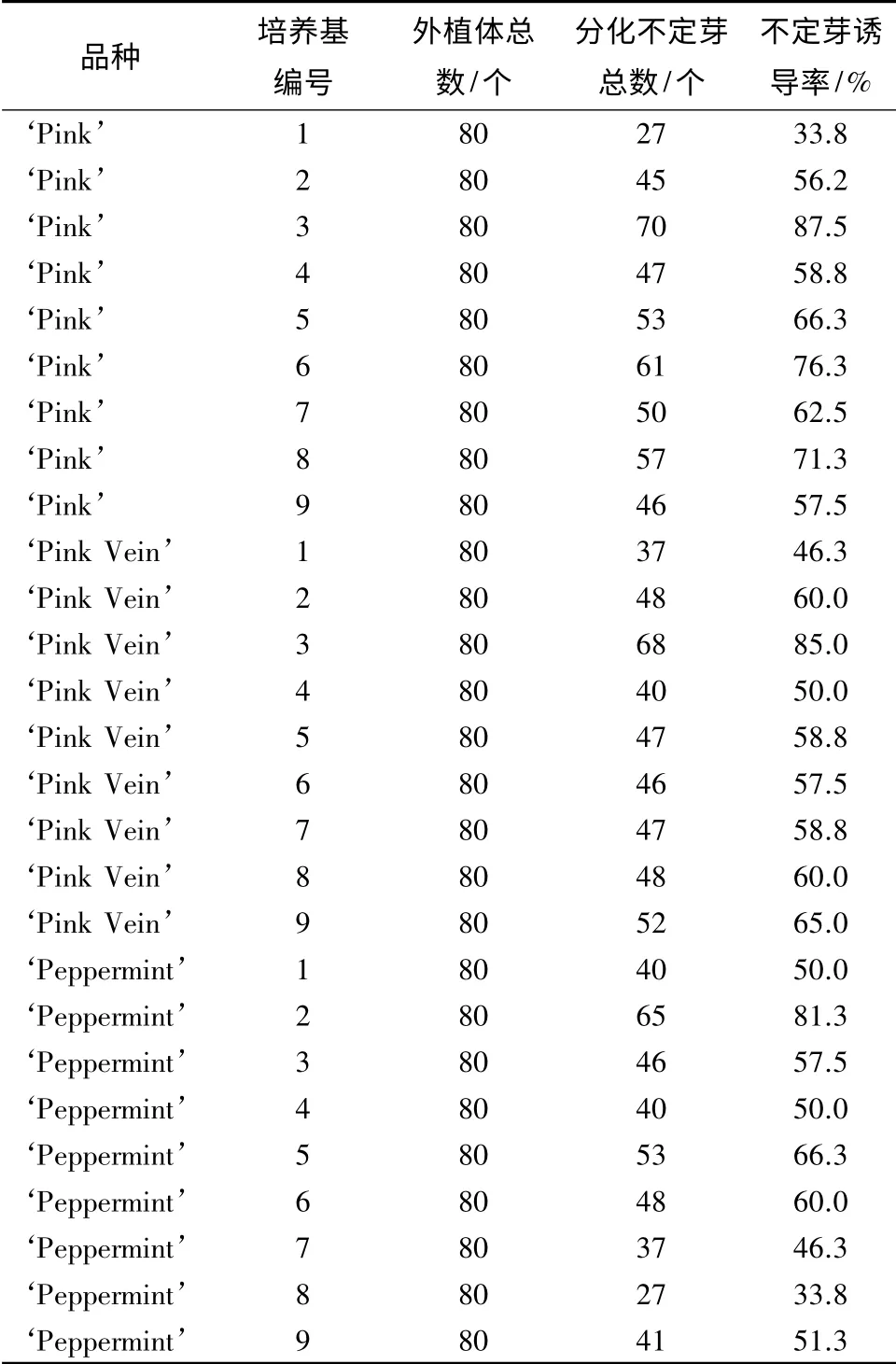
表2 不同质量浓度激素对矮牵牛不定芽诱导的影响
结果分析表明(表2),品种‘Pink Vein’在3 号培养基中不定芽产生个数最多,80 个外植体中有68个分化出不定芽,诱导率为85.0%,并且与其他培养基存在显著差异,确定品种‘Pink Vein’的最适培养基为3 号培养基,即MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA;品种‘Peppermint’在2 号培养基中不定芽产生个数最多,80 个外植体中有65 个分化出不定芽,诱导率为81.3%,且与其他培养基存在极显著差异,确定品种‘Peppermint’的最适培养基为2 号培养基,即MS+1.0 mg·L-16-BA+0.3 mg·L-1NAA;同样地,品种‘Pink’的最适培养基确定为3 号培养基,80 个外植体中有70 个分化出不定芽,诱导率为87.5%,即MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA为矮牵牛再生的最适培养基(图2)。品种‘Red’只在1 号培养基,即MS+1.0 mg·L-16-BA+0.1 mg·L-1NAA 中诱导产生一个不定芽。在其他培养基中没有诱导出不定芽。
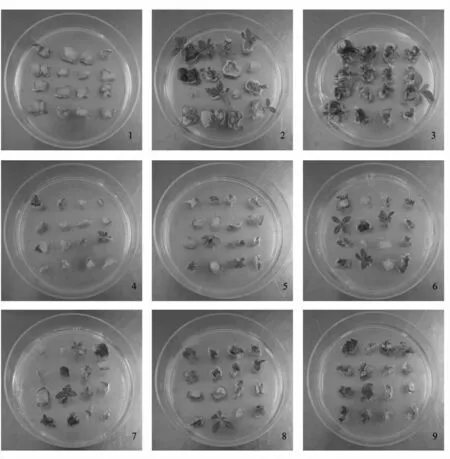
图2 在培养基中诱导21 d 时,‘Pink’矮牵牛叶片不定芽的诱导情况
2.1.2 不定芽诱导最适品种的筛选
为了从4 个矮牵牛品种中筛选得到哪个品种更适合不定芽的诱导,分析了培养基中不同激素质量浓度与不同品种不定芽诱导之间的关系,二者之间的二因素多重比较结果如表3所示。
由表2可以看出,4 个矮牵牛品种的不定芽诱导率由高到低的顺序为‘Pink’、‘Pink Vein’、‘Peppermint’、‘Red’。其中,由表3的二因素多重比较结果可以看出,品种‘Pink’与3 号培养基组合时,诱导不定芽的平均数与其他组合之间的不定芽诱导率存在极显著差异,而且叶片诱导的不定芽数量最多,因此,确定‘Pink’为4 个矮牵牛品种中最适合不定芽诱导的品种。4 个矮牵牛品种在诱导培养基上的不定芽诱导情况如图3所示。
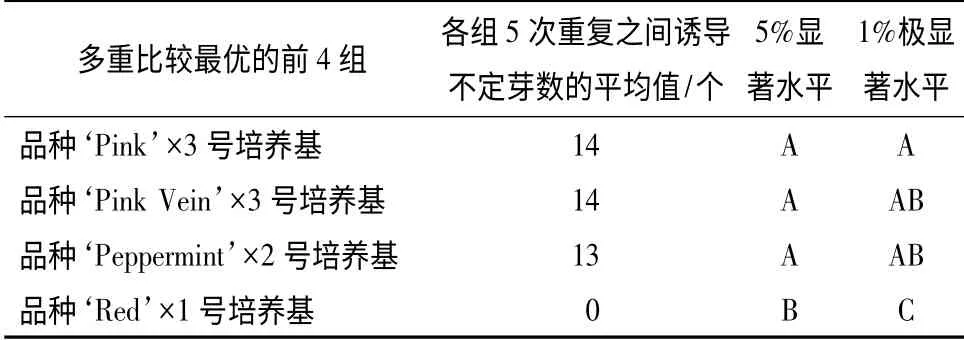
表3 不同激素质量浓度与不同矮牵牛品种不定芽诱导二因素多重比较

图3 4 个矮牵牛品种叶片在各自的最适培养基中培养25 d(A)和30 d(B)时不定芽的诱导情况
由图3可以看出,4 个矮牵牛品种在各自的最适诱导培养基中培养25 d 时,各个矮牵牛品种不定芽诱导的频率没有明显差异(图3A),但是当诱导时间延长至30 d 时,可以明显地发现品种‘Pink’与其他3 个品种之间的差别(图3B)。品种‘Pink’叶片诱导的不定芽成簇增加,不定芽诱导频率明显高于其他3 个品种的。
2.1.3 不同激素质量浓度与品种间因素对矮牵牛不定芽诱导的影响
根据不同激素质量浓度下不同品种矮牵牛不定芽方差分析(表4)可看出,品种间因素、品种与激素质量浓度间互作因素的概率值均小于0.01,而激素质量浓度间的因素概率值小于0.05 且大于0.01,表明品种因素极显著影响矮牵牛叶片诱导不定芽再生数量,而激素质量浓度显著影响叶片诱导不定芽再生数量。说明品种的不同是影响矮牵牛不定芽再生的关键性因素。
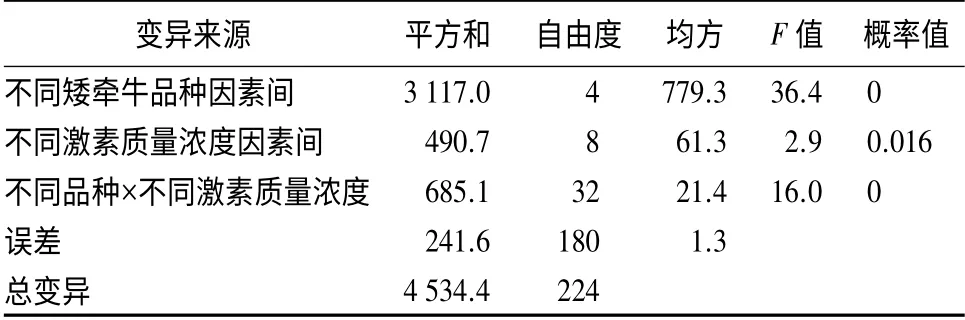
表4 不同激素质量浓度下不同矮牵牛品种不定芽诱导的方差分析
2.2 双丙氨膦对矮牵牛叶片离体培养的影响
以筛选得到的不定芽诱导频率最高的矮牵牛品种‘Pink’为材料,在其最适的3 号培养基中,添加不同质量浓度的Bar 进行梯度筛选,以确定Bar 对该品种叶片分化的影响,结果如表5所示。根据表5中外植体黄化或褐化个数分析,当用3 mg·L-1Bar处理8 d 时,16 个外植体中有8 个叶片外植体的分化产生明显的抑制,而当Bar 质量浓度低于3 mg·L-1时,其抑制时间增加,且抑制效果不明显,高于3 mg·L-1时,虽然抑制时间缩短,但抑制剂质量浓度过高会对不定芽的分化产生不利影响,因此,选择Bar 最适筛选质量浓度为3 mg·L-1。

表5 不同质量浓度双丙氨膦对叶片外植体分化的影响
从表5可看出,在最适品种‘Pink’、最适3 号培养基条件下,添加不同质量浓度的Bar 第10 天(图4),当Bar 质量浓度为3 mg·L-1时,对于离体叶片分化最为敏感,约有一半以上出现黄化现象;到第12 d 时完全抑制离体叶片分化,叶片几乎全部褐化,并且在2 周内死亡。
2.3 壮观霉素最适质量浓度的筛选
以筛选得到的不定芽诱导频率最高的矮牵牛品种‘Pink’为材料,在其最适的3 号培养基中,添加不同质量浓度的Spe 进行梯度筛选,以确定Spe 对该品种叶片分化的影响,结果如表6所示。根据表6中外植体黄化或褐化个数分析,当Spe 质量浓度为100 mg·L-1处理8 d 时,16 个外植体中有7 个的分化受到明显抑制;而当Spe 质量浓度低于100 mg·L-1时,其抑制增加;尽管当Spe 质量浓度高于100 mg·L-1时,抑制时间缩短,但抑制剂质量浓度过高不利于不定芽分化,因此,本研究选择Spe 最适筛选质量浓度为100 mg·L-1。
从表6可看出,在最适品种‘Pink’、最适3 号培养基条件下,添加不同质量浓度Spe 第8 天(图5),当Spe 质量浓度为100 mg·L-1时,对于离体叶片分化最为敏感,约有一半以上出现黄化现象;到第14天时完全抑制离体叶片分化,叶片几乎全部褐化,并且在2 周内死亡。
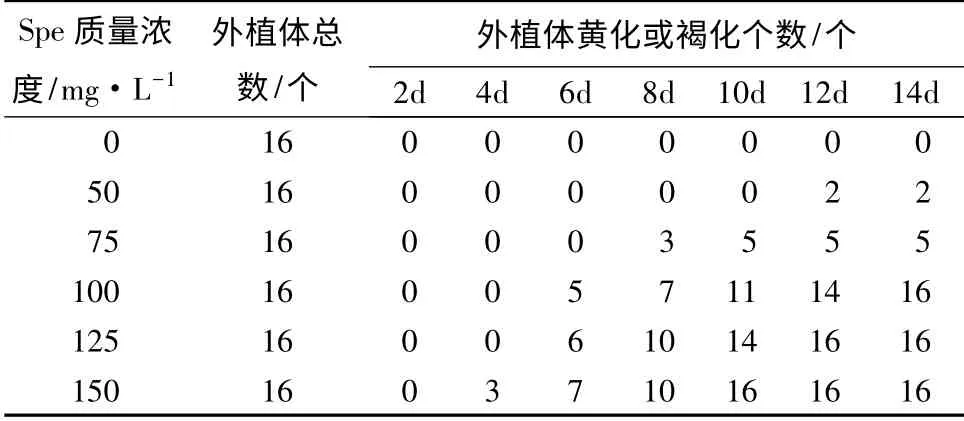
表6 不同质量浓度壮观霉素对叶片外植体分化的影响
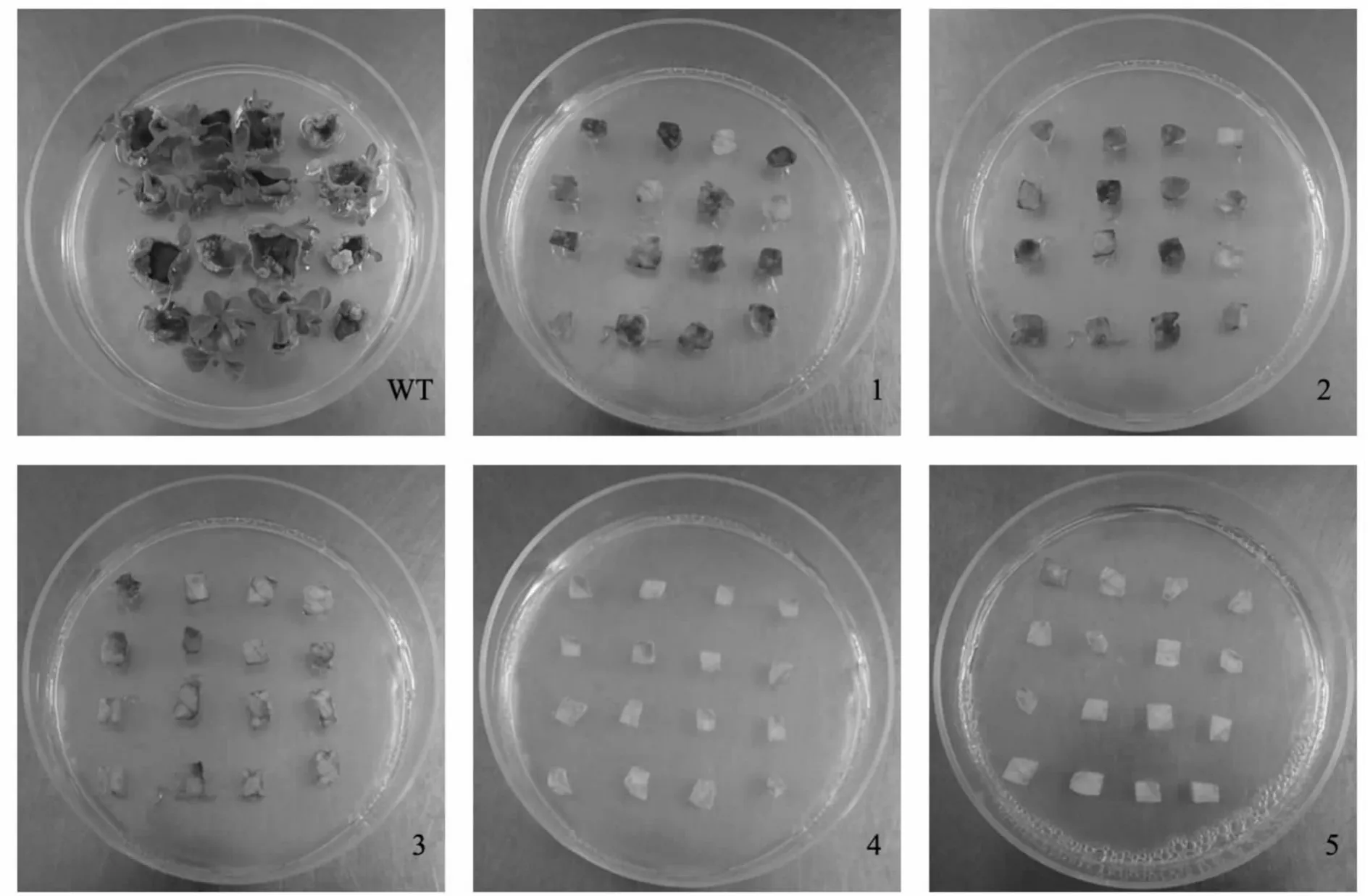
图4 不同质量浓度双丙氨膦筛选第10 天时对品种‘Pink’叶片外植体分化的影响
3 结论与讨论
选择某种植物作为遗传转化的受体材料,该材料是否能够具有理想的诱导和再生频率往往是转化成功的关键[30-31]。高频率诱导不定芽有利于后期转基因阳性苗的筛选,而影响不定芽诱导的关键因素主要是植物的基因型[32-35]。这和本研究的结果相吻合。本研究利用4 种不同花色矮牵牛品种的叶片作为外植体,通过激素种类与质量浓度之间的不同组合,配制培养基诱导不定芽,最终确定品种‘Pink’在质量浓度为1.0 mg·L-16-BA 和质量浓度为0.5 mg·L-1NAA 的培养基中,其不定芽的诱导率最高,诱导率约为87.5%,适合作为后续遗传转化的受体材料;其次,本研究首次利用不定芽诱导频率最高的品种‘Pink’,在最适培养基上分别进行双丙氨膦和壮观霉素对叶片外植体分化的影响,发现当双丙氨膦质量浓度为3 mg·L-1、壮观霉素质量浓度为100 mg·L-1时,分别对叶片的分化产生明显的抑制作用。
许多文献报道,激素是影响矮牵牛不定芽诱导的重要因素[35-37]。本研究借鉴前人在诱导矮牵牛外植体再生时采用的激素种类及质量浓度[38-40],对6-BA、NAA 以及6-BA 与IBA 的不同组合在不定芽诱导率方面的作用进行对比。武术杰等[38]在品种‘Tidal Wave’矮牵牛不定芽诱导中添加3.0 mg·L-16-BA 和0.3 mg·L-1NAA,诱导率为90%,与本试验的诱导率接近。诱导率微小差异的原因可能是由于品种材料的不同造成的。在本试验中,比较品种与激素方差分析结果表明,品种是影响不定芽分化的主要因素。吕晋慧等[34]在不同矮牵牛品种不定芽诱导研究中,添加0.2 mg·L-1NAA 时诱导效果最好,并提出NAA 是诱导不定芽的主导激素。本试验中6-BA、NAA 组合(1~3 号培养基)对不定芽的诱导率均高于6-BA、IBA 组合(4~6 号培养基),也证明了NAA 是矮牵牛不定芽诱导的主导激素。并且本试验对前人提出的各方面影响转基因受体材料不定芽诱导因素(激素种类、激素配比、激素质量浓度、品种材料等)首次进行综合分析,并在此基础上首次尝试添加筛选剂进行梯度试验,从而为叶绿体转化方面的研究提供材料基础。

图5 不同质量浓度壮观霉素筛选第8 天时对品种‘Pink’叶片外植体分化的影响
矮牵牛转基因研究中,绿色荧光蛋白基因gfp和卡那霉素、链霉素等常作为报告基因和抗生素筛选剂[33,39],而利用双丙氨膦和壮观霉素作为筛选剂的报道甚少。Zubko et al.[23]在矮牵牛叶绿体转化中,培养基中壮观霉素的筛选质量浓度为200 mg·L-1,但未进行质量浓度梯度筛选。这和本研究结果不同,原因可能由于品种基因型的差异造成的,也可能是叶绿体转化后转基因材料的抗性发生了变化。本研究在确定双丙氨膦与壮观霉素筛选质量浓度的同时,发现Bar 在低质量浓度筛选时,外植体叶片黄化或褐化效果明显优于Spe 高质量浓度的筛选效果。为了更加高效地筛选出阳性转基因植株,Bar更适合作筛选剂。
在叶绿体基因工程受体材料研究中,存在叶绿体转基因受体材料转化效率较低、叶绿体同质化植株很难获得、宿主植物种类偏少等问题[22-23,41]。本研究中的品种‘Pink’的不定芽诱导率为87.5%,尤其是在后期不定芽分化方面,可以明显的看出其不定芽成簇增长。而目前仅有的一篇关于矮牵牛叶绿体遗传转化体系的报道中,Zubko et al.[23]仅提出激素的质量浓度分别为1.0 mg·L-16-BA 和0.1 mg·L-1IAA,并没有具体说明不定芽诱导情况及诱导率为多少。并且在Zubko et al.[23]关于矮牵牛叶绿体转化及Wang et al.[22]在烟草叶绿体转化中均提到,叶绿体转化明显的限制因素是很难获得同质化材料,需要受体材料具备较高的不定芽诱导频率和再生频率,并且筛选效果明显,进而从中筛选出获得完全同质化叶绿体转基因材料。因此,本试验首次从叶绿体转化的需求方面考虑,对影响不定芽诱导率各方面因素进行全面分析,为矮牵牛叶绿体遗传转化提供最优条件。
综上所述,在本研究开展的4 种矮牵牛品种中,品种‘Pink’不定芽诱导表现最佳,而双丙氨膦最适作为筛选剂,其最适不定芽诱导及筛选培养基为MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA+3 mg·L-1Bar。该结果为今后利用生物技术改良该品种提供了技术支持。
[1] 施雪波.矮牵牛的遗传育种[J].北京园林,1999,7(2):234-239.
[2] 代色平,包满珠.矮牵牛花药培养及植株再生研究[J].亚热带植物科学,2003,32(2):55-57.
[3] 代色平,包满珠.矮牵牛育种研究进展[J].植物学通报,2004,21(4):385-391.
[4] 闫明旭,夏珣,郭余龙,等.矮牵牛育种发展及品种应用[J].南方农业,2009,3(5):93-97.
[5] Engvild D C.Triploid petunias from anther cultures[J].Hereditas,1973,74(1):144-147.
[6] Wagner W,Hess D.Haploid,diploid and triploid plants of Petunia from pollen grains[J].Z P Flanz Bodenkunde,1974,73:273-276.
[7] Malhotra K,Maheshwari S C.Enhancement by cold treatment of pollen embryoid development in Petunia[J].Z P Flanz Bodenkunde,1977,85:177-180.
[8] Mitchell A Z,Hanson M R,Skvirsky R C,et al.Another culture of Petunia:genotypes with high frequency of callus,Root of plantlet formation[J].Z P Flanz Bodenkunde,1980,100:131-146.
[9] 白三平.矮牵牛杂交育种的初步研究[D].武汉:华中农业大学,2006.
[10] 黄善武.新培育的矮牵牛一代杂种[J].农牧产品开发,1998,1(5):3-4.
[11] 唐小敏,齐鸣.矮牵牛杂交一代优势研究初报[J].浙江农业科学,2001,7(3):120-124.
[12] 彭春秀.根癌农杆菌介导的Lpt 基因对矮牵牛遗传转化的研究[D].重庆:西南农业大学,2003.
[13] 李岩,赵德刚.Lpt 基因促进矮牵牛遗传转化效率及热激启动子驱动基因删除[J].基因组学与应用生物学,2011,30(2):145-151.
[14] Horsch R B,Fry J E,Hoffmann N L,et al.A simple and general method for transferring genes into plants[J].Science,1985,227:1229-1231.
[15] Meyer P,Heidmann I,Forkmann G,et al.A new petunia flower color generated by transformation of a mutant with a maize gene[J].Nature,1990,330:677-678.
[16] Davies K M,Bloor S J,Spiller G B,et al.Production of yellow color in flowers:redirection of falconoid biosynthesis in Petunia[J].Plant Journal,1998,13(2):259-266.
[17] 宁露云,李蓓,李佩,等.矮牵牛B-box 型锌指蛋白基因PhBBX8 的克隆与表达分析[J].园艺学报,2014,41(12):2437-2445.
[18] 李颖,刘姬艳,胡江琴,等.矮牵牛转基因体系的建立及转BIO和bio 基因研究初报[J].浙江大学学报:农业与生命科学版,2013,39(1):42-49.
[19] 余勇,葛文东,邹世慧,等.异源表达拟南芥赤霉素2-氧化酶基因对矮牵牛形态发育的影响[J].园艺学报,2014,41(10):2065-2074.
[20] 王宏,蔺经,刘刚,等.etr1-1 在矮牵牛中诱导表达可提高叶片对灰霉病的抗性[J].中国农业科学,2014,47(8):1502-1511.
[21] 王立,张晓薇.矮牵牛转SAG12-IPT 基因的研究[J].重庆理工大学学报:自然科学版,2014,28(9):62-65.
[22] Wang Yunpeng,Wei Zhengyi,Zhang Yuying,et al.Chloroplastexpressed MSI-99 in Tobacco Improves disease resistance and displays inhibitory effect against rice blast fungus[J].International Journal of Molecular Sciences,2015,16(3):4628-4641.
[23] Zubko M K,Zubko E I,van Zuilen K,et al.Stable transformation of petunia plastids[J].Transgenic Research,2004,13(6):523-530.
[24] 周锺信,李明,王英超,等.烟草Bar 基因的转化及其转化体快速检测方法的研制[J].天津农学院学报,2003,10(4):5-12.
[25] 张祥喜,罗林广.水稻抗除草剂Bar 基因的遗传研究初报[J].江西农业学报,2003,15(4):17-20.
[26] 刘小红.Bar 基因的转化及抗草丁膦除草剂转基因玉米植株的获得[J].沈阳农业大学学报,2007,38(1):25-29.
[27] 孙璟晗,李滨胜,崔杰.两种抗生素对甜菜离体叶柄分化的影响[J].中国甜菜糖业,2006,3(9):18-20.
[28] 刘永巨.农杆菌介导的次郎柿ACC 合成酶与ACC 氧化酶反义基因遗传转化研究[D].保定:河北农业大学,2009.
[29] 巩智刚.菊苣叶绿体表达载体的构建及对菊苣和烟草的转化[D].西安:西北大学,2013.
[30] Asako S,Sugane H,Toru T,et al.Introduction of transformed chloroplasts from tobacco into petunia by asymmetric cell fusion[J].Plant Cell Reports,2009,11(28):1633-1640.
[31] 高婧.含抗除草剂标记的水稻叶绿体转化载体的构建及分子鉴定[D].长沙:中南大学,2013.
[32] 陶妹英,贾彩红,徐碧玉,等.直接诱导不定芽的矮牵牛再生体系的建立[J].农业生物技术科学,2006,6(22):62-65.
[33] Anthony J C,Nick W A,Simon C D.Transformation and regeneration of Petunia[J].Petunia,2009,19:395-409.
[34] 吕晋慧,王玄,王媛,等.不同基因型矮牵牛高频再生体系建立的研究[J].山西农业大学学报:自然科学版,2011,31(2):97-103.
[35] 程琳,瞿波,李和平,等.植物叶绿体基因工程研究进展[J].华中农业大学学报,2011,30(2):249-259.
[36] Wu Xiaoqing,Li Xingguo,Zhang Xiansheng.Molecular analysis of hormone-regulated petal regeneration in Petunia[J].Plant Cell Reports,2008,27(9):1169-1176.
[37] Raham S K,Gunaratnam T,Ikuo N,et al.Rol (root loci)gene as a positive selection marker to produce marker-free Petunia hybrid[J].Plant Cell,Tissue and Organ Culture,2010,101(13):279-285.
[38] 武术杰,李邱华.矮牵牛Tidal Wave 品种遗传转化受体再生体系的建立[J].东北林业大学学报,2007,35(4):14-27.
[39] Viola M,Margrethe S,Traud W.Selection of transgenic Petunia plants using the green fluorescent protein(GFP)[J].Plant Cell,Tissue and Organ Culture,2011,107(3):483-492.
[40] 马方芳,岳远征,黄雪,等.‘幻想’矮牵牛遗传转化受体再生体系建立[J].安徽农业科学,2013,41(4):1462-1463,1503.
[41] 崔柳青,李一帆,潘卫东.叶绿体基因工程研究进展[J].生物技术通报,2012,25(6):1-6.
