毛果杨PGR5基因转南林895杨的分子鉴定及表达量1)
2015-03-07王丽娜李开隆
王丽娜 李开隆
(林木遗传育种国家级重点实验室(东北林业大学),哈尔滨,150040)
责任编辑:程 红。
目前杨树转基因的研究主要集中在抗虫、抗除草剂、抗病、降低木质素、抗环境污染以及非生物胁迫等[1-3],对光合作用环式电子传递链中的载体蛋白研究的较少,尤其是将光合与抗逆结合进行木本植物转基因的研究更少[4]。PGR5 在C3植物杨树中的遗传转化是其功能性研究的重要方法,对PGR5 转基因植株的分子鉴定和表达量研究能有效地证明外源基因在转基因植株中的阳性转化效率及基因表达情况,是功能试验的关键环节[5]。笔者经过近一年的遗传转化获得了23 个转基因抗性株系,对这些株系进行PCR、RT-PCR、qRT-PCR 检测,获得12 个在转录水平高表达的转基因株系。
1 材料与方法
1.1 材料
毛果杨(Populus trichocarpa)组培苗由中国科学研究院植物研究所光合中心王佰臣教授提供。转基因所用材料为南林895 杨(Populus×euramericana‘Nanlin895’)组培苗,由上海植物生理生化研究所李莱庚教授提供。
大肠杆菌DH5a 为东北林业大学林木遗传育种国家级重点实验室保存,pCAMBIA1300 原始质粒、GV3101 感受态菌株为中国科学研究院植物研究所王佰臣教授提供,Silica Bead DNA Gel Extraction Kit#K0513 购于北京Thermo 公司,限制性内切酶购于北京NEB 公司,高保真酶KOD-Plus-Neo 购于TOYOBO 公司,RNA 提取试剂盒RNAprep Pure Plant Kit(DP441)购于TIANGEN 公司,反转录试剂盒购于Invitrogen 公司,克隆载体使用的北京全式金公司的pEASY-Blunt Simple Cloing Kit,TRANS2KTMDNA Marker 购于全式金公司。
1.2 方法
1.2.1 普通PCR 检测PGR5 基因
对23 个抗性株系提取总DNA,设计特异引物进行PCR 扩增。PCR 反应扩增条件为:94 ℃预变性5 min,94 ℃、1 min,60 ℃、1 min,72 ℃、1 min,35个循环,最后72 ℃延伸10 min,PGR5 基因产物大小为1 000 bp,反应产物用1.2%的琼脂糖电泳进行检测[6-8]。
采用天根专门针对杨树多糖多酚特点的RNA提取试剂盒(RNAprep Pure Plant Kit)提取南林895 杨总RNA,利用Invitrogen 的反转录试剂盒(C28025-032)反转cDNA,采用特异性引物进行PCR 扩增[9]。
1.2.2 实时荧光定量PCR 检测
鉴于内参基因在实时荧光定量PCR 中的重要作用,从内参基因的选择、常用内参基因的特点、应用内参基因组合的优越性和评价内参基因稳定性等几方面选择适合杨树的Actin 作为内参基因[10-12],并设计适合实时荧光定量PCR 引物,引物序列见表1。在荧光定量PCR 管(国盛公司)中加入10 μmol·L-1正向引物和反向引物各0.4 μL,全式金PCR Master Mix(北京全式金SYBR Green Realtime PCR Master Mix)10 μL。各反应管中加入待测样品cDNA 各1 μL,总反应体系为20 μL,每个样品做3 个平行重复。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,55℃退火30 s,40 个循环。然后进行55~95 ℃的熔解曲线分析,完成上述步骤后,把加好样品的定量PCR 专用反应管放入real- time quantity PCR仪[13]。

表1 实时荧光定量表达量检测所需引物序列及扩增片段
2 结果与分析
2.1 转基因杨树DNA 水平检测
选择生长良好的转PGR5 基因的生根苗,分别对23 株转基因植株进行叶片基因组DNA 的提取和PCR 检测,同时以p1300RD29A-PGR5 质粒作为阳性对照,以非转基因植株南林895 杨为阴性对照(图1),PCR 扩增产物经1.2%琼脂糖凝胶电泳检测,在紫外照射下拍照,在约1 000 bp 处出现一条特征条带,与预期的PGR5 基因大小一致,而在阴性对照的泳道上未发现该特征带,这初步证明PGR5 基因已经整合到南林895 杨基因组中[14]。
2.2 转基因杨树RNA 水平检测
转基因杨树DNA 检测结果说明PGR5 基因已插入杨树基因组中,为检测其转录水平的表达,提取12 个阳性苗株系的叶片总RNA,提取的RNA 溶于35 μL RNase-free Water 中,取5 μL RNA 溶液点样,经1.0%的琼脂糖凝胶电泳,在紫外下拍照的结果见图2。从图2可以清晰的看到18 S 和28 S 的两条带,说明RNA 提取质量完好,无污染未降解,可以进行下游试验。
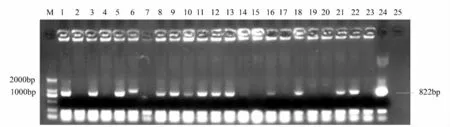
图1 转PGR5 基因的PCR 检测结果
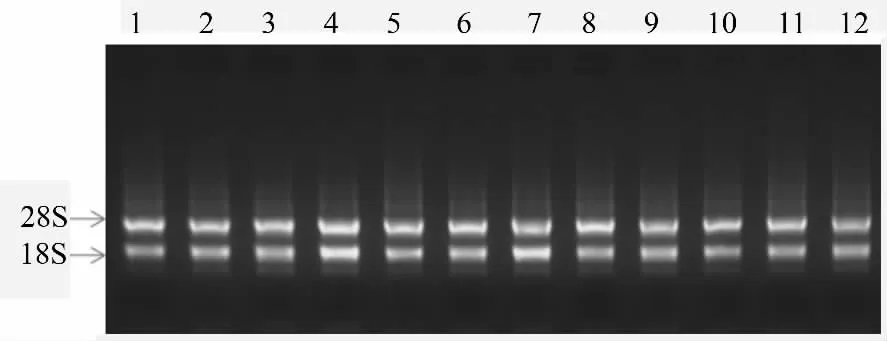
图2 12 株阳性转PGR5 基因植株叶片总RNA
将检测的完整的RNA 反转录为cDNA[15],用PGR5 特异性引物检测,以p1300RD29A-PGR5 质粒作为阳性对照,结果如图3所示,1~12 泳道均扩增出特异性条带,与阳性质粒对照(CK+)相一致,而阴性对照(CK-)并未扩增出该特异性条带,说明目的基因已经整合到了南林895 杨基因组中并在转录水平表达[16-18]。
2.3 PGR5 基因相对表达量
以Actin 作为内参基因,对12 个转PGR5 基因样本的表达情况进行了实时荧光定量PCR 检测,结果表明,12 个样本均有不同程度表达,PGR5-M5 样本表达量最高,是野生型的20 倍,PGR5-M11 约10倍,PGR5-M1、PGR5-M2、PGR5-M3、PGR5-M9 的表达量为6~10 倍,PGR5-M6、PGR5-M7、PGR5-M8的表达量均在5 倍以下,PGR5-M4 样本表达量最低,约是野生型的2 倍。
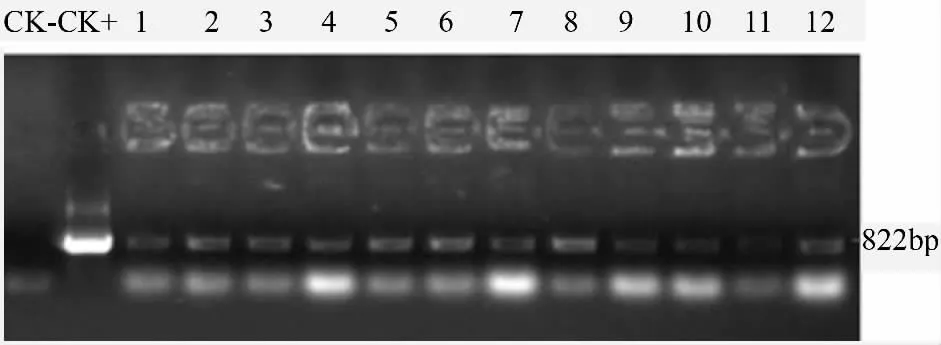
图3 转PGR5 基因植株的RT-PCR 电泳检测结果
3 结束语
本研究采用农杆菌介导的光下诱导不定芽的方法对PGR5 进行遗传转化,用普通PCR 和RT-PCR对转化株系进行了检测和筛选,获得了12 株转基因阳性苗;实时荧光定量PCR 表达量检测结果表明,转PGR5 基因在叶片中均高表达,最高表达量是野生型的20 倍,PGR5-M5、PGR5-M11 样本经多次实时荧光定量PCR 重复表达稳定并高表达;通过遗传转化条件的优化及潮霉素筛选获得了一批转PGR5基因的南林895 杨植株,并准备对转基因植株进行进一步的功能鉴定。
[1] 白亚蒙.大田试验转基因杨树无性系的抗虫性研究[D].南京:南京林业大学,2004.
[2] 周陈力.杨树转AtGolS2 和SRK2C 基因的遗传转化研究[D].南京:南京林业大学,2010.
[3] 田晓明,谭晓风.转基因杨树的研究进展及展望[J].湖南林业科技,2009,36(2):71-73,85.
[4] 马瑞.早粳稻空育131 耐障碍性冷害基因OsRGR5 的克隆[D].哈尔滨:黑龙江大学,2014.
[5] 敖金霞,高学军,曲波,等.转基因大豆、玉米和水稻外源基因检测通用标准分子的构建[J].中国农业大学学报,2008,13(6):19-24.
[6] 杜春芳,李润植,刘惠民,等.转基因植物的表型变异、分子检测与遗传分析[J].生物技术通讯,2003,14(5):422-427.
[7] Deprez R H L,Fijnvandraat A C,Ruijter J M,et al.Sensitivity and accuracy of quantitative real-time polymerase chainreaction using SYBR green I depends on cDNA synthesis conditions[J].Analytical Biochemistry,2002,307:63-69.
[8] Taverniers I,Windels P,Vaïtilingom M,et al.Event-specific plasmid standards and real-time PCR methods for transgenic Bt11,Bt176,and GA21 maizeand transgenic GT73 canola[J].J Agric Food Chem,2005,53(8):3041-3052.
[9] 李义良.转基因杨树的分子检测及抗逆性评价[D].北京:北京林业大学,2008:3-25.
[10] 袁伟,万红建,杨悦检,等.植物实时荧光定量PCR 内参基因的特点及选择[J].植物学报,2012,47(4):427-436.
[11] Dheda K,Huggett J F,Bustin S A,et al.Validation of housekeeping genes for normalizing RNA expression in real-time PCR[J].Biotechniques,2004,37(1):112-119.
[12] Andersen C L,Jensen J L,Ørntoft T F.Normalization of realtime quantitative reverse transcription-PCR data:a model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J].Cancer Res,2004,64(15):5245-5250.
[13] 赵敬贤,李娟,严兴荣,等.FABP4 转基因牛的分子生物学鉴定[J].中国农业科学,2014,47(24):4895-4903.
[14] 宫本贺.转基因苎麻的分子检测和抗虫性鉴定[D].北京:中国农业科学院,2010:10-28.
[15] 陈红敏.抗逆、抗病转基因小麦的分子检测及抗性鉴定[D].杨凌:西北农林科技大学,2010:20-39.
[16] 杜建中,孙毅,郝目瞿山,等.抗玉米丝黑穗病转基因株系的分子检测及抗病株系选育[J].华北农学报,2006,21(5):99-104.
[17] 林秀艳,陆续,沈乾,等.分子检测技术在转基因药用植物研究中的应用[J].上海交通大学学报:农业科学版,2011,29(1):94-98.
[18] 朱英,刘永翔,黄永会,等.分子检测技术在转基因植物中的研究概况[J].种子,2013,32(4):45-49.
