紫杉醇脂质体联合顺铂治疗中晚期肺鳞癌的疗效评价
2015-03-07作者单位201318上海上海市浦东新区周浦医院呼吸科
作者单位:201318 上海,上海市浦东新区周浦医院呼吸科
李晓宁,周 超,魏 丽
紫杉醇脂质体联合顺铂治疗中晚期肺鳞癌的疗效评价
作者单位:201318 上海,上海市浦东新区周浦医院呼吸科
李晓宁,周超,魏丽
[摘要]目的比较紫杉醇脂质体联合顺铂与吉西他滨联合顺铂一线治疗中晚期肺鳞癌的临床疗效及毒副作用。方法62例Ⅲ/Ⅳ期肺鳞癌患者随机分为观察组和对照组,每组31例。观察组给予注射用紫杉醇脂质体175 mg/m2和顺铂75 mg/m2治疗,对照组给予注射用吉西他滨1000 mg/m2和顺铂75 mg/m2治疗,两组均是21 d为1个治疗周期,治疗2个周期后评价其临床疗效及毒副作用。结果治疗后两组肺部原发灶的治疗有效率及疾病控制率间均无明显差异(P>0.05),观察组区域转移淋巴结治疗有效率和疾病控制率分别为45.2%和90.3%,均显著高于对照组(P<0.05);观察组无进展生存期(PFS)为8.0个月,明显高于对照组的5.0个月(P<0.05);两组主要毒副反应均主要是血液学毒性和胃肠道反应,其中观察组血小板降低及胃肠道反应的发生率显著低于对照组(P<0.05)。 结论紫杉醇脂质体联合顺铂治疗中晚期肺鳞癌疗效确切,毒副反应患者可耐受,对于伴有区域淋巴结转移的患者,该方案可获得更高的无进展生存期。
[关键词]紫杉醇;脂质体;吉西他滨;顺铂;肺癌;疗效
肺癌占全部恶性肿瘤的首位,其中80%以上为非小细胞肺癌[1]。以吉西他滨或紫杉醇为代表的第三代化疗药物联合铂类的二联化疗能使患者明显受益,已成为当前一线治疗中晚期非小细胞肺癌的标准方案[2]。脂质体作为一种新型的药物载体,具有有效延长药物半衰期、增强药物靶向性、降低药物不良反应等优点[3]。本研究旨在观察比较紫杉醇脂质体联合顺铂与吉西他滨联合顺铂治疗中晚期肺鳞癌的临床疗效及毒副作用,为中晚期肺鳞癌化疗方案的选择提供依据。
1资料与方法
1.1病例资料以我科2010年1月~2013年1月收治的62例肺鳞癌患者作为研究对象,研究方案通过医院医学伦理委员会批准同意。入选患者纳入标准:(1)经病理组织学或细胞学确诊为肺鳞癌,(2)TNM分期Ⅲ/Ⅳ期,不能手术;(3)根据WHO实体肿瘤疗效评价标准,胸部影像学检查提示至少有1处影像学可测量或可评估病灶;(4)预计生存期≥3个月,至少完成2个周期以上化疗。所有患者按入院顺序编号,采用随机数字表法分观察组和对照组,每组31例。观察组男性18例,女性13例,年龄31~75(56.3±5.4)岁。对照组男性20例,女性11例,年龄30~76(55.9±5.6)岁。两组在年龄、性别、TNM分期等方面未见明显差异(P>0.05),具有可比性。患者及家属均签署知情同意书。
1.2方法观察组给予注射用紫杉醇脂质体(南京绿叶思科药业有限公司,国药准字H20030357)175 mg/m2,加入5%葡萄糖液500 ml中静脉滴注3 h,d1;给予注射用顺铂(齐鲁制药有限公司,国药准字H37021357)75 mg/m2,加入生理盐水500 ml中静滴,d1。对照组给予注射用盐酸吉西他滨(南京正大天晴制药有限公司,国药准字H20093403)1000 mg/m2,加入生理盐水100 ml中静滴(30 min内),d1、d8;顺铂用法及剂量同观察组。两组用药前30 min均给予苯海拉明50 mg肌注,西咪替丁400 mg静注,观察组同时给予地塞米松5 mg静脉注射,对照组给予地塞米松20 mg口服,以减轻变态反应。两组均是21 d为1个治疗周期。
1.3观察指标采用GE公司64排螺旋CT及图像处理系统,对患者治疗前后进行胸部增强扫描,由放射科两名经验丰富专家进行阅片。根据图像后处理系统重建图像,测量肿瘤瘤体最大相长径及垂直径长度,观察计数并测量纵隔淋巴结大小。
1.4疗效评价标准治疗两个周期结束后1个月评价疗效。参照WHO实体瘤疗效评价标准,肺原发灶治疗疗效分为完全缓解(CR):肿瘤瘤体完全消失,且维持>4 w;部分缓解(PR):两最大相垂直径乘积缩小≥50%,无新发病灶出现;稳定(SD):肿瘤两最大相垂直径乘积缩小<50%,增大≤25%,无新发病灶出现;进展(PD):肿瘤肿瘤两最大相垂直径乘积增大≥25%或出现新发肿瘤病灶。
区域淋巴结治疗疗效评价标准:CR:纵隔所见每个淋巴结短径均<10 mm;PR:可见短径>10 mm淋巴结,同一解剖部位淋巴结最大相垂直径乘积缩小≥50%;SD:可见短径>10 mm淋巴结,同一解剖部位淋巴结最大相垂直径乘积缩小<50%,增大≤25%;PD:可见短径>10 mm淋巴结,同一解剖部位淋巴结最大相垂直径乘积增大≥25%。有效率(RR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
毒副反应参照美国国立癌症研究所(NCI-CTC3.0)标准进行评价。
1.5统计学处理应用SPSS 18.0统计软件进行分析,计数资料以例和率的形式表示,采用χ2检验,无进展生存期(PFS)分析采用Kaplan-Meiea分析,以P<0.05为差异有统计学意义。
2结果
2.1临床疗效治疗后两组肺部原发灶的治疗有效率及疾病控制率间均未见明显差异(P>0.05),观察组区域转移淋巴结治疗有效率和疾病控制率分别为45.2%和90.3%,均显著高于对照组(P<0.05),见表1。
2.2生存分析利用生存函数比较两组治疗后的PFS,结果显示,观察组和对照组患者的中位PFS分别为8.0个月和5.0个月,差异具有统计学意义(χ2=4.900,P<0.05)见图1。
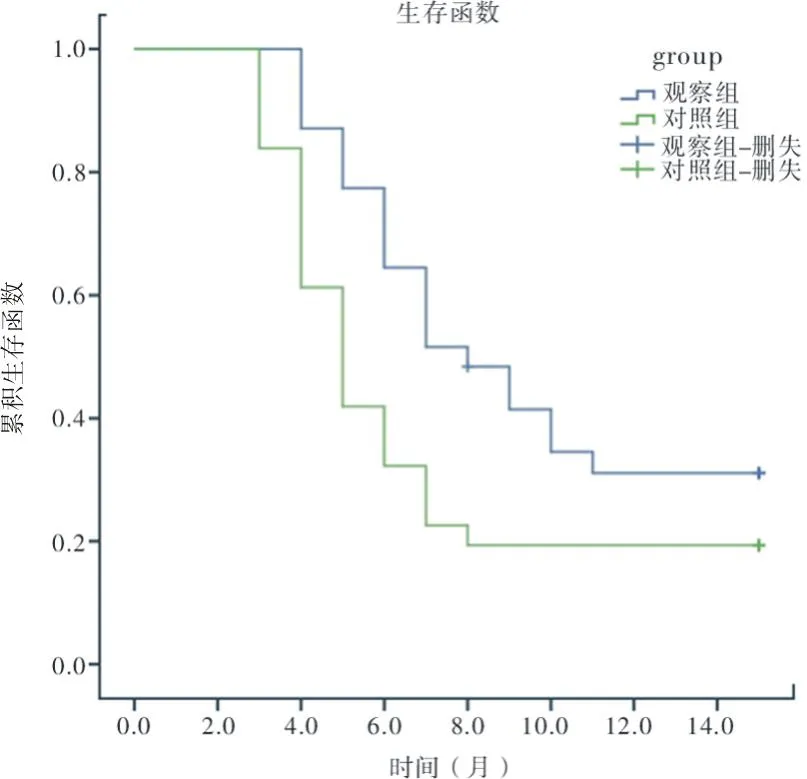
图1 两组患者PFS比较
2.3毒副反应两组治疗过程中,主要毒副反应为血液系统毒性和胃肠道反应,血液系统毒性主要表现为白细胞及中性粒细胞减少、贫血以及血小板降低。观察组血小板降低及胃肠道反应的发生率显著低于对照组(P<0.05),其他毒副反应组间比较未见明显差异(P>0.05),见表2。
3讨论
紫杉醇是一种广谱抗癌药物,在水中几乎不溶解,目前临床应用的紫杉醇溶媒易致敏,部分患者应用后会产生严重的过敏反应,发生率高达20% ~30%[4]。为预防和减少过敏反应发生,临床上在用药前常须需先给予大剂量地塞米松和H2受体拮抗剂,但仍有约5%患者出现程度不等的过敏反应。Zhang等[5]的研究发现,紫杉醇脂质体在大鼠血液中的血浆浓度-时间曲线下面积明显高于紫杉醇,但分配系数却明显低于后者,认为同等剂量下紫杉醇脂质体消除半衰期明显延长,而组织毒性明显降低。Mielke等[6]对既往紫杉醇治疗失败的实体瘤患者应用紫杉醇脂质体200 mg/(m2·w),疗程3 w,患者疾病控制率可达59%,且患者具有良好的耐受性。

表1 两组临床疗效比较[例(%),n=31]
注:与对照组比较,①P<0.05

表2 两组治疗过程中的毒副反应比较(例,n=31)
注:与对照组比较,①P<0.05
吉西他滨是嘧啶类细胞周期特异性抗代谢类药物,其主要作用于细胞周期的G1期和S期,使肿瘤细胞DNA链合成停止,进而促使肿瘤细胞DNA链断裂、细胞死亡[7]。临床常与铂类联合应用,以提高治疗疗效,但二者联合应用也显著增加了两者的细胞毒性[8]。邵克锐等[9]的研究还发现,吉西他滨联合奈达铂方案对肺鳞癌患者具有较好的临床疗效,主要的毒性反应为血液学毒性和胃肠道反应,而紫杉醇对肺腺癌则更敏感。
目前,国内外对非小细胞肺癌化疗方案的研究较多,但针对肺鳞癌,尤其是中晚期肺鳞癌的化疗方案却鲜见报道。本研究探索了紫杉醇脂质体联合顺铂方案在治疗中晚期肺鳞癌中的应用价值。结果显示,两组肺部原发灶的治疗有效率及疾病控制率间未见明显差异,这与杨静翔等[10]报道的结果基本一致。但观察组区域转移淋巴结治疗有效率和疾病控制率均显著高于对照组,提示紫杉醇脂质体联合顺铂方案在缩小区域转移淋巴结方面具有较好疗效。由于本研究随访时间有限,考虑到总生存时间受后续治疗及其他混杂因素影响,本研究仅对两组进行了PFS统计分析。观察组中位PFS为8.0个月,明显长于对照组5.0个月,说明紫杉醇脂质体联合顺铂在中晚期肺鳞癌患者的治疗中具有较好临床疗效。
肿瘤患者治疗前常担心化疗的严重毒性反应会造成生活质量下降,加速病情恶化,甚至死亡。因此,选择疗效确切、毒性反应较轻,尤其是患者主观感觉上较轻的方案,更易于患者接受,提高患者治疗的依从性[11]。本研究结果证实紫杉醇脂质体联合顺铂具有相对较好的耐受性。Fetterly等[12]一项Ⅰ期临床研究显示,紫杉醇脂质体剂量在275mg/m2时仍具有较好的耐受性,并主张对于中晚期癌症患者可提高紫杉醇脂质体剂量至275 mg/m2水平,以提高治疗疗效。
总之,对于伴有区域淋巴结转移的中晚期肺鳞癌患者,紫杉醇脂质体联合顺铂不仅对原发灶具有良好的治疗疗效,而且在缩小区域转移的淋巴结方面也具有满意疗效,可能更有益于中晚期肺鳞癌患者获益。由于本研究样本量和随访时间有限,其疗效有待进一步大样本随机对照研究进行证实。
【参考文献】
[1]方楚玲,郭琳琅.miRNA对肺癌化疗耐药调控研究进展[J].中华肿瘤防治杂志,2014,21(1):72-76.
[2]Goffin J,Lacchetti C,Ellis PM,et al.First-line systemic chemothe-rapy in the treatment of advanced non-small cell lung cancer:a systematic review[J].J Thorac Oncol,2010,5(2):260-274.
[3]邓超,何燕,胡春宏.紫杉醇脂质体治疗非小细胞肺癌40例近期疗效及安全性分析[J].肿瘤防治研究,2011,38(3):315-318.
[4]Price KS,Castells MC.Taxol reactions[J].Allergy Asthma Proc,2002,23(3):205-208.
[5]Zhang XN,Tang LH,Gong JH,et al.An alternative paclitaxel self-emulsifying microemulsion formulation:preparation,pharmacokinetic profile,and hypersensitivity evaluation[J].PDA J Pharm Sci Technol,2006,60(2):89-94.
[6]Mielke S,Sparreboom A,Mross K.Peripheral neuropathy:a persisting challenge in paclitaxel-based regimes[J].Eur J Cancer,2006,42(1):24-30.
[7]Fury MG,Sherman E,Haque S,et al.A phase Ⅰ study of daily everolimus plus low-dose weekly cisplatin for patients with advanced solid tumors[J].Cancer Chemother Pharmacol,2012,69(3):591-598.
[8]Kobayashi S,Ueno M,Ohkawa S,et al.Renal toxicity associated with weekly cisplatin and gemcitabine combination therapy for treatment of advanced biliary tract cancer[J].Oncology,2014,87(1):30-39.
[9]邵克锐,王建春.吉西他滨与紫杉醇联合奈达铂治疗晚期非小细胞肺癌的疗效及毒性反应观察[J].第三军医大学学报,2012,34(14):1450-1453.
[10]杨静翔,罗虎,周向东.紫杉醇脂质体对比吉西他滨联合顺铂一线治疗中晚期肺鳞癌的疗效评价[J].第三军医大学学报,2014,36(2):140-143.
[11]汤维娟,王毅欣,徐燕.国外有关癌症病人症状负担的研究进展[J].护理研究,2010,24(9C):2447-2449.
[12]Fetterly GJ,Grasela TH,Sherman JW,et al.Pharmacokinetic/pharmacodynamic modeling and simulation of neutropenia during phase Ⅰ development of liposome-entrapped paclitaxel[J].Clin Cancer Res,2008,14(18):5856-5863.
Evaluation of curative effects of paclitaxel liposome combined with cisplatin in treatment of advanced pulmonary squamous cell carcinoma
Li Xiaoning,Zhou Chao,Wei LiDepartment of Respiration,Zhoupu Hospital of Shanghai,Pudong New District,Shanghai,201318,China
[Abstract]ObjectiveTo compare the curative effects and adverse reaction of paclitaxel liposome combined with cisplatin and that of gemcitabine combined with cisplatin as the preferred method in treatment of advanced pulmonary squamous cell carcinoma.MethodsTotal 62 patients with stage Ⅲ/Ⅳ pulmonary squamous cell carcinoma were randomly divided into the observation group and control group(n=31,respectively).The observation group was administered with Paclitaxel liposome(175 mg/m2)and cisplatin(75 mg/m2)for injection,and the control group was administered with gemcitabine(1000 mg/m2)and cisplatin(75 mg/m2)for injection.For both groups,the course of treatment was 21 days.After two weeks of treatment,the curative effects and adverse reaction were evaluated.ResultsAfter the treatment,there were no significant differences in the treatment effectivenesss of pulmonary primary focus and control rate of disease between the two groups(P>0.05);the treatment effectivenesss of regional lymph node metastasis and control rate of disease of the observation group were 45.2% and 90.3%,respectively,which were significantly higher than those in the control group(P<0.05);the progression-free survival period(PFS)in observation group was eight months,significantly longer than that in the control group of five months(P<0.05).In both groups,the main adverse reactions include hematological toxicity and gastrointestinal reaction,in which the occurrence rates of decreased platelet counts and gastrointestinal reaction in the observation group were significantly lower than those in the control group(P<0.05).ConclusionPaclitaxel liposome combined with cisplatin has definite curative effects on advanced pulmonary squamous cell carcinoma,and the adverse reaction can be tolerated by the patients.For the patients accompanied with regional lymph node metastasis,the scheme can obtain higher progression-free survival.
[Key words]paclitaxel;liposome;gemcitabine;cisplatin;lung cancer;curative effect
(收稿日期:2014-07-29)
文章编号1004-0188(2015)01-0039-04
doi:10.3969/j.issn.1004-0188.2015.01.015
中图分类号R 713.4
文献标识码A
