黑木耳“黑皮病”病原菌鉴定
2015-03-06刘佳宁马银鹏王玉文张介驰张丕奇
刘佳宁,马银鹏,王玉文,张介驰,张丕奇
(黑龙江省科学院微生物研究所,哈尔滨 150010)
木耳(Auricularia auricular judae)别名黑木耳、光木耳,真菌学分类属担子菌纲、木耳目、木耳科。其担子果胶质,圆盘形或耳形,新鲜时软,干后收缩,色泽黑褐,质地柔软,味道鲜美,营养丰富,是强身健体的理想食品。它还具有很高的药用价值,是世界公认的高营养保健食品[1]。我国的栽培规模逐年扩大,木耳产业已经成为东北部分地区的主导产业,在农业总产值中占有较大比重。
近年来,东北地区特别是黑龙江东宁、尚志、伊春和吉林蛟河等地区的栽培面积不断扩大,部分地域由一年一季生产变为春秋两季生产。但由于栽培环境的恶化,连年重复生产的老耳房,环境灭菌的次数和间隔时间达不到要求,造成在高温、阴暗、潮湿、通风不良、卫生条件差的环境条件下大量生产,极易发生杂菌侵染性病害,致使木耳减产,严重影响收益。
近期在以上地区就发生了一种高危侵染性病害,其发病特点为病原菌生长迅速,在接菌后7~10d,长覆盖菌袋表面,整个菌袋表面迅速变为黑色,在菌袋与培养基中间形成一层致密的黑色菌丝覆盖层,并伴有大量黑色的凸起产生。该病具有发病快、传播广的特点。生产第一线种植户将这种病害称之为“黑木耳黑皮病”。目前,关于该病害病原菌的分类地位、危害状况、遗传分化状况等情况均未见报道,更缺乏对该病害的防治方法。为防止该病害蔓延,减少农民收益损失,迫切需要对该病害进行深入而系统地研究,夯实基础,为研发出适合的综合防治方法提供依据。
从4个木耳主产区采集多个病原样品,根据科赫法则的基本步骤进行了一系列分离培养、病原菌回接等试验,确定病原菌为一种黑色腐生真菌,并且通过形态观察比对,确定了该病原菌的分类地位,利用I TS序列分析,进一步对该菌株进行鉴定及遗传多样性分析。
1 材料与方法
1.1 试验材料
试验所用病原菌菌种由病原地采集获得。对照试验所用木耳菌种为“黑29”,由黑龙江省科学院微生物研究所提供。I TS序列扩增所用引物为I TS1-F:5′-CTT GGTCATTTAGAGGAAGTAA-3′和ITS4-B∶
5′-CAGGAGACTTGTACACGGTCCAG-3′,引物由大连宝生物有限公司合成。试验用培养基配方为:第一,改良PDA培养基,配方为:水1000m L、马铃薯200g、葡萄糖 20g、琼脂 20g、磷酸二氢钾 3g、硫酸镁1.5g。第二,改良P D液体培养基,配方为:水1000m L、磷酸二氢钾3g、硫酸镁1.5g、马铃薯200g、葡萄糖20g。第三,三级种配方为:木屑78%、麦麸20%、石膏1%、石灰1%。
1.2 方法
1.2.1 病害调查与病原菌菌株获取
采集具有典型病害特征的样品(见图1)进行分离培养,获取纯病原菌菌株。该病典型发病特征为:初期菌丝洁白生长迅速,7~10d,长满袋(袋规格为16cm×33cm)。长满袋后7~10 d菌袋变为黑色,于菌袋与培养基之间形成大量黑色凸起。大约20~24d左右,在黑色凸起处产生黄色丝状物质并随风传播。菌袋内黑木耳菌丝由于没有足够生长空间,造成产量剧减甚至绝产。将分离出的病原菌暂时定名为未知真菌unknownfungi,以便于后期应用分子生物学方法进行数据分析使用。4d,用挑取适量菌丝在显微镜下观察照相并测量。用刀片切取真子座型载孢体截面观察结构和其内部的分生孢子形态。

图1 黑木耳“黑皮病”病害样品图Fig.1 Sample of black skin of Auricularia auricular
1.2.4 菌丝体培养及DNA提取
将病原菌菌种接种于液体P D培养基中,25℃培养3~5 d,收集菌丝,滤纸吸干后冷冻保存。采用CTAB法提取DNA,DNA提取物于-20℃冰箱贮藏备用。
1.2.5 I TS序列提取、对比与分析
对未知真菌unknownfungi进行ITS序列的扩增。引物为PCR反应在Gene Amp PCRSystem 9700 PCR仪上进行扩增,20μL的反应体系内各种成分反应浓度(见表1)。扩增程序为:94℃预变性5min,94℃变性 30s,56 ℃退火 45 s,72 ℃延伸 2min,30 个循环,最后在72℃延伸10min,每次反应均设置一个空白对照,以去离子水代替模板,以排除系统误差。PCR扩增产物用1.0%的琼脂糖(含0.5μg/m LEB)电泳,在U VP凝胶成像系统下成像保存。测序由上海生物工程有限公司完成。
试验选用样本正反向测序。用BioEdit的ClustalW分别进行序列对位排列分析,对有N值和计算机误读的个别剪辑进行人工校对。对获得的序列进行序列分析。将测得的I TS序列在Gene Bank进行BLAST,从GeneBank核酸序列数据库进行比对,获得相似率较高、亲源关系较近的物种,研究其中的系统发育关系。采用ME G A4.0系统发育分析软件中的UPGMA法构建系统进化树[2,3]。
1.2.2 回接试验复制病害典型特征
根据科赫式法则进行回接试验,将分离出的真菌分别与黑木耳菌进行回接试验,定期观察,记录发病情况。同期将病原菌unknownfungi和黑木耳“黑29”转入养基配方、体积、重量、接菌时间、培养时间及培养条件等完全相同的菌袋中,并保留空白菌袋做对照。经过2w的培养以后,载有病原菌unknownfungi菌袋出现了与病原地所采集样品同样的发病特征,证明病原菌unknownfungi即为黑木耳“黑皮病”的致病菌。
1.2.3 病原菌宏观形态鉴定
1.2.3.1 病原菌菌落形态
用直径为5mm的打孔器沿菌落边缘,打取菌龄一致的菌饼,接种于改良PDA培养基斜面中央,然后于25℃恒温箱中培养。从第3 d开始,每隔24 h测量一次菌落直径,直到菌丝最前端接近平板培养基边缘为止。
1.2.3.2 菌丝、分生孢子及真子座型载孢体形态
将病原菌菌株转接至改良PDA培养基上,培养

表1 ITS序列扩增反应体系表Tab.1 System table of ITS sequence amplified reaction
2 结果与分析
2.1 形态学鉴定
2.1.1 菌落形态
斜面(见图2)内菌丝萌发时为白色,菌落具有发达的菌丝体。在24℃的培养条件下,菌丝长势旺盛,在固体培养基中,菌丝向培养基内深入,在距离表面约1mm厚的区域内形成菌丝层。随着培养时间的延长,菌丝向气相延展,并开始变色,菌丝大量聚集的区域变为深黑色,斜面末端呈黑灰色,后期全部变为黑色。该菌在斜面中只观察到菌丝,未能观察到其他结构。

图2 菌落形态图Fig.2 Aspectgraph of colony
2.1.2 菌丝、分生孢子形态及真子座型载孢体
2.1.2.1 菌丝(见图3-A)
菌丝体初期白色,逐渐变为褐色,后期逐渐变为黑色,呈扩散状生长,有气生菌丝,接种后6d长满直径9 cm平板,生长速度平均为0.75c m/d,菌丝体宽度(2.4)3~7(8.5)μm,有隔,光滑,菌丝体中段有分叉,形成新的菌丝体。
2.1.2.2 真子座型载孢体(见图3-B、C)
真子座型载孢体,黑色,呈球形或近球形,大小为(89)105~260(285)μm×(89)105~260(285)μm,有明显的外壁,外壁厚度(9)11~17(18.5)μm。分生孢子通过分生孢子梗连接于载孢体内壁,顶端无凸起或短小凸起,有顶孔,用于释放分生孢子。
2.1.2.3 分生孢子(见图 3-E、F、G、H)
分生孢子呈椭圆形或亚圆形,表面光滑,两端钝圆,初期无隔,无色,大小为(10.7)14~18(22.7)μm×(7.5)8.2~11(13.7)μm。后期于孢子中间产生一个隔膜,形成二孢结构,且孢子变为褐色或黑色。分生孢子释放以后,形成分生孢子束,分生孢子束肉眼可见,浅黄色或黄色,直径0.4~1.0mm。
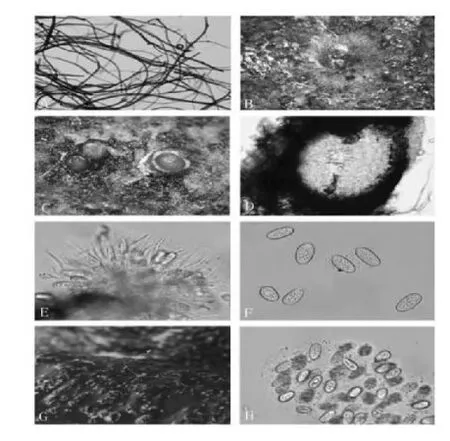
图3 病原菌结构显微观察图Fig.3 Microscopic graph of pathogen
该菌形态特征与已知品种可可毛色二孢菌Lasiodiplodia theobromae基本一致,初步确定该菌株为可可毛色二孢菌Lasiodiplodia theobromae。
2.2 序列分析
2.2.1 I TS扩增结果及分析
I TS-PCR产物电泳结果如图4所示,M ar k er为D L2000,1号泳道为病原菌,2号泳道为去离子水对照。供试菌株的I TS产物大小在500~750 b p,测序结果显示,供试菌株I TS序列为533 b p(见图5)。

图4 ITS产物扩增电泳图Fig.4 Electrophoretogram of ITS products amplified

图5 病原菌ITS序列图Fig.5Sequence diagram of ITS pathogen
2.2.2 I TS序列系统发育分析
用已经获得的病原菌ITS序列在GenBank中比对,与相似度最高的11个不同品种的已知序列建立进化树,各品种序列名称及GenBank号见表2。

表2 毛双孢属Lasiodiplodia(Botryosphaeria为有性阶段)Tab.2 Lasiodiplodia(Botryosphaeria in perfect stage)11个种的ITS序列名称及号码表
由图6可知,各分枝内菌株间的最大遗传距离在0.003 892,最小为0.0000,说明各分枝内菌株的ITS 差异很小,11 个品种具有极强的相似性,但又略有区别,证明所有品种来源于同一个属,即毛双孢属Lasiodiplodia 。其中病原菌(unknown fungi)与已知种Lasiodiplodia theobromae,GenBank 编号EU918707 的序列遗传距离差异为0.0000,经比对其相似度为99.999 %,结合宏观经典分类学数据进一步确定该病原菌为可可毛色二孢菌Lasiodiplodia theobromae。其生物学分类为子囊菌纲Ascomycetes、假球壳目Pleosporales、葡萄座腔菌科Botryosphaeriaceae、毛双孢属Lasiodiplodia、可可毛色二孢菌Lasiodiplodia theobromae。

图6 病原菌(unknown fungi)菌株与毛双孢属Lasiodiplodia 11个种的系统发育树Fig.6 Phylogenetic tree of pathogen strains and 11 species of Lasiodiplodia
3 结论
黑木耳“黑皮病”的病原菌,经过分离纯化、形态鉴定和分子生物学鉴定后,确定为可可毛色二孢菌Lasiodiplodia theobromae。
4 讨论
通过与GenBank中的序列比对,在已公布序列的菌种中,本文中的病原菌菌株与可可毛色二孢菌Lasiodiplodia theobromae遗传距离最近,且相似度最高。结合宏观形态和分子生物学分析结果可以确定该病原菌为可可毛色二孢菌Lasiodiplodia theobromae。本文中可可毛色二孢菌Lasiodiplodia theobromae,是该菌的无性世代,该菌还有异名Botryosphaeria theobromae.和Diplodia gossypina等。该菌的有性型属于子囊菌葡萄座腔菌科Botryosphaeriaceae属,在本次试验中未能观察到。
目前,国内外鲜有可可毛色二孢菌作为黑木耳病害的研究报道,尤其在我国东北黑木耳主产区该病害出现的时间不长,但是污染规模和造成的损失有逐年递增的趋势。随着研究的不断深入,我们也发现该病害如果在黑木耳菌丝成活以后侵染黑木耳菌袋,则不会造成黑木耳绝产。通过拮抗实验发现病原菌与黑木耳菌丝之间有明显的分割线,说明黑木耳菌丝体对该病有一定的抵抗能力,可与其共生,在黑木耳子实体形成期也可获得部分黑木耳子实体,但是整体产量将大幅下降。由于该病原菌与黑木耳菌丝生长、生殖所必须的营养、温度、湿度、pH、水分等基础条件有巨大的交集,因此对可可毛色二孢菌病害的防治造成较大困难,目前只能通过严格控制其进入菌袋,隔绝其接触菌袋内的培养基来防止这类病害的发生。目前缺乏病原菌侵入菌袋后的治疗方法,希望通过后续研究能够找到应对该病害的合理措施。
[1] 李慧蓉.白腐真菌生物学和生物技术[M].北京:化学工业出版社,2005:76-88.
[2] 刘佳宁,宋瑞清.扎龙湿地水生真菌多样性研究[D].哈尔滨:东北林业大学,2008.
[3] 宋瑞清,余江勇,冀瑞卿.四个姬松茸菌株rDNA ITS序列比较[J].林业科技,2007,(03):23-24.
