星点设计法优化盐酸伊托必利分散片处方
2015-03-06王江涛龙连清
岳 莉,王江涛,龙连清,苏 亮
迪沙药业集团,山东威海 264200
星点设计法优化盐酸伊托必利分散片处方
岳 莉,王江涛,龙连清,苏 亮
迪沙药业集团,山东威海 264200
目的:采用湿法制粒工艺制备盐酸伊托必利分散片。方法:以崩解时间、溶出度和混悬系数为评价指标,对辅料用量进行响应面分析法优化设计。结果与结论:处方最优工艺参数:乳糖占44.78%,微晶纤维素占25.75%,交联聚维酮占5.53%。该工艺下样品的崩解时间、溶出度和混悬系数等各指标参数达到较理想结果,符合分散片的质量要求。
盐酸伊托必利;分散片;响应面分析法
盐酸伊托必利(itopride hydrochloride)适用于治疗功能性消化不良,具有多巴胺D-受体拮抗活性和乙酰胆碱酯酶抑制活性,通过两者的协同发挥促胃肠蠕动的作用。此外,由于具有拮抗多巴胺D-受体活性,本品尚有一定的抗呕吐作用。
分散片是一种口服速释剂型,能在水中迅速崩解成均匀的混悬液,具有服用方便、迅速崩解、快速吸收、生物利用度高,尤其适合老、幼和吞咽固体困难的患者服用等特点[1-2],制备工艺简单,能有效降低药物的不良反应。鉴于此,笔者采用星点设计-效应面分析法,优化盐酸伊托必利分散片的处方参数,制备的盐酸伊托必利分散片符合质量标准、性质稳定,增加了用药选择。
1 药品、辅料与仪器
伊托必利原药(修正药业集团柳河制药,批号20130818);伊托必利对照品(国家食药监管总局生物检定所);伊托必利分散片(自制,50 mg/片);参比制剂样品(瑞士雅培制药有限公司,商品名:为力苏誖)。
微晶纤维素、硬脂酸镁、低取代羟丙基纤维素(辽宁奥达制药);交联聚维酮、聚丙烯酸树脂Ⅳ(北京凤礼精求商贸);乳糖(江苏道宁药业);十二烷基硫酸钠(湖南尔康制药);交联羧甲基纤维素钠(德国JRS集团);淀粉(曲阜市天利药用辅料公司);所用试剂均为分析纯。
1260高效液相色谱仪(安捷伦);U-2910双光束紫外可见分光光度计(日立);ML204电子天平(梅特勒-托利多仪器有限公司);HLSH2-6A湿法混合制粒机 (北京航空制造工程研究院);YK-100摇摆式颗粒机(江阴市方圆机械制造有限公司);SYH-5三维运动混合机 (南京鑫飞干燥设备厂);MB35卤素水分测定仪 (上海奥豪斯仪器有限公司);ZP-10旋转式压片机 (国药龙立科技有限公司);YPD-3000C智能片剂硬度测定仪、CJY-2A片剂脆碎度硬度测定仪(上海黄海药检仪器有限公司);ZBS-6G智能崩解试验仪、RC806溶出试验仪 (天津天大天发科技有限公司)。
2 方 法
2.1 处方与制备工艺
盐酸伊托必利、微晶纤维素、乳糖、交联聚维酮、十二烷基硫酸钠和硬脂酸镁均过100目标准筛,混匀后加入适量5%聚丙烯酸树脂Ⅳ的95%乙醇溶液制软材,以22目锦纶筛网制粒,于多功能流化床内50~55℃的温度干燥,20目锦纶筛网整粒,加入外掺的崩解剂及润滑剂,混合均匀,放置密闭容器内,测定颗粒中主药的含量,计算确定片重,压片即可。
2.2 溶出度测定[3]
取供试品,照溶出度测定法(《中国药典》2010年版二部附录ⅩC第一法),以900mL水为溶出介质,转速为100 r·min-1,依法操作,5 min取溶液10 mL;滤过,精密量取续滤液5 mL,置25 mL量瓶中,加水稀释至刻度,摇匀;照紫外-可见分光光度计法(《中国药典》2010年版二部附录ⅣA)在258 nm的波长处测定吸光度。另取盐酸伊托必利对照品适量,精密称定,加水溶解并稀释制成每毫升中约含10 μg的溶液,同法测定,计算溶出量。
2.3 单因素考察
2.3.1 崩解剂的筛选 在保持其他因素不变的情况下,选用6%交联聚维酮、6%低取代羟丙基纤维素及6%交联羧甲基纤维素钠为处方中崩解剂,以交联聚维酮的效果最优,故选择其为该处方中的崩解剂。
2.3.2 稀释剂的筛选 在保持其他因素不变的情况下,选用淀粉、乳糖、微晶纤维素作为处方中的稀释剂,三者在各试验处方中的比例均为70%。以乳糖和微晶纤维素为稀释剂的效果最优,故选择乳糖和微晶纤维素为处方中稀释剂。
2.4 处方用量的优化
2.4.1 星点设计优化[4]在预实验基础上,选用乳糖、微晶纤维素、交联聚维酮为处方辅料,湿法制粒压片。为进一步优化分散片处方中辅料用量,采用星点设计法,以乳糖用量(X1/g)、微晶纤维素用量(X2/g)、交联聚维酮用量(X3/g)为自变量,以分散片崩解时间(Y1/s)、溶出度(Y2/%)及混悬系数(Y3×10-2)为评价指标,根据星点设计原理,每个因素取5个水平,进行线性回归和二项式拟合,评价指标的总评“归一值”(overall desirability,OD),公式如下:
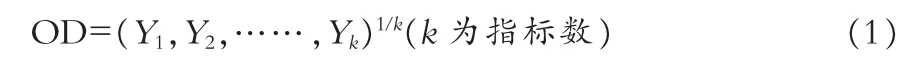
试验的因素和水平结果见表1、表2。
2.4.2 模型建立与方差分析 采用Statistica 6.0统计分析软件对表2数据进行处理,二项式拟合所得模型的R值(0.915)远大于用线性拟合回归所得模型的R值(0.399),故选择二项式(公式2)拟合数据。
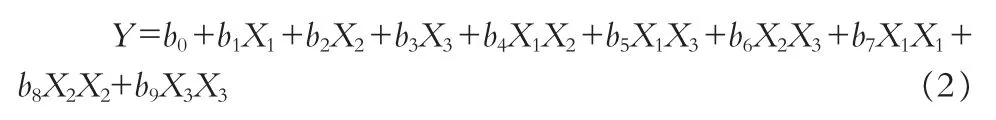
由表3可见,二项式系数b2、b8、b9的P>0.05,拟合显著性不佳。故舍弃b2、b8、b9项重新进行二项式拟合,得公式(3)。公式(3)拟合分析得出整体模型的P值小于0.0001,相关系数R为0.909,表明该二次方程模型极显著。
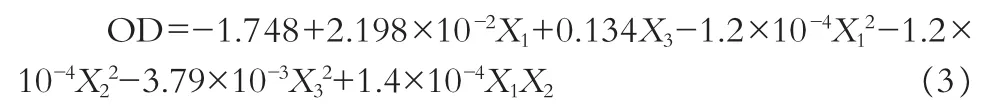
3 结 果
3.1 效应面优化与预测
应用Statistica 6.0软件分别绘制盐酸伊托必利分散片指标与各因素的三维效应面图 (见图1),以此直观反映各因素间的交互作用对OD值的影响。软件综合分析得处方用量最优值为:乳糖用量为144.48 g,微晶纤维素用量83.06 g,交联聚维酮用量17.83g,即在处方中所占的比例分别为乳糖占44.78%,微晶纤维素占25.75%,交联聚维酮占5.53%。
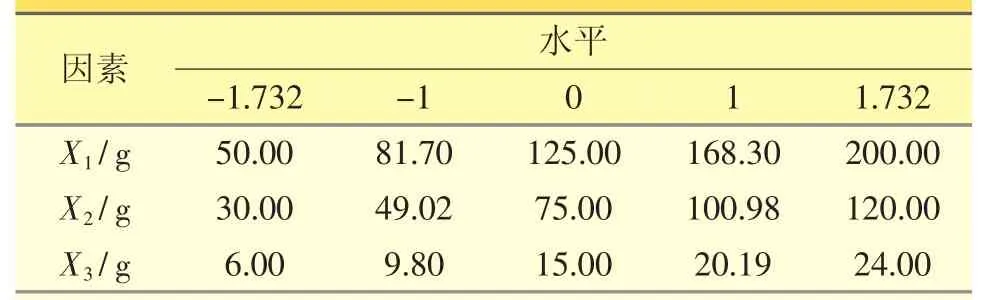
表1 星点设计因素水平
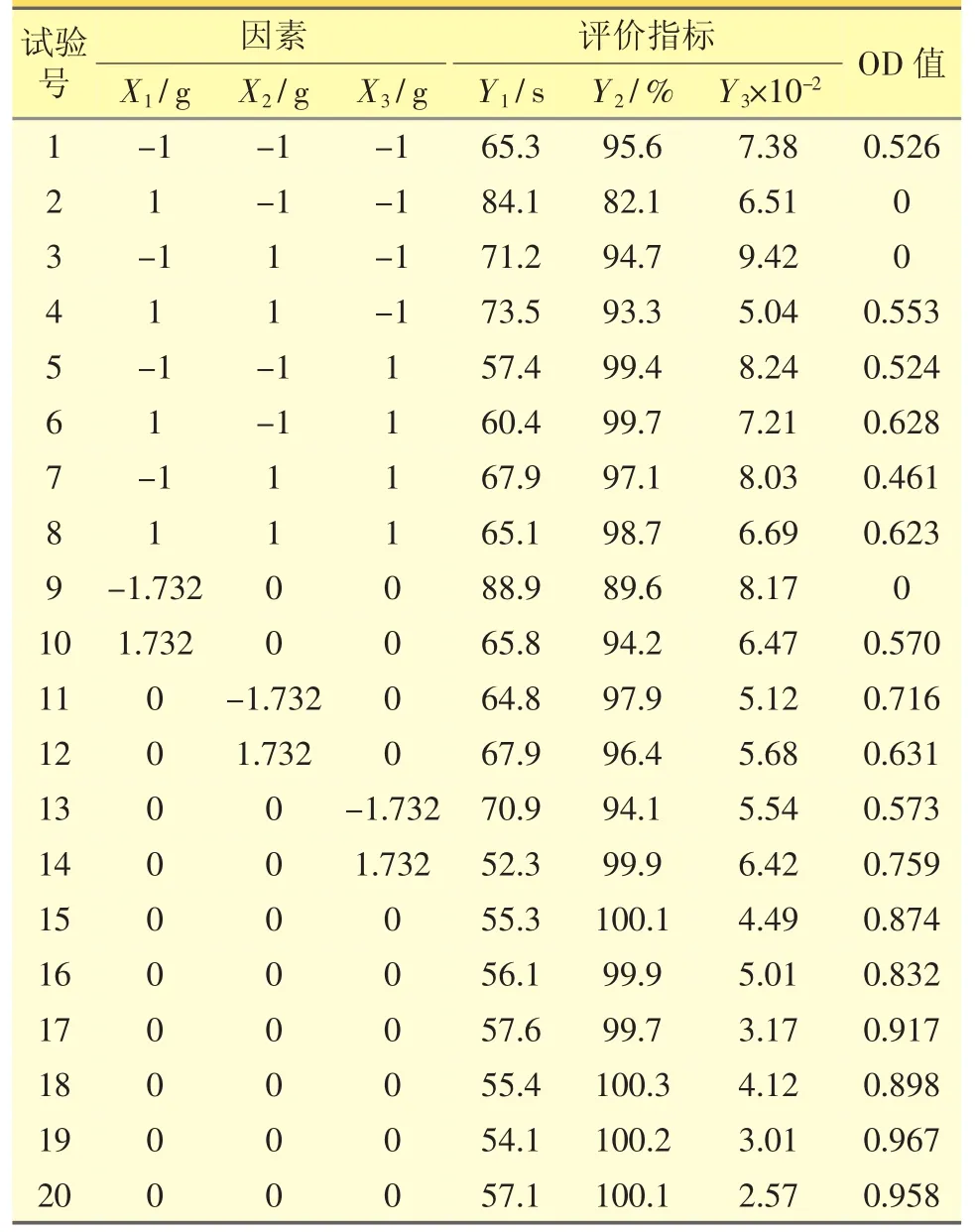
表2 星点设计实验结果
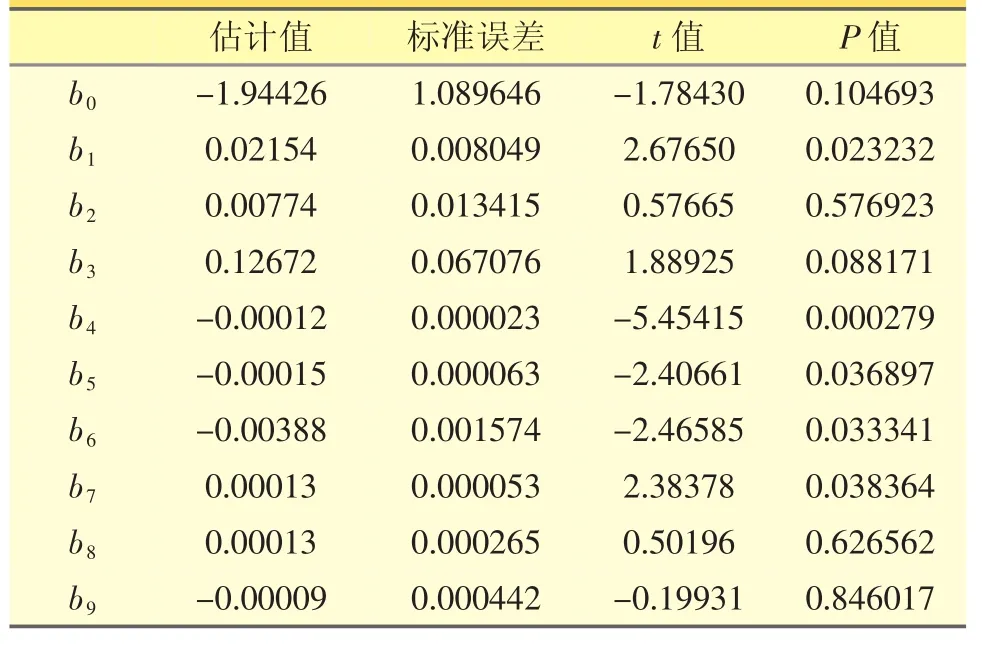
表3 二次多项式各系数及其显著性检验
最佳的处方优化结果依据模型采用简单直观的方法——描绘效应面法获得。由图1可见,乳糖用量于中值附近,OD值较大;交联聚维酮用量增加、微晶纤维素用量减少,可使OD值增大,故从三维响效应曲面和等高线图上直接读取处方用量的最优值为:乳糖用量144.48 g,微晶纤维素用量83.06 g,交联聚维酮用量17.83 g,即在处方中所占的比例分别为乳糖占 44.78%,微晶纤维素占25.75%,交联聚维酮占5.53%。
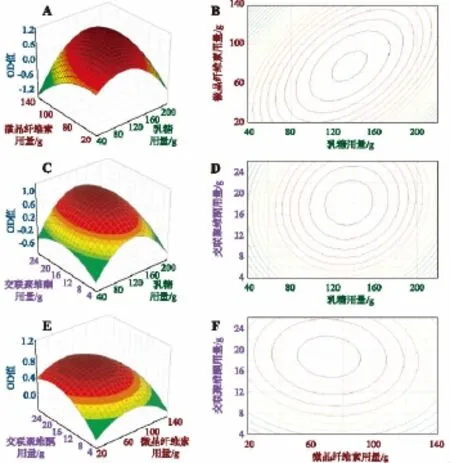
图1 不同因素对OD值影响的效应面图
3.2 验证实验
根据模型的最佳工艺条件进行3次平行验证实验,测得3批样品的评价指标见表4。结果可见,实测值与预测值偏差较小,误差在可接受范围以内,表明本实验所建立的模型具有很好的预测能力。
3.3 自制样品与参比制剂的检测结果对比
3批盐酸伊托必利分散片生产验证的样品溶出度、含量、有关物质的检测结果均符合质量标准,且品质优于参比制剂。见表5。
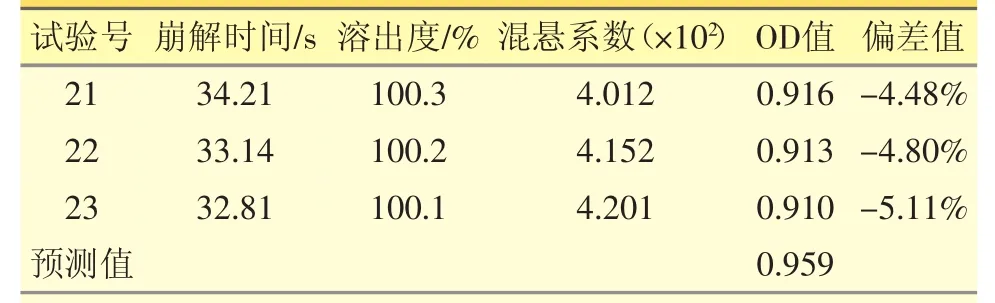
表4 3批工艺验证结果
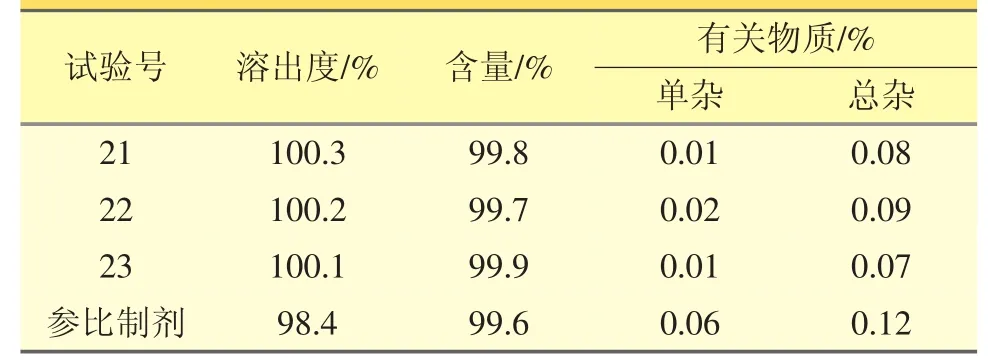
表5 自制样品与参比制剂对比
4 结 论
本研究采用星点设计响应面分析法优化盐酸伊托必利分散片的处方条件,采用综合评分法处理,主观性与预测性强,在最优工艺条件下样品的崩解时间、溶出度和混悬系数等各指标参数均达到较理想结果。星点设计响应面分析法较因子分析而言,精度仍有待提高,且试验次数偏多,但星点设计已在制剂处方和工艺优化中得到了一定范围的应用。
[1] 陈志明,陆伟根,王大林.分散片制备技术[J].中国医药工业杂志,2004,35(6):371-3.
[2] 陈 鹰,匡长春,宋 琪,等.分散片的研究与应用[J].中国药师,2001,4(1):62-4.
[3] 国家药典委员会.中华人民共和国药典:二部[S].北京:化学工业出版社,2010:附录ⅣA、ⅩC.
[4] 邱宏聪,刘布鸣.星点设计-效应面法优选岗松总黄酮提取工艺[J].中国实验方剂学杂志,2013,19(12):46-9.
Optimization ofthe Preparation ofItopride Hydrochloride Dispersible Tablet Using Response Surface Methodology
YUE Li,WANG Jiang-tao,LONG Lian-qing,SU Liang
DiSha Pharmaceutical Group,Weihai,Shandong 264200
Objective:To prepare itopride hydrochloride dispersible tablets by wet granulation.Methods:The formulation of itopride hydrochloride dispersible tablets was optimized in terms of disintegrating time,dissolution and suspensibility by response surface methodology designing.Results and Conclusion:The optimized formulation of the itopride hydrochloride dispersible tablets contained lactose 44.78%,microcrystalline cellulose 25.75%and cross-linked polyvinyl pyrrolidone 5.53%.Under the optimized formulation, disintegration time,dissolution and suspension coefficient achieved desirable results,which meets the quality standards.
Itopride hydrochloride;Dispersible tablets;Response surface methodology
R943
A
1673-7806(2015)06-555-03
岳莉,女,硕士研究生 E-mail:lily1357@126.com
2015-05-19
2015-07-27
