熊果酸对喉癌Hep-2细胞侵袭的影响及机制研究
2015-03-04张军辉严家芹赵玉林
张军辉,严家芹,赵玉林
(1.郑州大学第三附属医院耳鼻咽喉科,郑州450052;2.郑州大学第一附属医院肿瘤科,郑州450003;
3.郑州大学第一附属医院耳鼻咽喉科,郑州450003)
在世界范围内头颈部鳞状细胞癌是第六大常见恶性肿瘤,每年约60万新发确诊病例[1],喉鳞状细胞癌是头颈部区域第2个最常见的恶性肿瘤[2-3]。虽然近年来喉癌患者的综合治疗有很大的发展,但总的生存率仍然很低,喉癌患者死亡的主要原因之一就是侵袭转移[4]。近年来发现熊果酸具有抑制肿瘤细胞增殖和侵袭的作用,目前还没有熊果酸作用于人喉癌Hep-2细胞的国内外相关报道。本实验主要检测熊果酸对喉癌Hep-2细胞增殖和侵袭能力的影响,并分析其机制,为熊果酸应用于喉癌治疗提供理论依据。
1 材料与方法
1.1 材料 人喉癌Hep-2细胞株购自南京凯基生物有限公司;RPMI-1640培养基、胎牛血清购自杭州吉诺生物医药技术有限公司、杭州四季青工程材料有限公司;噻唑蓝(MTT)、Transwell小室购自美国Sigma公司、Corning公司;NF-κB 和βactin抗体购自Santa Cruz公司;辣根过氧化酶标记物山羊抗小鼠IgG(二抗)购自北京中杉金桥生物技术有限公司;明胶蛋白购自Amersco公司;熊果酸购自美国Sigma公司,溶于RPMI-1640培养基制成10mmol/L 的母液,过滤除菌后-20 ℃备用。
1.2 方法
1.2.1 细胞培养 人喉癌Hep-2细胞接种于RPMI-1640培养液(含10%胎牛血清),37 ℃、5%CO2及饱和湿度培养箱培养,每2天换1次培养液,实验时取对数生长期细胞。
1.2.2 MTT 法测定细胞增殖抑制效应 消化收集对数生长期细胞,计数并用含10%胎牛血清的培养液调整细胞浓度7.5×104个细胞/mL细胞悬液,按每孔100μL 接种于96 孔板。待细胞贴壁后进行分组,实验组加入熊果酸终浓度为0、12.5、25.0、50.0μmol/L 的培养基,阴性对照和空白对照,每组设6个复孔。在培养箱内培养12、24、36、48、60、72h后加入MTT 继续培养4h,弃培养液后加入DMSO 振荡10 min,检测各孔吸光度(A)值计算细胞增殖抑制率。增殖抑制率(%)=(对照组A值-给药组A值)/对照组A值×100%。
1.2.3 Transwell小室侵袭实验检测熊果酸对Hep-2细胞侵袭能力的影响 冰上将Matrigel用冷的无血清的RPMI-1640培养基按1∶8稀释,加入24孔板Transwell小室滤膜上表面,37 ℃风干4~5h。无血清培养液37 ℃水化基底膜30 min。消化收集0、12.5、25.0、50.0μmol/L 的熊果酸处理48h 的Hep-2细胞,用无血清培养基洗3次并制备单细胞悬液,调整细胞浓度5×105/mL。Transwell小室上室加入200μL 细胞悬液;小室下室加入500μL 含10%血清培养基培养24h后。弃去培养基并用棉签擦去底部内面未穿过细胞,95%乙醇固定后结晶紫染色,封片。高倍镜下计数穿越细胞数,计算平均数。
1.2.4 Western blot检测熊果酸对Hep-2细胞NF-κB蛋白表达的影响 消化收集对数生长期细胞接种于6孔板上培养至细胞间接近融合,熊果酸终浓度为0、12.5、25.0、50.0μmol/L的培养基作用24h提取细胞总蛋白。总蛋白浓度经Bio-Rad测定后经SDS-PAGE 凝胶电泳,然后转移至PVDF 膜上。封闭后与加稀释一抗抗体(靶蛋白抗体)4 ℃过夜。经TBST 漂洗后加入稀释的二抗室温孵育2h后荧光显色,曝光、显影和定影。扫描蛋白印迹胶片进行吸光度扫描分析,计算各组细胞靶蛋白相对表达量。
1.2.5 明胶酶谱检测熊果酸对Hep-2细胞MMP-2和MMP-9活性的影响 取对数生长期Hep-2细胞接种于6孔板培养24h。弃旧培养基并以PBS洗3次。分别加入熊果酸终浓度为0、12.5、25.0、50.0μmol/L 的无血清RPMI-1640培养基继续培养24h。收集各组细胞培养上清液,2 000r/min 4℃离心10min。计细胞数后按照细胞数取相应体积的上清与等体积的上样缓冲液混合,在含0.1%明胶的分离胶中进行常规SDSPAGE电泳。电泳结束后凝胶蒸馏水漂洗数次,洗脱液摇动洗涤后再次蒸馏水漂洗,明胶缓冲液37 ℃孵育18h后蒸馏水漂洗30min,5g/L考马斯亮蓝G-250染色液染色3h,脱色液处理1~2h,凝胶成像系统观察、拍照并保存。
1.3 统计学处理 采用SAS6.12和SPSS13.0统计软件进行分析,计量资料用±s表示,检验水准为α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 熊果酸抑制Hep-2细胞的增殖 熊果酸对Hep-2细胞增殖有显著的生长抑制作用,不同浓度组间、不同时间组间生长抑制率均差异有统计学意义(F=13.05,P<0.01),见图1。

图1 熊果酸对Hep-2细胞增殖能力的影响(×200)
2.2 熊果酸抑制Hep-2 细胞的侵袭能力 Hep-2 细胞经12.5、25.0、50.0μmol/L 浓度熊果酸作用24h后侵袭能力分别降至72.35±9.99、59.46±8.18、43.75±11.24,与对照组的83.07±13.61 比较,差异有统计学意义(F=7.212,P<0.05)。见图2。
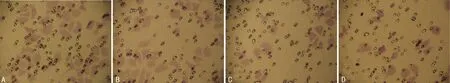
图2 熊果酸对Hep-2细胞侵袭能力的影响(×200)
2.3 熊果酸抑制Hep-2细胞NF-κB 蛋白的表达 经12.5、25.0、50.0μmol/L 的熊果酸作用24h后Hep-2细胞NF-κB蛋白表达明显降低,分别 降低至0.511±0.160、0.319±0.116、0.153±0.134,与对照组的0.637±0.123比较,差异有统计学意义(F=7.509,P<0.05)。见图3。

图3 熊果酸对Hep-2细胞NF-κB蛋白表达的影响
2.4 熊果酸抑制Hep-2 细胞MMP-9 和MMP-2 的活性 Hep-2细胞经12.5、25.0、50.0μmol/L 浓度的熊果酸作用24 h后MMP-9活性明显下降,分别降至3 501.174±599.465、2 414.981±550.453、1 267.656±507.451,与 对 照 组 的4 321.349±693.977 比较,差异有统计学意义(F=15.068,P<0.01);MMP-2 活性明显下 降,分别降至2 636.066±547.143、2 053.827±659.039、1 302.781±481.484,与对照组的3 288.831±581.703比较,差异有统计学意义(F=6.578,P<0.05)。见图4。

图4 熊果酸对Hep-2细胞MMP-9和MMP-2的影响
3 讨 论
熊果酸是一个中药抗癌活性化合物之一,在水果、蔬菜和药材等均有发现,广泛存在于多种植物的浆果、叶、花和果实内,具有抗炎、抗菌、抗氧化剂、抗溃疡、抗增殖、抗癌、抗诱变、抗动脉粥样硬化、抗高血压等多种生化和药理作用特性[5-7]。几年来随着体外实验及体外动物实验研究的深入,证实熊果酸可以抑制人肝癌、肺癌、乳腺癌等多种肿瘤细胞的增殖、侵袭和转移及诱导细胞凋亡且对机体的不良反应少,呈现出良好地临床应用前景[8-10]。本实验MTT 结果显示,熊果酸对人喉癌Hep-2细胞具有浓度和时间依赖性生长抑制作用,能有效地抑制Hep-2细胞增殖的作用。
浸润和转移是恶性肿瘤细胞的恶性生物学行为之一,肿瘤细胞对周围重要组织和重要脏器的侵袭和转移是恶性肿瘤的主要致死原因之一,是临床影响恶性肿瘤预后的关键因素,因而研究肿瘤细胞侵袭与转移的机制及防治措施是目前肿瘤诊治研究的热点[11]。喉癌患者尤其是中、晚的侵袭和转移严重影响着患者的生存率和生命质量,抑制喉癌的侵袭和转移也是抗肿瘤药物的研究重点之一[12]。本研究观察熊果酸对人喉癌Hep-2细胞侵袭和转移能力的影响,结果发现熊果酸能呈浓度效应关系抑制喉癌Hep-2细胞对重组基底膜的侵袭能力。
肿瘤细胞的浸润和转移是多步骤、多阶段的复杂生物学过程,包括肿瘤细胞穿过细胞外基质屏障和血管的基底膜及穿出血管壁并发生远处转移,在这个过程中细胞外基质和基底膜的酶解是关键的一步。研究表明降解细胞外基质和基底膜的重要蛋白酶就是基质金属蛋白酶类(MMPs),它能够促进肿瘤的浸润和转移且与新生血管的形成密切相关。Ⅳ型胶原是生物体内构成基底膜的主要成分,MMPs中的MMP-2和MMP-9是Ⅳ型胶原的主要降解酶类,很多研究都表明MMP-2、MMP-9高表达于喉癌组织中,并在喉癌的发生、发展、侵袭和转移中起着重要的作用。当抑制了喉癌Hep-2 细胞中MMP-2、MMP-9基因的表达后就可以显著抑制Hep-2细胞的侵袭能力[13-14]。本研究结果发现熊果酸呈浓度依赖性下调MMP-2和MMP-9的活性。
NF-κB是一类具有多向转录调节作用的核转录因子,广泛存在于生物体内多种组织细胞中,具有广泛的生物学活性。NF-κB可被多种因素激活,能与多种免疫和炎症反应有关的基因的启动子和增强子中序列位点发生特异性结合并促进转录和表达,参与感染、炎症反应、氧化应激、胚胎发生、细胞增生、细胞凋亡等众多生理病理过程。近年来的大量研究表明NFκB与多种肿瘤的发生、发展和浸润转移及肿瘤耐药问题密切相关[15-16]。本研究结果发现熊果酸呈浓度依赖性下调NF-κB蛋白的表达。
综上所述,熊果酸可通过下调MMP-2和MMP-9基因的活性及NF-κB蛋白表达抑制喉癌Hep-2细胞的增殖和侵袭能力,其可能是熊果酸抗肿瘤作用的一重要途径。为熊果酸用于喉癌的治疗提供了有效的理论基础,但其具体抗肿瘤机制和确切疗效仍需要进一步实验研究。
[1] Leemans CR,Braakhuis BJ,Brakenhoff RH.The molecular biology of head and neck cancer[J].Nature Rev,2001,11(1):9-22.
[2] Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].CA Cancer J Clin,2009,59(3):225-249.
[3] Hoffman HT,Porter K,Karnell LH,et al.Laryngeal cancer in the United States:changes in demographics,patterns of care,and survival[J].La Ryng,2006,116(1):1-13.
[4] Mnejja M,Hammami B,Bougacha L,et al.Occult lymph node metastasis in laryngeal squamous cell carcinoma:therapeutic and prognostic impact[J].Eur Ann Otorhinol Head Neck Dis,2010,127(5):173-176.
[5] Min BS,Kim NK,Ahn JB,et al.Cetuximab in combination with 5-fluorouracil,leucovorin and irinotecan as a neoadjuvant chemotherapy in patients with initially unresectable colorectal liver metastases[J].Onkologie,2007,30(12):637-643.
[6] Tsai SJ,Yin MC.Antioxidative and anti-inflammatory protection of oleanolic acid and ursolic acid in PC12cells[J].J Food Sci,2008,73(2):H174-178.
[7] Ikeda Y,Murakami A,Ohigashi H.Ursolic acid:an antiand pro-inflammatory triterpenoid[J].Mol Nutr Food Res,2008,52(1):26-42.
[8] Yu YX,Gu ZL,Yin JL,et al.Ursolic acid induces human hepatoma cell line SMMC-7721apoptosis via p53-dependent pathway[J].Chin Med J(Engl),2010,123(14):1915-1923.
[9] Huang CY,Lin CY,Tsai CW,et al.Toxicol In Vitro.Inhibition of cell proliferation,invasion and migration byursolic acid in human lung cancer cell lines[J].Toxicol In Vitro,2011,25(7):1274-1280.
[10] Kim KH,Seo HS.Induction of apoptotic cell death by ursolic acid through mitochondrial death pathway and extrinsic death receptor pathway in MDA-MB-231cells[J].Arch Pharm Res,2011,34(8):1363-1372.
[11] del Barco Barrantes I,Nebreda AR.Roles of p38 MAPKs in invasion and metastasis[J].Biochem Soc Trans,2012,40(1):79-84.
[12] Che XH,Chen H,Xu ZM,et al.14-3-3epsilon contributes to tumour suppression in laryngeal carcinoma by affecting apoptosis and invasion[J].BMC Cancer,2010,10(4):306.
[13] Uloza V,Liutkeviius V,Pangonyt D,et al.Expression of matrix metalloproteinases(MMP-2and MMP-9)in recurrent respiratory papillomas and laryngeal carcinoma:clinical and morphological parallels[J].Eur Arch Otorhinol,2011,68(6):871-878.
[14] Cao XL,Xu RJ,Zheng YY,et al.Expression of type Ⅳcollagen,metalloproteinase-2,metalloproteinase-9and tissue inhibitor of metalloproteinase-1in laryngeal squamous cell carcinomas[J].Asian Pac J Cancer Prev,2011,12(12):3245-3249.
[15] Maru Y.Encounter of cancer cells with bone.Cancer and inflammation-input and output of NF-κB[J].Clin Calcium,2011,21(3):364-371.
[16] Chaturvedi MM,Sung B,Yadav VR,et al.NF-κB addiction and its role in cancer:′one size does not fit all[J].Oncogene,2011,30(14):1615-1630.
