内脂素在糖尿病大鼠肝组织的表达及其对肝糖代谢的作用*
2015-03-04张安星杨孟雪
张安星,张 晗,阳 琰,高 琳,廖 鑫,杨孟雪
(遵义医学院附属医院内分泌科,贵州遵义563000)
糖尿病是全球普遍关注的严重影响人类健康的疾病,体内多种因素与糖尿病、肥胖、胰岛素抵抗这些病理状态相关,但目前糖尿病发生、发展的确切机制并不完全清楚。有研究显示内脂素(visfatin)具有类胰岛素的作用,能调节血糖,在机体糖脂代谢中发挥重要作用[1],但研究报道其在糖脂代谢及胰岛素抵抗中的作用并不一致。本研究通过建立糖尿病及肥胖大鼠动物模型,测定肝组织中visfatin、腺苷酸活化蛋白激酶(AMPK)的表达,探讨visfatin与葡萄糖6磷酸酶(G-6-Pase)、AMPK 的关系,将可能为糖尿病及胰岛素抵抗的防治提供理论依据。
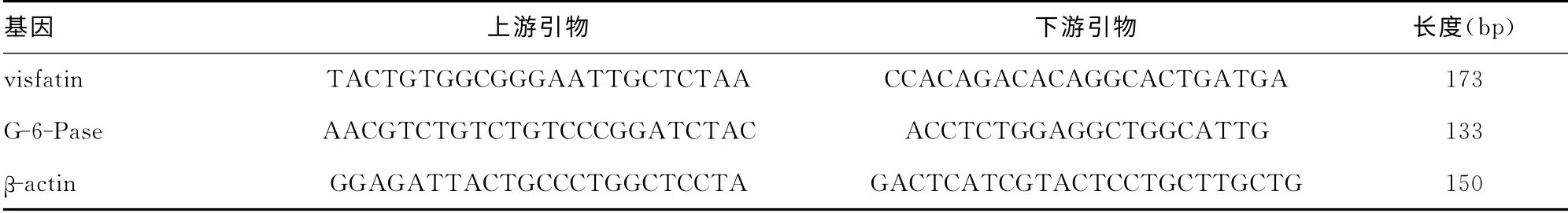
表1 PCR 引物序列及产物长度
表2 各组大鼠代谢指标比较(±s)

表2 各组大鼠代谢指标比较(±s)
-:此项无数据。
组别 n 体质量(g) 内脂质量/体质量(%)FBG(mmol/L)FFA(mmol/L)TG(mmol/L)TC(mmol/L)HOMA-IR ISI NC组 10 408.60±44.11 2.17±0.54 4.40±1.05 375.50±163.75 0.24±0.09 1.11±0.32 2.01±0.74 0.030 0±0.010 0 DIO组 12 619.00±29.55 4.29±1.05 5.11±0.57 479.42±151.71 1.13±0.48 1.59±0.41 5.61±2.23 0.010 0±0.005 0 DM 组 10 405.80±69.53 2.03±0.81 25.52±2.75 1 260.30±587.67 6.65±3.07 6.71±3.27 43.21±10.72 0.001 0±0.000 2 INS组 9 468.45±33.31 3.61±1.02 6.04±1.57 727.44±280.41 2.72±1.34 1.89±0.32 - -MET组 9 422.67±29.27 2.62±1.25 6.97±1.35 646.56±1 92.97 1.55±0.61 1.80±0.33 - -
1 材料与方法
1.1 材料 清洁级雄性SD 大鼠70只,体质量180~220g,由第三军医大学大坪医院野战外科研究所动物中心提供。高脂高糖饲料为在普通饲料中加20%的炼猪油、10%的蛋黄、5%的葡萄糖、2%的胆固醇。胰岛素放免试剂盒(科美东雅公司),链脲佐菌素(STZ,sigma),Trizol Reagent、逆转录试剂盒、焦碳酸二乙酯(DEPC)、SYBR®GREEN PCR Master Mix;辣根过氧化物酶标记兔抗山羊、小鼠IgG、RIPA 蛋白裂解液、BCA 蛋白浓度定量试剂盒、彩色预染marker、ECL 显色试剂盒由碧云天生物有限公司提供;引物由宝生物公司合成,visfatin抗体由Biovision公司提供;AMPKα抗体、p-AMPKα抗体均由cell signaling 公司提供;β-actin抗体由中杉金桥公司提供;盐酸二甲双胍(施贵宝公司),胰岛素注射液(万邦公司)。
1.2 方法
1.2.1 模型建立 适应性喂养SD大鼠1周后,分为正常对照组(NC组)10只、肥胖组(DIO 组)15只、糖尿病组(DM 组)15只、胰岛素治疗(INS组)15只、二甲双胍治疗组(MET 组)15只。NC组大鼠普通饲料喂养,其余大鼠用高脂高糖饲料喂养。DIO 组喂养12周,禁食12h后称体质量,大于NC组大鼠平均体质量20%者为DIO 成模,共成模12 只。DM 组、INS组、MET 组大鼠经喂养8周后禁食12h后称质量,按40mg/kg腹腔注射链脲佐菌素,1 周后测FPG,2 次FPG≥16.7 mmol/L为糖尿病大鼠成模,共成模10只。NC组、DIO组 腹腔注射0.1 mmol/L 柠檬酸缓冲液。INS组用低精蛋白锌胰岛素腹部皮下注射,使FPG<11.1mmol/L,共有成模9只;二甲双胍300mg·kg-1·d-1灌胃,控制FPG<11.1 mmol/L,共计成模9只。至12周全部大鼠禁食12h后,腹腔注射10%水合氯醛麻醉后腹主动脉取血,血清测FFA、TG、TC、Fins。肝脏放入-80 ℃冰箱保存;另取同一部位小块肝脏液氮速冻后移入-80 ℃冰箱冻存。
1.2.2 血清生化指标检测 强生稳步倍加型血糖仪及相应配套试纸测定FBG,FFA、TG、TC 用全自动生化分析仪检测,放射免疫法检测血清Fins。胰岛素抵抗指数(HOMA-IR)=FBG×Fins/22.5。胰岛素敏感性指数(ISI)=1/(Fins×FBG)。
1.2.3 RT-PCR检测肝组织中visfatin、G-6-Pase mRNA 的表达 用美国BIO-RAD公司icycler荧光定量PCR 仪,按TaKa-Ra逆转录试剂盒说明将RNA 逆转录为cDNA。采用15μL PCR反应体系:iQ SYBR Green Supermix 7.5μL,模板混合液0.5μL,cDNA template 3μL,DEPC水4μL。反应条件:95℃3min;95 ℃10s,退火温度61.6 ℃30s,循环40次。取CT平均值。引物序列见表1。
1.2.4 Western blot测定visfatin、AMPKα、p-AMPKα的蛋白表达 肝脏组织PBS洗涤剪碎后加入RIPA 裂解液,震碎、裂解,离心后取上清液。BCA 法测定蛋白浓度。100 ℃、5 min蛋白变性后上样电泳,转膜,封闭,加入visfatin/AMPKα/p-AMPKα一抗孵育过夜,次日加入二抗,孵育1h显影,凝胶成像拍照并条带扫描。
1.3 统计学处理 采用SPSS13.0对数据进行统计学分析,计量资料用±s表示,多组间采用方差分析,偏态分布经秩次转换。正态分布数据用Perason相关分析,非正态分布数据用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠代谢指标比较 DIO 组、INS组内脂质量/体质量较NC 组明显升高,DM 组、MET 组内脂质量/体质量较DIO 组显著降低(P<0.01),INS组内脂质量/体质量较DM组显著升高(P<0.01),MET 组内脂质量/体质量较INS组显著下降(P<0.05)。DM 组FBG 比NC 组、DIO 组显著升高(P<0.01);INS 组、MET 组FBG 比DM 组 明 显 降 低(P<0.01)。DIO 组、DM 组HOMA-IR均较NC组明显升高,而ISI均显著降低(P<0.01);DM 组HOMA-IR 较DIO 组明显升高,ISI明显降低(P<0.01)。DIO 组TG 较NC 组显著升高(P<0.01);DM 组、INS组及MET 组TG、TC 均比NC 组 明显升高(P<0.05);DM 组TG 比DIO 组明显升高(P<0.05);MET 组、INS组TG 比DM 组明显降低(P<0.05)。DM 组、INS组、MET 组FFA 较NC 组显著升高(P<0.05);DM 组FFA 较DIO 组显著增高(P<0.05),见表2。
2.2 各组大鼠肝组织visfatin、G-6-Pase mRNA 比较 DM 组visfatin mRNA 较NC组、DIO 组均显著升高(P<0.05),INS组、MET 组visfatin mRNA 均较DM 组显著下降(P<0.01)。DM 组、INS组、MET 组G-6-Pase mRNA 均 较DIO 组 显 著 升高(P<0.05),DIO 组G-6-Pase mRNA 均 较NC 组 显 著 降 低(P<0.01),MET 组G-6-Pase mRNA 较DM 组及INS组均显著降低(P<0.05)。见表3。
表3 各组大鼠肝组织visfatin、G-6-Pase mRNA 表达比较(±s)

表3 各组大鼠肝组织visfatin、G-6-Pase mRNA 表达比较(±s)
组别 n visfatin G-6-Pase NC组5 65.41±28.73 131.57±31.46 DIO 组 5 116.23±57.66 35.12±7.65 DM 组 5 220.03±96.62 159.37±39.92 INS组 5 40.32±10.52 194.50±59.87 MET 组5 36.05±16.51 108.40±26.23
2.3 各组大鼠肝组织visfatin、AMPKα、p-AMPKα蛋白表达比 较 DM 组、INS 组、MET 组visfatin蛋 白 表 达 均 较NC 组明显升高(P<0.05);DM 组、INS组、MET 组AMPKα蛋白表达均较NC组显著降低(P<0.05),DM 组AMPKα的蛋白表达较DIO 组显 著 降 低(P<0.05)。DIO 组、DM 组、INS 组、MET 组p-AMPKα蛋白的表达较NC组显著降低(P<0.01),见表4、图1。
表4 各组大鼠肝组织visfatin、AMPKα、 p-AMPKα蛋白表达比较(±s)

表4 各组大鼠肝组织visfatin、AMPKα、 p-AMPKα蛋白表达比较(±s)
组别 n visfatin AMPKα p-AMPKα NC组5 0.38±0.18 1.19±0.22 0.83±0.08 DIO 组 5 0.60±0.22 0.94±0.14 0.43±0.03 DM 组 5 0.75±0.23 0.66±0.23 0.37±0.03 INS组 5 0.69±0.08 0.89±0.20 0.39±0.04 MET 组5 0.66±0.14 0.77±0.25 0.48±0.13
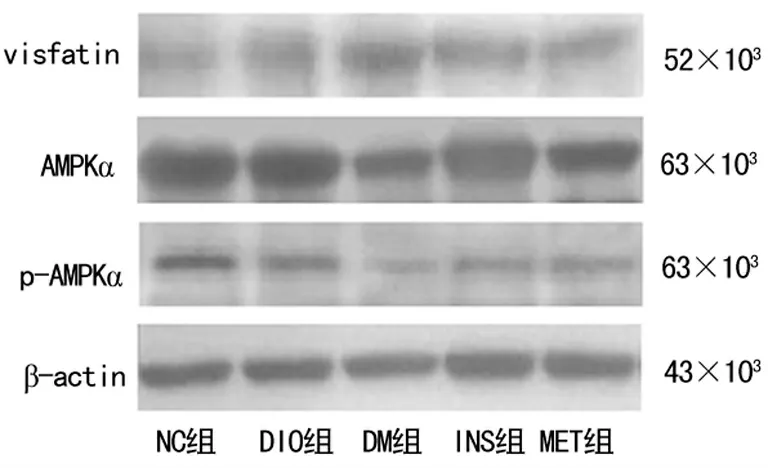
图1 各组大鼠肝组织visfatin、AMPKα、p-AMPKα蛋白表达
2.4 visfatin 表达与G-6-Pase表达相关性分析 NC 组visfatin mRNA 与G-6-Pase mRNA 表达呈正相关(r=1.000,P<0.01),INS 组visfatin 与G-6-Pase mRNA 表 达 呈 负 相 关(r=-0.996,P=0.004)
3 讨 论
visfatin高表达于人及动物的脂肪细胞、肝细胞、骨骼肌、肾脏及心脏等部位,研究认为其能够调节胰岛素分泌[1],目前国内外关于visfatin在肝脏中的表达研究结果并不一致。研究表明KKAy小鼠随着糖尿病的发展,肝脏visfatin mRNA 的表达有逐渐增高趋势[1];高脂喂养大鼠visfatin mRNA 的表达随时间的延长逐渐增高[2],也有研究认为2型糖尿病患者肝脏visfatin mRNA 表达较糖耐量正常者降低[3]。在糖尿病小鼠模型中显示短期激活肝脏AMPK 可使血糖降低[4]。研究发现,激活AMPK 可以降低肝糖代谢中两种关键酶磷酸烯醇式丙酮酸羧激酶和G-6-Pase的表达[5]。目前已经发现AMPK的活性可受多种脂肪因子调节,而visfatin对AMPK 的调节作用尚不清楚,体外培养的大鼠脂肪细胞中,二十碳五烯酸能够通过激活AMPK 通道而增加visfatin的表达与分泌[6]。研究发现visfatin可能下调AMPK 活性[2],肥胖大鼠内脏脂肪visfatin蛋白表达和AMPK 的活化负相关。
本研究建立起具有胰岛素抵抗与胰岛素分泌障碍的糖尿病大鼠模型,INS组内脂质量较DM 组明显增加,而MET 组则明显低于INS组。DM 组、INS组、MET 组visfatin蛋白表达较NC组显著升高,DM组visfatin mRNA表达量较NC组及DIO 组显著升高,可能是血糖的升高导致组织代偿性的分泌更多的visfatin,胰岛素代谢通路被激活,而血糖降低对visfatin的表达起了负反馈调节作用,INS组、MET组visfatin mRNA 的表达均较DM 组显著下降,与Chen等[4]的研究实验结果一致。AMPK 通道的激活被认为是二甲双胍发挥降糖作用的重要途径,MET 组visfatin、AMPKα、p-AMPKα蛋白的表达与INS 组无显著差异,visfatin 蛋白的表达与AMPKα、p-AMPKα蛋白的表达并无明显相关性,提示二甲双胍激活AMPK 降血糖的机制中并无visfatin的直接参与。
本实验中DM 组G-6-Pase mRNA 表达较DIO 组明显升高,这与国 内报 道 一 致[7],而MET 组G-6-Pase mRNA 较DM组、INS组均显明降低,NC 组中visfatin mRNA 与G-6-Pase mRNA 的表达呈正相关,其因果关系及机制有待于更进一步的研究,G-6-Pase或许参与了生理状态下visfatin调节机制。
综上所述,糖尿病大鼠肝组织visfatin的表达明显升高,可能与胰岛素抵抗及糖尿病发生有关,visfatin可能激活了胰岛素受体而发挥降糖作用,但visfatin在糖尿病及胰岛素抵抗机制中具体作用如何,还有待于对其进行更深入的研究。
[1] Fukuhara A,Matsuda M,Nishizawa M,et al.Visfatin:a protein secreted by visceral fat that mimics effects of insulin[J].Science,2005,307(5708):426-430.
[2] 肖海涛,裴晓萌.高脂饲料诱导的肥胖倾向和肥胖抵抗倾向大鼠内脏脂肪visfatin 和AMPK 表达及其相互关系[J].中国运动医学杂志,2008,27(2):170-173.
[3] Catalán V,Gómez-Ambrosi J,Rodríguez A,et al.Association of increased Visfatin/ PBEF/NAMPT circulating concentrations and gene expression levels in peripheral blood cells with lipid metabolism and fatty liver in human morbid obesity[J].Nutr Metab Cardiovasc Dis,2011,21(4):245-253.
[4] Chen MP,Chung FM,Chang DM,et al.Elevated plasma level of visfatin/pre-B-Cell colony-enhancing factor in patients with type 2diabetes mellitus[J].J Clin Endocrinol Metab,2006,91(1):295-299.
[5] Dogru T,Sonmez A,Tasci I,et al.Plasma visfatin levels in patients with newly diagnosed and untreated type 2diabetes mellitus and impaired glucose tolerance[J].Diabetes Res Clin Pract,2007,76(1):24-29.
[6] Silvia L,Matilde B,Amelia M,et al.Eicosapentaenoic acid stimulates AMP-activated protein kinase and increases visfatin secretion in cultured murine adipocytes[J].Clin Sci,2009,117(3):243-249.
[7] 董莹,刘伟.不同糖代谢状态下大鼠肝X 受体的表达及其对肝糖代谢的影响[J].中华内分泌代谢杂志,2011,27(2):148-151.
