柚皮中柚皮苷和类柠檬苦素的提取及分离纯化
2015-03-03杨秋明李靖雅肖安风
杨秋明,李靖雅,肖安风,陈 俊
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,
福建 厦门 361021;3.厦门市食品生物工程技术研究中心,福建 厦门 361021;
4.厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建 厦门 361021)
柚皮中柚皮苷和类柠檬苦素的提取及分离纯化
杨秋明1,2,3,4,李靖雅1,肖安风1,2,3,4,陈俊1,2,3,4
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,
福建 厦门 361021;3.厦门市食品生物工程技术研究中心,福建 厦门 361021;
4.厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建 厦门 361021)
[摘要]用热水煮提法提取出柚皮中柚皮苷和类柠檬苦素等大量苦味活性物质,通过静态吸附-解吸试验,筛选出具有较大吸附和解吸率的D101大孔吸附树脂进行分离纯化,得出最优的吸附条件:树脂添加量3.0%(质量分数),25 ℃恒温条件下摇床以180 r/min振荡90 min.在此条件下,柚皮苷和柠檬苦素吸附率都达到100%.吸附完全后进行动态洗脱,洗脱液再通过萃取和重结晶后可有效分离纯化柚皮苷和柠檬苦素类似物,纯化后的样品用HPLC法测得柚皮苷纯度达到95.8%,用紫外分光光度法测得柠檬苦素类似物纯度达到90.9%.
[关键词]柚皮苷;柠檬苦素类似物;大孔吸附树脂;分离纯化
0引言
柚皮苷(4,5,7-trihydroxy flavanone-7-β-L-rhamnoglucoside-(1,2)-α-D-glucopyranoside)是一种二氢黄酮糖苷类化合物,它是芸香科植物如葡萄柚、蜜柚、酸橙等的主要苦味物质[1].常温下的柚皮苷在水中的溶解度为1 g/L,易溶于甲醇、乙醇、丙酮、醋酸、稀碱溶液及热水.柠檬苦素(Limonin)类化合物是三萜系后苦味化合物[2-3],主要存在于芸香科植物果实中,易溶于溶酯性有机溶剂,难溶于水,在甲醇、乙醇中溶解度较大.
柚皮苷作为柚汁当中的主要苦味物质,具有很高的药用价值.柚皮苷生物活性高,具有很好的抗氧化作用[4],对致突变性具有抑制作用[5-7],具有抗癌防癌等功能[8-11].因此,在医药工业上,柚皮苷可用于生产防治心脑血管疾病及消炎类的药物[12-13].类柠檬苦素也有生物学功能,如对人体乳腺癌细胞的抗癌功能[14]、镇痛抗炎作用[15-16]、抗焦虑和镇静作用以及昆虫拒食功能[17].虽然柚皮苷和类柠檬苦素都具有生物活性,但过多的含量会影响商品果汁的感官质量,使消费者难以接受,从而降低了果汁的商品价值,因此需要进行脱苦处理.脱苦处理的方法有很多,目前在应用大孔吸附树脂进行柑橘汁脱苦方面有一些报道:文献[18-20]使用Amberlite XAD系列树脂对柑橘汁进行脱苦效果很好,且对营养成分影响较少;2009年,邢建荣等利用HZ树脂对胡柚汁进行脱苦,柚皮苷和柠檬苦素的脱除率分别达64.6%和76.7%[21].本文选取优良树脂进行静态吸附工艺的优化,并通过动态洗脱分离纯化柚皮苷和类柠檬苦素,并结合萃取和结晶的方法使柚皮脱苦.
1材料与方法
1.1 材料与试剂
琯溪蜜柚,购自漳州市平和县琯溪镇;AB-8、DM130、D4020、D101、D101-I大孔吸附树脂,购自杭州星群仪器公司.
甲醇、乙腈均为色谱纯,购自美国 Tedia公司;其他试剂均为国产分析纯.
1.2 仪器与设备
Waters 2489高效液相色谱仪(配有Binary泵、2695紫外检测器、Waters System Breeze系统控制和数据处理工作站),购自美国Waters公司;Unic 7200紫外可见分光光度计,购自尤尼柯(上海)仪器有限公司.
1.3 方法
1.3.1柚皮苷及柠檬苦素的提取
采用热水煮提法,具体过程为:将原料中霉烂、虫蛀及有病虫害疤痕的柚皮去除,用刀削去除接近果肉部分疏松的白皮组织,将柚皮切成1 cm×2 cm大小的块,采用盐的质量分数为0.8%,料液比为20∶1(g∶L),每次煮沸2~3 min,进行4次盐水煮沸.水煮液用4层纱布过滤,取少量水煮液测定其中柚皮苷和柠檬苦素的含量.
1.3.2大孔吸附树脂筛选
1.3.2.1大孔吸附树脂预处理
树脂先经漂浮法进行筛选,再用体积分数95%的乙醇浸泡24 h,充分溶胀,浸泡过程中保持树脂完全被浸没.然后湿法上柱,用体积分数95%乙醇通过树脂层,直至流出液不呈白色浑浊为止,再用蒸馏水以同样流速洗至流出液无乙醇味,然后用质量分数2%的盐酸溶液通过树脂层,并浸泡3 h,而后用蒸馏水洗至流出水的pH值呈中性(操作2遍),待用.
1.3.2.2静态吸附
称取经预处理后滤干水分的5种树脂各0.27 g于50 mL三角瓶中,加入15 mL提取液,以25 ℃、180 r/min恒温摇床中恒速振荡12 h,取适量提取液,测定柚皮苷、柠檬苦素的含量,计算5种树脂对柚皮苷和柠檬苦素的吸附率.
1.3.2.3静态解吸
取吸附饱和的树脂,用去离子水洗去表面未被吸附的提取液,加入30 mL体积分数70%的乙醇溶液,25 ℃、180 r/min恒温摇床中恒速振荡12 h,取适量解吸液,检测柚皮苷和柠檬苦素的含量,计算各树脂的解吸率.
1.3.3静态吸附等温曲线

1.3.4静态吸附动力学曲线测定
准确称取D101树脂0.36 g于3个100 mL锥形瓶中,均加入50 g提取液,于25 ℃摇床以180 r/min 振荡12 h,分别在1,2,3.5,5,7,9,12 h取样测定吸附液中柚皮苷和柠檬苦素的含量,绘制静态吸附动力学曲线.
1.3.5单因素试验
称取树脂0.25 g,加入20 g提取液,于25 ℃恒温摇床中以180 r/min振荡2 h,取样测定吸附液中柚皮苷和柠檬苦素含量,计算树脂吸附量.在保持其他条件不变的情况下分别改变树脂添加量、吸附时间、吸附温度、振荡速率进行单因素试验.
1.3.6动态洗脱
吸附完全的树脂湿法上柱,先用大量水淋洗至淋洗液无色并用浓硫酸检测不出糖;然后用体积分数为30%的乙醇洗脱;流速约为1 Bv/h,约每3 mL接一管,用薄层色谱法对洗脱液中成分进行跟踪检测定性,将成分相同的洗脱液进行合并,并减压蒸馏浓缩得浓缩物.
1.3.7萃取纯化
浓缩物用体积分数50%的甲醇溶解后,用两倍体积的石油醚萃取3次,将得到的两部分分别浓缩.甲醇部分浓缩后用体积分数70%的乙醇溶解后测其纯度,石油醚部分浓缩后用乙腈溶解测其纯度.
1.4 计算
吸附率/%=(C0-Ce)/C0×100;解吸率/%=C1V1/[(C0-Ce)V]×100,其中:Ce是平衡的质量浓度;C1是解析液的质量浓度;C0是初始的质量浓度;V是吸附液体积;V1是解析液体积.
2结果与分析
2.1 热水煮提
柚皮苷易溶于热水,通过加热处理可使其溶出,且加热使柚皮细胞壁软化,柚皮中的苦味物质更容易随可溶性固形物一起溶出.随着柚皮煮沸次数的增加,煮出液中苦味物质溶出越来越少,在柚皮煮沸3~4次时,可以将柚皮中大部分苦味物质释放到煮出液中.经检测,煮出液中约含有柚皮苷154.25 μg/mL,柠檬苦素53.33 μg/mL.
2.2 大孔吸附树脂筛选
选择不同极性和不同平均孔径的树脂进行静态吸附和静态解析实验,结果如表1所示.由表1可知,平均孔径最大的D101树脂对柚皮苷的吸附率和解吸率都最高,对柠檬苦素的解吸率可以达到100%,可能由于孔径大,活性物质更容易进入树脂内,也更容易脱离树脂被解吸出来.综合考虑5种树脂的吸附率和解吸率,选择D101进行下一步试验.
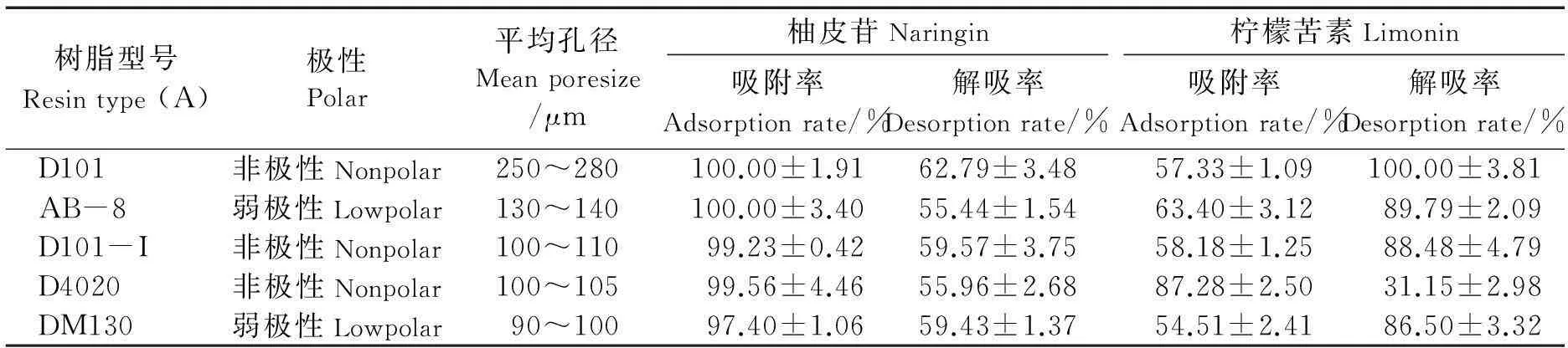
表1 5种树脂对柚皮苷和柠檬苦素的吸附能力
2.3 静态吸附等温模型
目前,大孔吸附树脂吸附作用的机制普遍归结为Freundlich或Langmuir模型,本实验采用Langmuir方程和Freundlich方程对实验数据进行拟合,柚皮苷及柠檬苦素拟合参数如表2所示.可见,Langmuir和 Freundlich等温吸附模型线性相关性符合均较好,但是相比而言,Langmuir等温吸附模型符合得更好;柚皮苷吸附在 Freundlich吸附等温式中参数n=3.61, 在2~10之间,表明吸附容易发生,而且是一个优惠吸附过程.

表2 D101树脂对柚皮苷和柠檬苦素等温吸附模型参数
2.4 静态吸附动力学曲线
由吸附量随时间的变化曲线(如图1所示)可以看出,该曲线为指数形式,吸附量刚开始的阶段上升较快,吸附5 h后基本达到平衡,说明D101树脂达到吸附平衡所需要的时间较短,对柚皮苷和柠檬苦素的选择吸附性好.
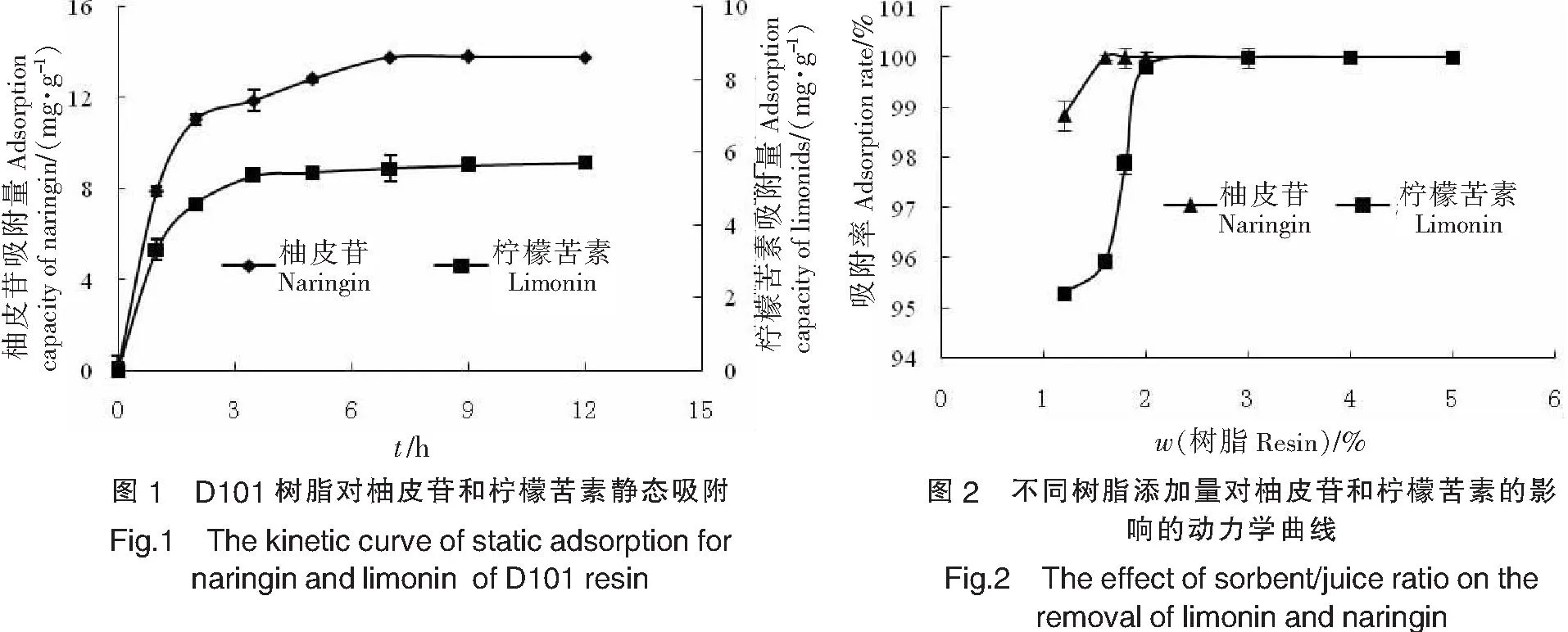
2.5 树脂添加量的确定
改变树脂添加量,在25 ℃、140 r/min条件下振荡2 h,取样测定吸附液中柚皮苷和柠檬苦素的含量,结果如图2所示.由图2可以看出,树脂添加量的增多可以提高柚皮苷和柠檬苦素的吸附率,这是由于树脂量增多使得树脂的总吸附表面积增大,一定时间内吸附的活性物质相应增多.当树脂的添加量为3.0%(质量分数)时,柚皮苷和柠檬苦素已全部被吸收.因此,确定树脂的最佳添加量为3.0%(质量分数).
2.6 吸附时间的确定
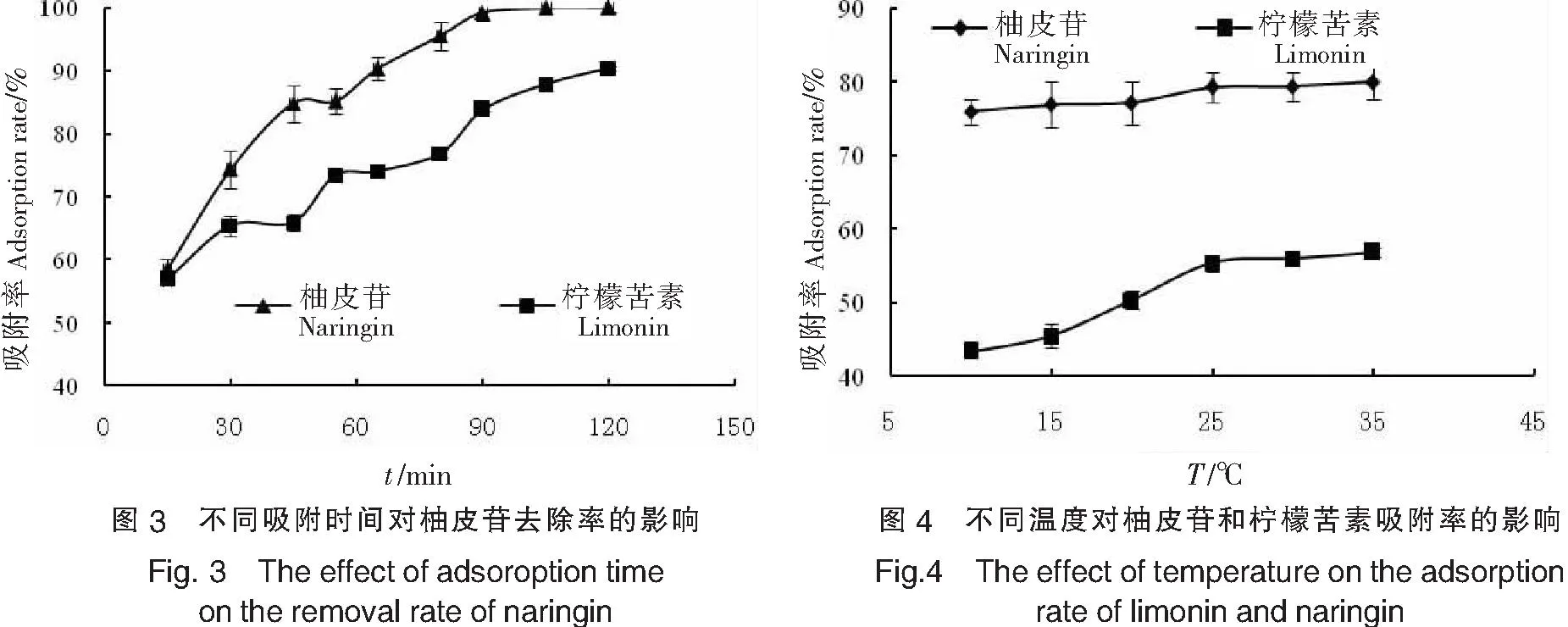
固定树脂添加量为3.0%(质量分数),在25 ℃恒温条件下,摇床以140 r/min振荡2 h,时间为15,30,45,55,65,80,90,105,120 min进行取样测定吸附液中柚皮苷和柠檬苦素的含量,结果如图3所示.由图3可知,随着吸附时间的增加,柚皮苷和柠檬苦素的吸附量呈现出增加的趋势.当吸附时间达到90 min时,柚皮苷吸附率达到稳定,柠檬苦素吸附量变化不大.因此,确定最佳吸附时间为90 min.
2.7 吸附温度的确定
固定树脂添加量为3%(质量分数),振荡速度140 r/min,吸附时间为90 min,考察温度10,15,20,25,30,35 ℃对吸附率的影响,结果如图4所示.由图4可以看出,温度对柠檬苦素的吸附率影响较大,而对柚皮苷吸附率影响较小.这可能是由于温度的升高,导致了树脂的内部结构变得更为松弛,从而增大了活性物质向树脂内渗透.由于D101树脂对柚皮苷吸附为优惠型吸附,所以温度对其影响不大,但是却增加了对柠檬苦素的吸附量.当温度为25 ℃时,柠檬苦素的吸附率随温度变化趋于平缓.因此,本试验选择25 ℃作为树脂吸附温度.
2.8 振荡速度的确定
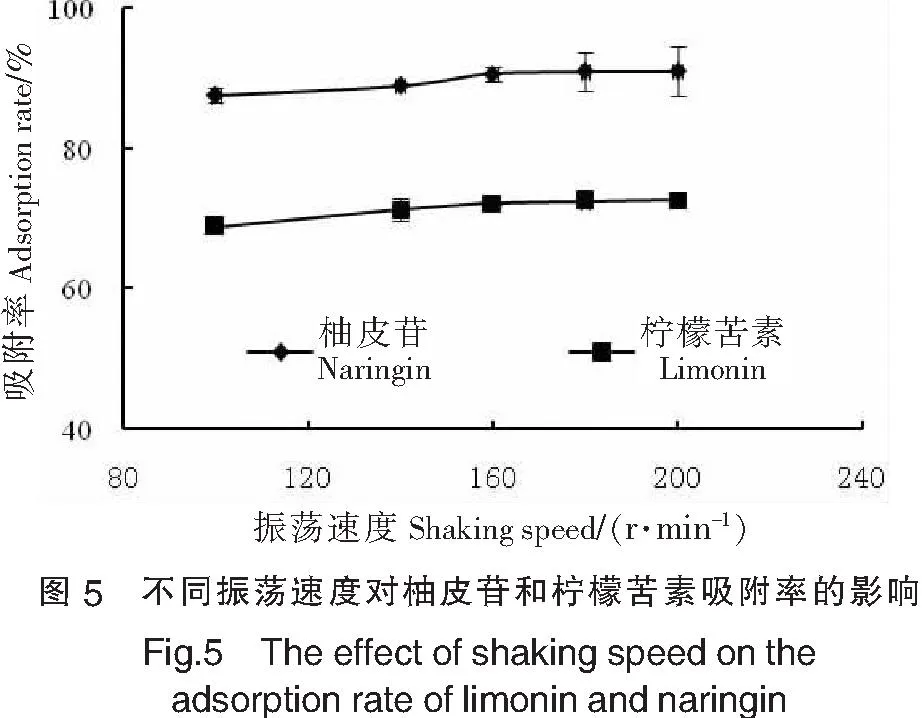
固定树脂添加量为3%(质量分数),于25 ℃恒温条件下振荡90 min,考察转速100,120,140,160,180,190 r/min对吸附率的影响,结果(见图5)表明:5个不同振荡速度下吸附率的变化不大,说明振荡速度对吸附率没有明显的影响.这可能与在100~180 r/min的转速条件下,柚皮苷和柠檬苦素均能与树脂充分接触有关.
2.9 动态洗脱及纯化结果
固定树脂添加量为3%(质量分数),于25 ℃恒温条件下,转速180 r/min振荡90 min吸附完全,动态洗脱,结果见表3.由表3可计算得洗脱下来的500 mL 70%体积分数乙醇中柠檬苦素类似物质量浓度为15.44 μg/mL,质量约7.72 mg.洗脱液蒸干后用石油醚萃取纯化,石油醚部分再蒸干后得到固体质量为8 mg,则得到柠檬苦素类似物理论上为96.5%.由于萃取过程中有一定量柠檬苦素类似物的损失,8 mg固体用100 mL乙腈溶解后测得柠檬苦素类似物浓度为(72.75±1.23) μg/mL,纯度为(90.9±1.54)%.
由图6a可以看出,用体积分数70%乙醇洗脱后的液体中基本不含柚皮苷,柠檬苦素类似物较纯,随流动相展开的成分中,在最上边有少量的其他成分,不是柠檬苦素,推测为柠檬苦素类似物.由图6b可以看出用体积分数30%乙醇洗脱后柚皮苷含量很高,且不含其他黄酮类物质.为了确定分离纯化得到的柚皮苷样品的纯度,分别对柚皮苷样品和标准品进行HPLC分析,所得结果如图7和图8所示.从图7和图8中可以看出,柚皮苷样品及标准品的色谱图的峰形及保留时间基本一致,说明样品中柚皮苷的含量较高,根据面积外标法测得柚皮苷样品的纯度为95.8%.

表3 动态洗脱结果Tab.3 Theresultofdynamicelution洗脱液Elutionliquidρ(柚皮苷Naringin)/(μg·mL-1)ρ(柠檬苦素类似物Limonoids)/(μg·mL-1)提取液Extract215.75±3.5032.75±1.01树脂吸附后Resinadsorption0030%乙醇洗脱30%ethanolelu-tion136.75±1.150500mL70%乙醇洗脱500mL70%Ethanolelution3.25±1.0315.44±1.12


3结论
1)采用热水煮提法提取柚皮中的苦味物质柚皮苷和柠檬苦素,提取液中约含有柚皮苷154.25 μg/mL,柠檬苦素53.33 μg/mL.
2)用静态吸附和静态解吸试验筛选出具有较大吸附和解吸率的D101大孔吸附树脂对提取液进行静态吸附,得出最优的吸附条件:树脂添加量3.0%(质量分数),25 ℃恒温条件下摇床以180 r/min 振荡90 min.
3)吸附完全后进行动态洗脱,洗脱液再通过石油醚3次萃取和重结晶后可有效分离纯化出柚皮苷和柠檬苦素类似物,纯化后样品用TLC法结合HPLC法有效地鉴别和测得柚皮苷纯度达到95.8%,紫外分光光度法测得柠檬苦素类似物纯度达到90.9%.
[参考文献]
[1]CHANG H Y,LEE Y B,LEE S B,et al.Purification and characterisation ofAspergillussojaenaringinase:the production of pruning exhibiting markedly enhanced solubility with in vitro inhibition of HMG-CoA reductase[J].Food Chemistry,2011,124:234-241.
[2]贾冬英,姚开,谭敏,等.柚皮中柚皮苷的乙醇提取工艺研究[J].中草药,2002,33(9):801-802.
[3]胡阳,倪辉,邬应龙,等.琯溪蜜柚中主要苦味物的丙酮提取工艺研究[J].食品科学,2007,28(4):152-155.
[4]LEE M K.Supplementation of naringenin and its synthetic derivative alters antioxidant enzyme activities of erythrocyte and liver in high cholesterol-fed rats[J].Bioorganic & Medicinal Chemistry,2002,10(7):2239-2244.
[5]SINGH D.Protective effect of naringin,a bioflavonoid on ferric itrilotriacetate-induced oxidative renal damage in rat kidney[J].Toxicology,2004,201:1281.
[6]JEON S M.Antioxidative activity of naringin and lovastatin in high holesterol-fed rabbits[J].Life Sciences,2001,69:2855-2866.
[7]NG T B,LIU F,WANG Z T.Antioxidative activity of natural products from plants[J].Life Sciences,2000,66(8):709-723.
[8]YUNG C H,WU H K,PEI N C,et al.Flavanone and 2′-OH flavanone inhibit metastasis of lung cancer cells via down-regulation of proteinases activities and MAPK pathway[J].Chemico-Biological Interactions,2007,167(3):193-206.
[9]LAKE B G,BEAMAND J A,TREDGER J M,et al.Inhabition of xenobiotic-induced genotoxicity in cultured precision-cut human and rat liver slices[J].Mutation Research,1999,440:91-100.
[10]CHEN Y C.Rutinoside at C7 attenuates the apoptosis-inducing activity of flavonoids[J].Biochemical Pharmacology,2003,66:1139-1150.
[11]SHU L Y.Flavonoids suppresses the enhancing effect of 13-carotene on DNA damage induced by 4-(methylnit rosamino)-1-(3-pyridy)-1-butanone(NNK)in A549 cells[J].Chemico-Biological Interaction,2006,160:175-182.
[12]黄华艺,查锡良.黄酮类化合物抗肿瘤作用研究进展[J].中国新药与临床杂志,2002(7):428- 433.
[13]SEO H J.Role of naringin supplement in regulation of lipid and ethanol metabolism in rats[J].Life Sciences,2003,73:933-946.
[14]朱琦,卞卫和,李永刚.乳腺增生病中医外治法研宄进展[J].中医药导报,2011,17(12):79-81.
[15]温靖,施英,徐玉娟,等.柑橘果实中柠檬苦素抗炎镇痛作用的研宄[J].食品科学,2007,28(11):515-518.
[16]施英,徐玉娟,吴娱明,等.桔核中柠檬苦素类物质消炎镇痛作用的研宄[J].天然产物研宄与开发,2007,19:456- 458.
[17]郭育铭,郑旭煦,殷钟意,等.柠檬苦素类似物的研宄进展[J].重庆工商大学学报(自然科学版),2008,25(6):639-641,653.
[18]MISHRA P,KAR R.Treatment of grapefruit juice for bitterness removal by amberlite IR120 and IR400 and alginate entrapped naringinase enzyme[J].Journal of Food Science,2003,68(4):1229-1235.
[19]LEE H S,KIM G.Efects of debitterintg on red grapefruit juice concentrate[J].Food Chemistry,2003,82(2):177-180.
[20]吴长庆.柑桔果汁中的苦味物质及其去除方法[J].中国商办工业,2000(2):53-54.
[21]邢建荣,夏其乐,程绍南,等.胡柚汁脱苦工艺的研究[J].中国食品学报,2009,4(9):130-136.
[22]张庆芳,杨国栋,胡显峰,等.花生壳对Cr(VI)的等温吸附模型研究[J].四川环境,2011,30(2):1-3.
(责任编辑马建华英文审校曹敏杰)
Extraction and Purification of Naringin and Limonoids from Pomelo PeelYANG Qiu-ming1,2,3,4,LI Jing-ya1,XIAO An-feng1,2,3,4,CHEN Jun1,2,3,4
(1.College of Food and Biological Engineering,Jimei University,Xiamen 361021,China;2.Key Laboratory of Food
Microbiology and Enzyme Engineering of Fujian Province,Xiamen 361021,China;3.Research Center of Food Biotechnology
of Xiamen,Xiamen 361021,China;4.Key Laboratory of Recycling Application and Deep Processing in Economic Marine
Alga,Xiamen South Oceanographic Research Center,Xiamen 361021,China)
Abstract:Bitterness active components such as naringin and limonoids were extracted by heating water.By means of adsorption-desorption experiments,the macro porous resin D101 was selected for isolation and purification of naringin and limonoids from pomelo peel due to its higher adsorption and desorption rate.The adsorption condition was optimized in the presence of 3% resin with absorption time of 90 min,at 25 ℃ and rotation speed of 180 r/min.After complete adsorption,the resulting solution was applied to dynamic-state elution.Naringin and limonoids were separated and purified effectively via concentration of the eluent and recrystalization.The samples thus prepared were determined by HPLC and UV spectrophotometer,the purities of naringin and limonoids reached 95.8% and 90.9%,respectively.
Key words:naringin;limonoids;macro porous resin;separation and purification
[中图分类号]TS 255.1
[文献标志码]A
[文章编号]1007-7405(2015)06-0414-07
[作者简介]杨秋明(1977—),男,高级实验师,主要从事食品微生物及工艺方面的研究.通信作者:陈俊(1977—),男,副教授,从事药学研究,E-mail:chenjun@jmu.edu.cn.
[基金项目]国家自然科学基金资助项目(31271914);福建省科技计划重点项目(2011N1008);福建省教育厅科技项目(JA11160)
[收稿日期]2014-09-30[修回日期]2015-09-28
