野生南荻与芒杂种多倍体诱导研究
2015-03-03黄丽芳殷绪明杨宇晨李伟丽易自力
黄丽芳,殷绪明,杨宇晨,李伟丽,易自力*
(1 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙 410125;2 湖南农业大学 生物科学技术学院,长沙 410128)
野生南荻与芒杂种多倍体诱导研究
黄丽芳1,殷绪明1,杨宇晨2,李伟丽1,易自力2*
(1 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙 410125;2 湖南农业大学 生物科学技术学院,长沙 410128)
摘要:用不同浓度秋水仙素处理野生南荻×芒(Miscanthuslutarioriparia×Miscanthussinensis)远缘杂交后代以诱导产生多倍体,并对变异株进行形态学和细胞学鉴定,以期获得稳定的四倍体植株并分析其生理特性。结果表明:(1)采用秋水仙素加入培养基处理法和秋水仙素溶液浸泡处理法都可获得一定频率的多倍体植株;胚性愈伤组织以0.2%秋水仙素浸泡处理48 h的诱变效果较好,四倍体诱导率达8.7%;芽在0.05%秋水仙素培养基中处理15 d较好,四倍体诱导率达10.6%;生根苗在0.1%秋水仙素培养基中处理10 d较好,四倍体诱导率达11.1%。(2)经体细胞染色体计数,加倍植株染色体数为2n=4x=76,对照植株的染色体数目为2n=2x=38。(3)生长2年的多倍体植株形态、叶片大小、茎粗、茎壁厚、节间等性状表现出巨大性和超亲优势。
关键词:芒属植物;杂交后代;染色体加倍;秋水仙碱;异源四倍体
芒属(Miscanthus)植物俗称芒草,是一种新型的纤维素类能源植物。芒属植物具有高光效、低呼吸、CO2补偿点低、生长快、适应性强、抗逆性强、生物产量高等特点,除了作为能源植物开发外,还可用于造纸和作为水土保持、生态修复植物应用[1-7]。在芒属植物中,芒(Miscanthussinensis)、五节芒(Miscanthusfloridulus)、荻(Miscanthussacchariflora)、南荻(Miscanthuslutarioriparia)等4个种的利用价值最大,但各有优点。为了选育出高生物产量、强适应能力和优良能源利用品质的芒属能源植物新品种,以满足生物质能源产业的实际需要,还必需开展芒属植物的遗传改良。
通过染色体加倍技术,人工创造多倍体,是获得高生物质产量芒属植物新品种的有效途径之一。何立珍等[8]采用组培诱变方法,获得了第一个南荻同源四倍体新资源“芙蓉南荻”,发现其产量大幅度提高,纤维质量更好。该品种通过常规的造纸试验证明,碱耗低,易成浆,制浆得率高,是一种优良的造纸纤维原料[9]。张闯等[10]通过秋水仙素诱导获得的另一南获同源四倍体,具有较强光合特性,其株高、茎粗以及干物质量均高于普通二倍体。但诱导产生的全部是同源四倍体,即品种自身加倍。从遗传进化的角度看,它们的亲缘关系太近。所以南荻同源四倍体的最大缺点就是株型散生。
芒属植物具有自交不亲和特征,且种间可以进行杂交,现在多采用远缘杂交育种手段,将优良基因转入到栽培种中创造新种质。目前,欧洲国家正在推广的一种主要能源植物——奇岗(M.giganteus)就是一种芒与荻种间自然杂交而产生的异源三倍体[11-12]。‘湘杂芒2号’是湖南农业大学芒属植物研究所以野生南荻(M.lutarioriparius)为母本和芒(M.sinensis)为父本,通过人工远缘杂交培育出的种间杂交新品种,其叶片、株高、株型和腋芽的形态学性状均介于双亲之间,具高产、优质、抗病虫和耐逆性强等优点,但其茎秆细弱,生长期遇大暴风雨易发生倒伏。
解决远缘杂交和多倍体问题的策略是异源多倍体化[13]。实践证明,已成功获得油菜(Brassica)[14]、拟南芥(Arabidopsis)[15]和棉花(Gossypium)[16]的异源多倍体,多表现出超亲优势和器官巨大性。因此,本研究特以野生南荻×芒(M.lutarioriparia×M.sinensis)远缘杂交新品种‘湘杂芒2号’为材料,利用秋水仙素诱导其染色体加倍,旨在获得高产、优质、多抗的异源多倍体新品系。
1材料和方法
1.1实验材料
外植体材料来自于芒属植物杂交种‘湘杂芒2号’,是湖南农业大学培育出的南荻(M.lutarioriparius)与芒(M.sinensis)远缘人工杂交种,经体细胞染色体鉴定为二倍体,数目为2n=2x=38。选择‘湘杂芒2号’继代的胚性愈伤组织、离体芽尖和生根苗为诱导多倍体的外植体。生物学性状分析材料为杂种二倍体与四倍体试管苗移植田间的植株。
1.2组织培养及秋水仙碱处理的方法
用含5.0 mg/L 2,4-D和1.0 mg/L 6-BA培养基进行幼穗愈伤组织诱导和培养;用含2.0 mg/L 6-BA和0.2 mg/L IAA培养基进行分化和增殖;用含0.5 mg/L NAA和1.0 mg/L PP333(多效唑)培养基进行生根培养(基本培养基均为MS)。选用秋水仙素作为诱导剂,胚性愈伤组织在形成绿点的第3、第5和第7天用秋水仙碱浸泡处理,浸没在0.1%、0.2%、0.3%秋水仙碱溶液中处理48和72 h;选择1~2 cm高的芽和生根苗接种在添加0.05%、0.1%秋水仙碱的MS培养基上共培养5、10、15 d,同时将同浓度秋水仙碱溶液点滴2片子叶中间的生长点,共培养结束后转接至上述分化和增殖培养基中。为了提高秋水仙碱的渗透率,在被测试的应用溶液中均加入1.5%的二甲亚砜(DMSO)。每种方法重复3次,并且每次不少于30个处理。120 d后,将诱变成活的试管苗转入生根培养基中培养;从中选择变异明显的植株进行DNA的相对含量鉴定;对DNA相对含量已加倍的再生苗,进行根尖染色体制片,根据染色体数判断其倍性,并统计诱导率(诱导率=四倍体植株数/成活植株数×100%)。对染色体鉴定为多倍体的部分植株进行扩大繁殖,另一部分移栽至大田生长。
1.3多倍体鉴定方法
(1)形态学观测经植株大小、叶片颜色、叶形等外部形态观察比较后,完成初步筛选。
(2)流式细胞仪检测参考周玥玥等[17]的方法,初步确定染色体倍性。
(3)细胞遗传学鉴定经细胞流式仪检测的DNA相对含量已加倍的再生苗,在幼苗根长至1~2 cm时,切取4~6 mm根尖,用文献[18]建立的芒属植物染色体核型分析方法,对根尖进行染色体制片,在显微镜下观察染色体数目并确定植株倍性。
1.4四倍体与二倍体主要性状观察
以杂种后代二倍体和四倍体为材料,移栽大田生长2年,随机抽取10株,用同一标准测量植株的各形态指标,进行对比分析。测量标准如下:
(1)株高:直尺测量开花植株茎的基部到植株茎的最高点的垂直距离,取平均值;(2)茎粗:游标卡尺测量植株中部附近最粗的茎的直径,同一株各测5个值计算取平均值。(3)茎壁厚:剪开植株中部附近最粗的茎的节间,用游标卡尺测量茎壁厚度,在同一横截面取3个值计算取平均值。(4)叶长、叶宽和叶厚:直尺测量叶片与叶鞘结合处到叶片尖端的距离为叶长;游标卡尺测量叶片最宽处叶缘间的距离为叶宽;游标卡尺测量每片叶中部靠近叶脉处的厚度为叶厚;同一株各测10个值计算取平均值。(5)节间:直尺测量植株中部附近最粗的茎的节间距离,同一株各测10个值计算取平均值。
1.5统计分析
利用 Microsoft Excel作数据处理,采用DPS统计软件对数据作差异显著性分析与相关性分析。
2结果与分析
2.1秋水仙素加入培养基处理对芽和生根苗多倍体的诱导
对离体芽尖进行秋水仙碱处理,从成活的151个芽中发现6个四倍体和11个嵌合体芽(7.2%);对生根苗进行秋水仙碱处理,从成活的52个芽中发现3个四倍体和6个嵌合体(11.5%)。从表1看出,随体积浓度升高和处理时间延长,秋水仙素处理致使外植体死亡率增加,但在体积浓度适中的情况下,总体死亡率较低,且能获得较高变异率。0.05%或0.1%秋水仙素处理生根苗和离体茎尖5 d,没有发现四倍体植株;0.05%秋水仙素处理芽15 d、0.1%秋水仙素处理生根苗10 d,这2个组合加倍效果较好,加倍率分别为10.6%和11.1%。
2.2秋水仙素溶液浸泡处理对愈伤组织细胞多倍体的诱导
对胚性愈伤组织进行秋水仙素溶液浸泡处理,获得148株成活试管苗,检测后发现4个多倍嵌合体(2.7%)和6个四倍体。多倍体出现的频率随体积浓度的升高和处理时间的延长而增加,小于0.1%秋水仙素体积浓度处理对诱导多倍体作用小;0.1%及其以上体积浓度处理对诱导产生多倍体效果较好,但随体积浓度增加秋水仙素对外植体的毒害作用增大,最高体积浓度(0.3%)处理(72 h)将杀死几乎所有的外植体;以处理浓度0.2%、处理时间48 h的组合效果最好,四倍体诱导率达到8.7%。
2.3秋水仙素处理对再生试管苗的影响
愈伤组织经秋水仙素诱变处理后,继代于分化培养基中,培养初期(15~20 d)芽块表面出现褐化现象,继续培养30 d,逐步长出少量绿色小芽(图版Ⅰ,1),得到的小芽第二次继代后活性较高,部分试管苗植株粗壮,叶片增厚,表面出现轻微皱折,叶色深绿,部分叶片畸形,但植株生长速度慢。白化植株的频率,尤其是来自愈伤组织用秋水仙碱处理后其数量明显的增加,由于白化植株倍性难以确定而被丢弃,秋水仙素的浓度和浸入时间对白化苗的生长没有明显影响。
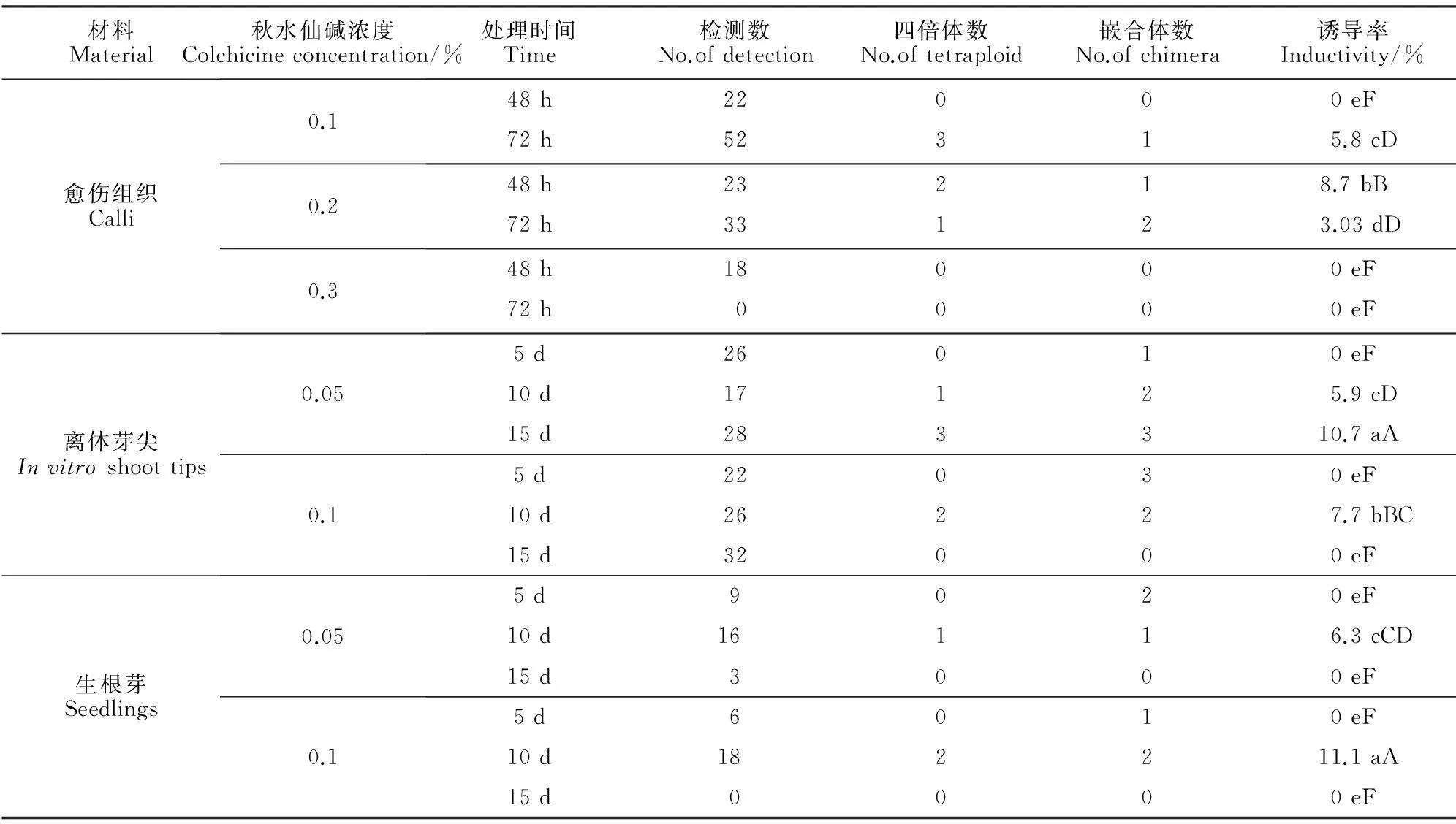
表1 离体培养条件下秋水仙碱的诱变效果
注:诱导率列数据后不同小写和大字母分别表示0.05和0.01水平显著性差异。
Note:The inductivity data with normal and capital letters mean significant difference at 0.05 and 0.01 level.
经秋水仙碱处理过的离体茎尖和生根苗,其生长和增殖受到不同程度的抑制,成活率随秋水仙碱浓度的增高和处理时间的延长而降低。处理后的试管苗生长缓慢,胚轴增粗呈棒状,幼根根尖肿大呈鼓锤状或褐色,其增粗程度随体积浓度提高或随处理时间延长呈加剧趋势;其次是处理后的试管苗均表现出一定的变异。秋水仙碱体积浓度为0.05%或0.1%,处理5 d芽没有受害状,产生的新苗数量多,但多为二倍体植株;处理10 d以上芽发生明显变化,主要表现为芽胚轴膨大成棒状(图版Ⅰ,2),幼根根尖肿大呈鼓锤状或褐色(图版Ⅰ,3),叶片肥厚、变宽、叶色深绿;处理时间超过15 d时,大部分芽褐变,顶端生长点和胚根生长点受到严重抑制,在培养过程中均先后死亡或是停止生长分化。
2.4多倍体的鉴定
2.4.1形态学鉴定与对照(图版Ⅰ,4) 试管苗相比,经过处理的部分试管苗表现出扭曲矮化、生长缓慢、茎秆变粗、叶片增厚、叶变宽、叶片颜色加深、叶表面粗糙呈泡状等植株形态变异(图版Ⅰ,5)。基于形态学变异,从351株成活苗中初步筛选出106株疑似四倍体试管苗(30.19%)。对诱变成功的四倍体植株进行增殖,仍然表现出器官巨大性,茎段粗壮,叶片比二倍体大而厚,甚至叶形都发生了显著的变化,由狭长变为钝圆(图版Ⅰ,6)。因此,不定芽增殖是保存和扩繁新种质的有效途径,但增殖的新芽倍性有待进一步的研究。
试管苗移栽后,比较生长2年的四倍体与对照二倍体植株(图版Ⅰ,7),发现2年后的四倍体植株形态性状与双亲有较大差异,且大多表现出超亲优势(表2)。依据性状的差异,四倍体植株在株高、株型(图版Ⅰ,8)、叶宽(图版Ⅰ,9)、叶厚、茎粗(图版Ⅰ,10)、茎壁厚、节间长等性状表现出超亲优势。四倍体植株高大,茎杆粗,生物产量高,表现为偏母本性状;株型紧凑,茎秆直立密集,表现为偏父本性状;节间着生腋芽,可作为区分杂种和双亲的形态标记指标。总体来说,异源多倍体表现出器官巨大型,大多高于两亲本,表现出超亲优势,长势更强。
2.4.2流式细胞仪鉴定以杂种二倍体植株为参照,对形态明显变异植株进行流式细胞仪分析,分析DNA相对含量确定二倍体、四倍体和嵌合体植株。通过比较DNA相对含量分布图(图1),初步判断有36株试管苗(图1,A)的荧光通道值大致在杂种二倍体(图1,B)荧光通道值的2倍处。根据DNA相对含量看,初步筛选的变异植株33.96%为四倍体。除四倍体外,还检测出少量嵌合体,其DNA相对含量图与混合样的DNA相对含量图较相似(图1,C)。此外,还有一些处理组植株的DNA相对含量图与对照相似,此类植株为未成功诱导加倍的植株。

表2 生长2年的四倍体与二倍体植株形态学比较
注:数据以平均值±标准表示;同列不同小写、大写字母分别表示0.05和0.01水平差异显著。
Note:Data is mean value±standard deviation;The different normal and capital letters means significant difference between the tetraploid and diploid at 0.05 and 0.01 levels,respectively.
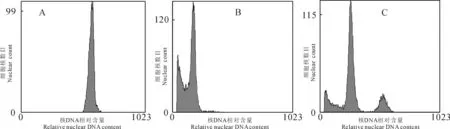
图1 二倍体与四倍体再生苗的相对DNA含量
2.4.3染色体制片技术检测细胞学染色体计数法可直接观察染色体并计数,是一种可靠、直观的鉴定倍性的方法。杂种二倍体材料(图版Ⅱ,1)染色体2n=2x=38(x=19),而筛选出的变异植株50%~60%染色体数超过38条,但由于染色体小,染色体重叠等,只有15株制片清楚显示四倍体(图版Ⅱ,2)2n=4x=76(x=19)。根据可数染色体数接近76的情况看,初步筛选的变异植株41.7%为四倍体。在变异植株中也发现染色体多样性,如染色体缺失(2n=31;图版Ⅱ,3),染色体增加(38<2n<76;图版Ⅱ,4),染色体重叠(图版Ⅱ,5)。
3讨论
通过组织培养技术对远缘杂交种F1代进行大量扩繁后,采用秋水仙素进行化学诱导异源多倍体,通过鉴定获得15个异源四倍体株系,建立了芒属植物远缘杂交和多倍体双重优势育种的新途径。
试验中,采用秋水仙素加入培养基处理法和秋水仙素溶液浸泡处理法都可获得一定频率的多倍体植株;胚性愈伤组织浸泡处理获得了较多的成活试管苗,嵌合体频率低,但秋水仙素溶液浸泡处理法对愈伤组织的伤害较直接,且要经过多次的转移和冲洗,增加了受污染的几率;离体芽尖在培养基上共培养获得了较多的成活试管苗,操作简单,嵌合体频率较低;生根苗在培养基上共培养,操作虽简单,诱变率高,但获得很高频率的嵌合体,且生根苗所有处理的植物都通过根吸收秋水仙碱,要比愈伤组织和离体芽尖对秋水仙素的处理更敏感,导致大部分外植体褐化死亡。综上所述,秋水仙素溶液浸泡处理法不论在操作还是在加倍效果上均不如秋水仙素加入培养基处理法,离体芽尖共培养要比生根苗效果好。因此,处理离体芽尖是一种诱导芒属植物多倍体的有效方法。
本研究基于形态学变异和流式细胞仪初步判断再生植株的变异率分别为30.19%、33.96%,进一步的染色体鉴定表明,其中有41.7%为真实的多倍体植株。形态观察是最简单而直观的倍性鉴定方法,也是最粗放的鉴定方法。所以通过形态学对倍性进行初步的判断,有利于减少工作量。流式细胞仪具有方便、快速、可重复性强等优点,但不能区分染色体丢失或者增加的现象。染色体鉴定的操作虽然比较繁琐,但染色体数目的细胞学鉴定无疑是多倍体鉴定中最可靠最直接,也是目前应用最多的方法。本研究也是通过染色体计数的方法最终确定了四倍体的真实性。因此,综合运用形态学、流式细胞仪及染色体压片,是鉴定多倍体的有效方法,既简单、快捷,又能保证准确性。
异源四倍体的诱导是以已鉴定为远缘杂交种的F1代作为材料,使来源不同的2条染色体得到加倍,从而达到试验预期的目的。杂种F1代的母本南荻特征为散生状,茎秆自立稀疏,植株高大,茎粗,节间着生腋芽,甚至萌发成侧枝。而父本芒特征为丛生状,茎秆直立密集,株高和茎径较小,节间无腋芽,叶片直立;杂种F1代综合了南荻和芒的特点,植株丛生状,茎秆自立密集,植株高、茎径介于双亲,节间着生腋芽。生长2年的杂种F1代异源四倍体植株形态性状不仅出现介于两亲本之间的性状,还可以出现某些超亲性状,甚至产生一些双亲都没有的新性状。例如,四倍体植株株型紧凑,茎秆粗壮,叶片浓绿,叶片长度宽度也都比两亲本和其他二倍体杂种要大,可以看出明显的优势,其优势正好解决了南荻同源四倍体株型散生和杂种F1代茎秆细弱等方面的缺点。实践证明,利用远缘杂交和多倍体双重优势是获得高产优质新品种的一条有效途径。
参考文献:
[1]HOLME I B,KROGSTUP P,HANSEN J.Embryogenic callus formantion,growth and regeneration in callus and suspension cultures ofMiscanthusogiformisHonda ‘Giganteus’ as affected by proline[J].PlantCellTissOrg.,1997,50(3):203-210.
[2]PETERSEN K K,HANSEN J,KROGSTRUP P.Significance of different carbon sources and sterilization methods on callus induction and plant regeneration ofMiscanthusogiforisHonda ‘Giganteus’[J].PlantCellTissOrg.,1999,58(3):189-197.
[3]LEWANDOWSKI I,CLIFTON-BROWN J C,SCURLOCK J M O.Miscanthus:european experience with a novel energy crop[J].BiomassandBioenergy,2000,19(4):209-227.
[4]ROWE R L,STREET N R,TAYLOR G G.Identifying potential environmental impacts of large-scale deployment of dedicated bioenergy crops in the UK[J].RenewSustenergRev.,2009,13(1):271-290.
[5]SANG T,ZHU W.China’s bioenergy potential[J].GlobalChangeBoil.,2011,3(2):79-90.
[6]LIU M X(刘明稀),JIANG J X(蒋建雄),YI Z L(易自力).Application of cell engineering in improvingMiscanthusas a dedicated bioenergy crop[J].ActaPrataculturaeSinica(草业学报),2011,20(4):261-269(in Chinese).
[7]YI Z L(易自力).Exploitation and utilization ofMiscanthusas energy plant[J].JournalofHunanAgriculturalUniversity(Nat.Sci.Edi.)(湖南农业大学学报·自然科学版),2012,38(5):455-463(in Chinese).
[8]HE L ZH(何立珍),ZHOU P H(周朴华),LIU X M(刘选明),etal.Studies on the autotetraploid ofTriarrhenalutarioripariaL.Liou.sp.nov.[J].ActaGeneticaSinica(遗传学报),1997,24(6):544-549(in Chinese).
[9]SONG SH J(宋善军),JIANG H H(蒋红花),SONG L ZH(宋连珍),etal.Comparison of pulping and papermaking performance between the hmology tetraploid ofMiscanthussacchariflorusand diploid[J].HunanPapermaking(湖南造纸),1999,(3):13-15(in Chinese).
[10]ZHANG CH(张闯),WANG H Q(王惠群),TONG J H(童建华),etal.Study on the photosynthetic physiological characteristics of autotetraploid ofTriarrhenalutarioripariaL Liu.[J].CropResearch(作物研究),2013,27(3):219-223(in Chinese).
[11]RICHARD PYTER,EMILY HEATON,FRANK DOHLEMAN.Agronomic experiences withMiscanthus×Giganteusin Illinois,USA.Methods in Molecular Biology[M].New York:Springer,2009,581:41-52.
[12]XI Q G(席庆国),HONG H(洪浩).Description of an introduced plantMiscanthus×giganteus[J].PrataculturalScience(草业科学),2008,25(2):26-28(in Chinese).
[13]CAI D T(蔡得田),YUAN L P(袁隆平),LU X G(卢兴桂).A new strategy of rice breeding in the 21st century[J].ActaAgronomicaSinica(作物学报),2001,27(1):110-116(in Chinese).
[14]SCHRANZ M E,OSBORN T C.Novel flowering time variation in the resynthesized polyploidBrassicanapus[J].JournalofHeredity,2000,91(3):242-246.
[15]COMAIL L,TYAGI A Q,WINTER K.Phenotypic instability and rapid gene silencing in newly formedArabidopsisallopolyploids[J].ThePlantCell,2000,12(9):1 551-1 567.
[16]JIANG C,WRIGHT R,EL-ZIK K.Polyploid formation created unique avenues for response to selection inGossypium(cotton)[J].Proc.Natl.Acad.Sci.,1998,95(8):4 419-4 424.
[17]ZHOU Y Y(周玥玥),CHEN ZH Y(陈智勇),HUANG L F(黄丽芳),etal.Establishment of aninvitrosystem for regeneration and polyploid induction ofMiscanthusfloridulus[J].JournalofHunanAgriculturalUniversity(Nat.Sci.Edi.)(湖南农业大学学报·自然科学版),2012,(10):487-490(in Chinese).
[18]DU F(杜凤),JIANG J X(蒋建雄),LU Y F(卢玉飞),etal.Establishing of karyotype analysis system ofMiscanthus[J].ProgressinModernBiomedicine(现代生物医学进展),2009,9(10):1 878-1 880(in Chinese).

图版 Ⅰ1.秋水仙素处理过的愈伤;2.秋水仙素处理过的芽;3.秋水仙素处理过的生根苗;4.二倍体组培苗;5.四倍体组培苗;6.四倍体增殖苗;7.杂种二倍体植株;8.四倍体植株;9.杂种二倍体叶(左)和四倍体叶片(右);10.二倍体茎(左)和四倍体茎(右)。
Plate ⅠFig.1.Calli treated with colchicine;Fig.2.Buds treated with colchicine;Fig.3.Seedlings treated with colchicine;Fig.4.The diploid plantletinvitrotissue culture;Fig.5.The tetraploid plantletinvitrotissue culture;Fig.6.The proliferation seedlings of tetraploid;Fig.7.Hybrid diploid plants;Fig.8.Tetraploid plants;Fig.9.The leaves from hybrid diploid plants(left) and tetraploid plants(right);Fig.10.The shoots from hybrid diploid plants(left) and tetraploid plants(right).
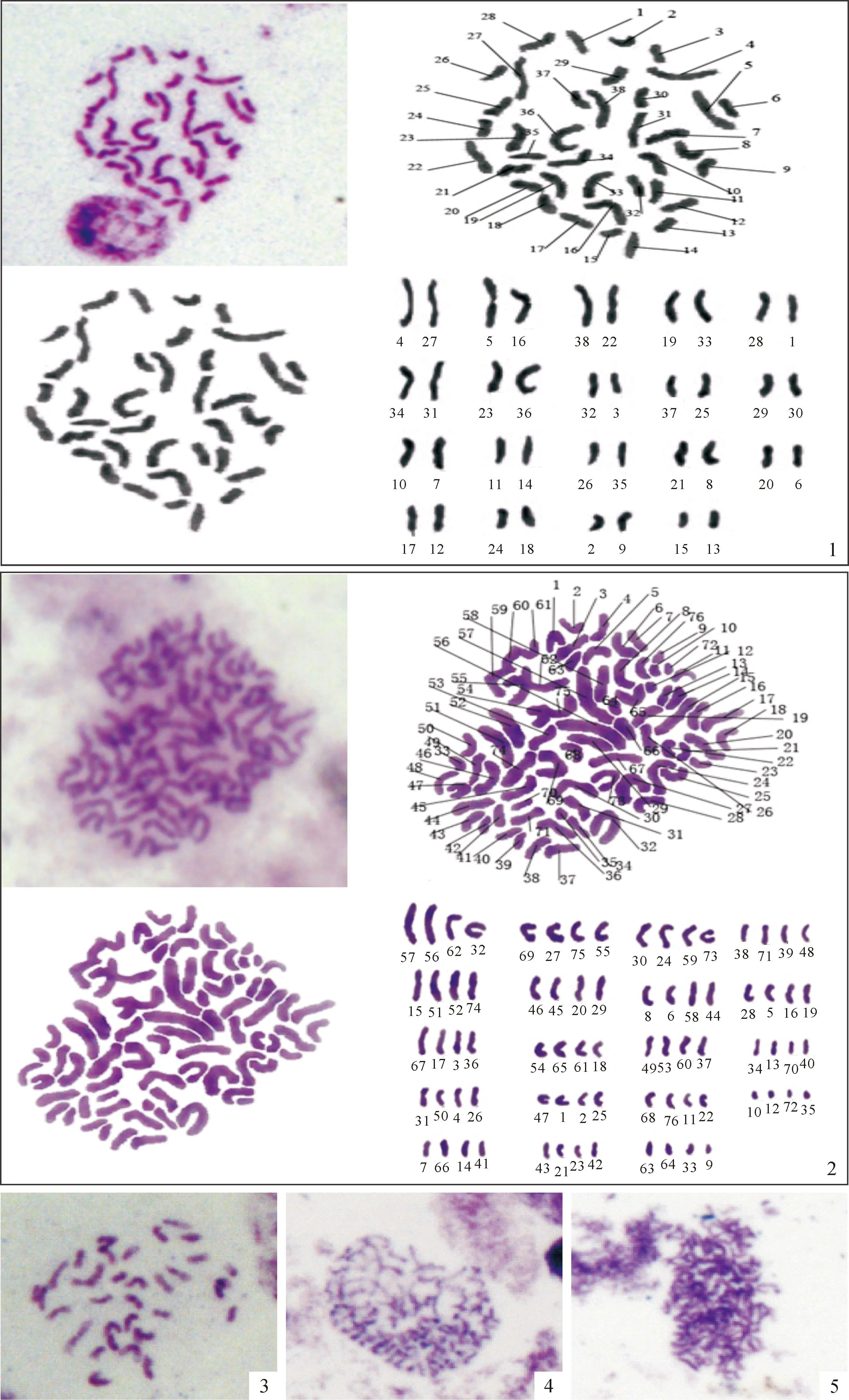
图版 Ⅱ二倍体与四倍体再生苗的染色体核型分析,×1 000
1.杂种二倍体染色体形态和核型图;2.四倍体染色体形态和核型图;3.染色体缺失;4.染色体增加;5.染色体重叠。
Plate ⅡThe karyotype of the regenerated plantlets from the diploid and tetraploid,×1 000
Fig.1.The chromosomes morphology and karyotype of hybrid dipoidand;Fig.2.The chromosomes morphology and karyotype of tetraploid;Fig.3.Chromosome deficiency;Fig.4.Chromosome increased;Fig.5.Chromosome duplication.
(编辑:宋亚珍)
Polyploid Induction on the Hybrid of
Miscanthuslutarioriparia×Miscanthussinensis
HUANG Lifang1,YIN Xuming1,YANG Yuchen2,LI Weili1,YI Zili2*
(1 Key Laboratory of Agro-ecological Processes in Subtropical Region,Institute of Subtropical Agriculture Chinese Academy of Sciences,Changsha 410125,China;2 College of Bioscience & Biotechnology,Key Laboratory of Cell Engineering,Hunan Agricultural University,Changsha 410128,China)
Abstract:In this study,the F1generation from wildMiscanthuslutarioriparia×Miscanthussinensishybridization was used to induce tetraploid and then characterize the morphology,cytology.and physiological property.The results obtained from the experiment showed that:(1)The polyploid plants were produced through treatment in medium or solution supplemented with different concentrations of colchicine.The induction frequency of tetraploid plants was 8.7% by using the embryogenic callus as material under the treatment of soaking in solution containing 0.2%(W/V) colchicine for 48 h,and the rate of tetraploid plants induced from bud was 10.6% on the treatment medium with colchicine 0.05%(W/V) for 15 d;The rate of tetraploid reached 11.1% from seedling with 0.1%(W/V) colchicine treatment on the medium for 10 d.(2)The chromosome identification showed that the chromosome number of polyploid is 2n=4x=76,and the wild type plant is 2n=2x=38.(3)The polyploid showed better heterobeltiosis under normal growth conditions with higher plant height,thicker shoot and bigger leaves compared to parents.
Key words:Miscanthus;hybrids proganic;chromosome doubling;colchicines;allotetraploid
中图分类号:Q813.5
文献标志码:A
