30 例外侧裂区胶质瘤的显微手术分析
2015-03-02徐英辉廉治刚赵永顺姚轶群
李 俊,徐英辉,廉治刚,董 斌,赵永顺,傅 鑫,姚轶群,李 涛
(大连医科大学附属第一医院1.神经外科;2.体检科,辽宁 大连116011)
胶质瘤手术质量不仅直接影响病人的生存质量,而且与术后的肿瘤复发、放化疗等非手术综合治疗效果以及患病生存期密切相关[1-3]。而外侧裂区胶质瘤因该区血管及脑组织解剖结构复杂,完全切除此区域胶质瘤难度较大,尤其是跨侧裂区胶质瘤,手术中须顾及多部位脑叶及外侧裂区血管组织,完全切除胶质瘤难度更大。2009年9月至2014年9月,大连医科大学附属第一医院对30 例外侧裂区胶质瘤行显微外科手术,手术治疗效果比较满意,现总结分析如下。
1 资料与方法
1.1 一般资料
本组患者30 例,男19 例(63. 3%),女11 例(36.7%),平均年龄(50.4 ±13.36)岁,病程2 h ~10年不等,术前KPS 均≥70 分。首发症状:头痛或头晕21 例,癫痫发作7 例,记忆力下降7 例,对侧肢体肌力II ~IV 级6 例,言语不清2 例,视物模糊2例,幻嗅3 例。具体见表1。影像学检查:肿瘤位于左外侧裂区12 例,右外侧裂区18 例,肿瘤均累及两个及以上脑叶。30 例均行头部CT 初步检查,平扫可见低密度或等高密度影,高级别胶质瘤增强后出现明显周边强化,周围水肿明显。根据肿瘤与额、颞、岛叶的位置关系,侧裂区胶质瘤分为4 种类型[4],即额叶型、颞叶型、岛叶型、混合型。本组额叶型10 例,颞叶型14 例,岛叶型3 例,混合型3 例。术前MRI 显示低级别胶质细胞瘤MRI 表现为均匀的长T1、长T2,强化及周围水肿较少,高级别胶质细胞瘤表现为不均匀的长Tl 及长T2,不规则强化,偶有囊性变及肿瘤卒中出血表现。见表2、图1。

表1 患者一般资料Tab 1 General information of patients

表2 患者术前影像资料Tab 2 Preoperative iconography information of patients
1.2 手术方法
气管插管全麻,常规消毒铺巾,根据胶质瘤部位及周围水肿带大小,采用改良翼点或扩大翼点入路,头皮夹止血,钻孔后铣刀开颅,咬除蝶骨嵴外端,悬吊硬膜止血,快速静点20%甘露醇250 mL,打开硬膜,显微镜下解剖外侧裂,释放侧裂池,充分减压后分离并保护外侧裂浅静脉,根据肿瘤位置选择性从额侧或颞侧入路,仔细分离肿瘤周围血管及脑组织,分块切除,确定镜下切除肿瘤范围满意,创面止血充分,止血纱覆盖,冲洗瘤腔,严密修补缝合硬膜,还纳固定骨瓣,逐层缝合肌肉皮肤,术毕。
术后脱水降颅压、预防感染、防止血管痉挛、预防癫痫等对症治疗。
1.3 随访及生存时间比较
统计获访患者的生存时间,并根据术前是否行颅脑CT 血管显像(CTA)检查对获访的间变星形细胞瘤患者进行分组:CTA 组和对照组,比较两组的生存时间。
1.4 统计学方法
采用SPSS19.0 软件包进行统计,生存率比较采用Kaplan- Meier 法,P <0.05 为差异有统计学意义。
2 结 果
2.1 手术结果

图1 根据术前MRI 对侧裂区胶质瘤的分型Fig 1 Classification of glioma in sylvian fissure according preoperative MRI
术中示肿瘤突出于表面5 例,完全位于皮层下25 例。肿瘤全切除24 例,次全切除3 例,大部切除3 例。术后病理显示,间变星形细胞瘤14例,少突胶质瘤8 例,胶质母细胞瘤8 例。术后对侧肢体肌力较术前好转6 例,较术前肢体肌力下降或失语10例,对症治疗后5 例回复接近正常,余未见明显好转,血管痉挛3 例,对症治疗回复良好,无癫痫发作,术后KPS≥70 分25 例,<70 分5 例。见表3。在术后病理确诊的14 例间变星形细胞瘤中有6 例术前行颅内CTA 检查,显示出肿瘤与MCA 主干及分支关系、肿瘤供应血管、肿瘤引流血管;术后肿瘤血供切断。见图2。
2.2 生存时间分析结果
本组30 例,27 例获得随访,8 例胶质母细胞瘤全部随访,术后均行放化疗,1年生存率13%,2年生存率0%;8 例少突细胞瘤3 例失访,故不对其生存时间及生存率进行分析;14 例间变星形细胞瘤中全部获得随访,患者术后均行放疗,1年生存率85%,2年生存率44%,CTA 组与对照组的中位生存时间分别为54 个月与20 个月,采用Kaplan -Meier法比较两组生存时间,差异有显著性意义(P <0.05),CTA 组生存时间长于对照组。见图3。

表3 肿瘤术中、术后相关资料及患者术后KPS 评分Tab 3 The intraoperative and postoperative findings of tumor and postoperative KPS
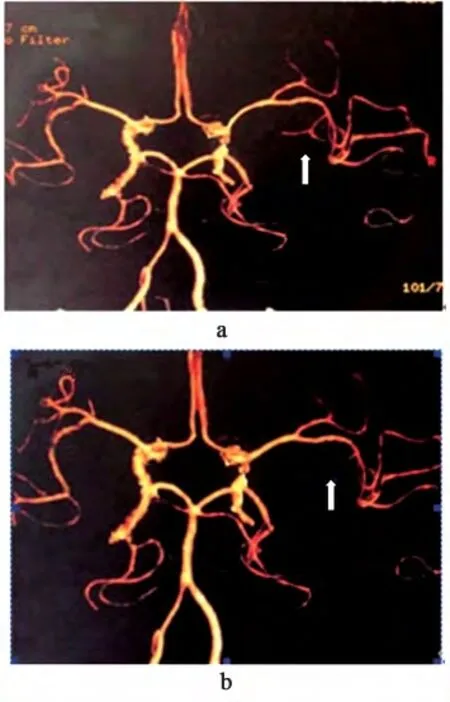
图2 挤推型间变星形细胞瘤Fig 2 Squeezing type:anaplastic astrocytoma

图3 CTA 组与对照组生存率比较Fig 3 Comparison of survival rate between CTA group and control group
3 讨 论
3.1 术前影像学检查
术前患者均行MRI 检查,主刀医师通过术前MRI 分析,对肿瘤进行分型,为选择手术入路及肿瘤切除范围提供依据,利于肿瘤全切,减少术中损伤及术后并发症,利于术后恢复。6 例间变星形细胞瘤患者术前行颅内血管CTA 检查,依据外侧裂深部血管情况、肿瘤与周围主干血管关系可以将外侧裂胶质瘤分为:(1)包裹型:外侧裂区功能性动静脉血管走行于胶质瘤内部,分块切除肿瘤时须重点保护。(2)挤推型(图2):外侧裂动静脉主干血管位于胶质瘤外部,肿瘤占位压迫挤压血管,若肿瘤与血管粘连,可先大部切除肿瘤,血管外壁可残留少量肿瘤组织,待后期处置,若肿瘤与血管未粘连,可完整切除肿瘤。(3)混合型:既有主干血管走行瘤内,又有被肿瘤压迫,术中须酌情处置。本组样本量少,但仍有一定的临床价值,术前CTA 检查让术者充分明确不同患者不同肿瘤周围血管解剖关系,避免操作损伤,利于手术切除,从而做到肿瘤最大程度切除,保护主干血管,减少术后并发症,延长患者术后生存时间。总之,术前全面的影像学检查,为术前讨论及术中操作提供可靠依据,从而提高胶质瘤全切率,减少术后并发症,提高生活质量,延长术后生存时间。
3.2 手术入路要点
(1)皮瓣设计:外侧裂近点是一个容易识别的标志,与脑沟具有固定形态关系[5],根据术前影像学所示病变位置、大小,围绕外侧裂体表投影,设计皮瓣,使肿瘤与外侧裂血管得到充分暴露。本组25例采用改良翼点入路,5 例采用扩大翼点入路,均得到良好暴露。(2)分离外侧裂:从侧裂入路,切除未累计脑皮质的胶质瘤,能够使脑叶皮质功能区保持完整。首先显微镜下锐性分离外侧裂静脉旁蛛网膜,放出脑脊液,充分减压,使额颞叶尽量自然分离,运用Yasagil 等[6]“动力性”牵引以及带明胶海绵的脑棉维持侧裂牵开,切忌粗暴性牵拉损伤,尤其是左侧外侧裂区。当肿瘤较深甚至达岛叶时,需进一步解剖一段较长侧裂,做到“无张力、短时间”牵拉。
3.3 术中操作技巧
(1)手术空间获得:足够的手术空间在一定程度上直接影响侧裂池解剖、降低颅压、减轻功能区组织及血管牵拉,进而影响手术效果:①去除蝶骨嵴:由浅入深,逐渐咬除或磨除达眶后壁,缓解外侧裂张力。②控制性降压:需麻醉师密切配合,本组30 例术中出血(243.33 ±151.85)mL,无一例术中输血;可使术野清晰,利于操作;可降低血管张力,减少术中对功能区组织、血管误伤,缩短手术时间。③甘露醇脱水:本组均在打开硬膜前快速静点20%甘露醇250 mL,防止脑压极高,脑组织膨出。若脱水效果不佳,可开放腰大池,颅压下降明显。(2)肿瘤切除:肿瘤全切是提高病人生存质量和长期存活的最佳选择。肿瘤较大时,可先行中心切除再分块切除,尽可能在瘤腔内操作。在切除肿瘤时可在瘤体中心部分切除,形成瘤腔,增加手术操作的空间又不容易破坏周围组织。部分切除后脑压降低,减少对周围组织的挤压。暴露肿瘤后,取少量送术中病理,不同级别肿瘤有着不同处理方式:低级别胶质瘤质软、血运少,术中出血少,术野清晰,易保护受累的功能血管,肿瘤易被全切;高级别胶质瘤质地较韧,血运丰富,术中出血多,对于这类肿瘤,可以先分离肿瘤与脑组织,电凝切断供血,向肿瘤与脑组织间隙塞入明胶海绵,覆盖脑棉,再精细有目的迅速掏空肿瘤,瘤腔内出血可通过明胶海绵及脑棉压迫止血[6-8],但是,切忌盲目切除瘤周血管,显微镜下仔细辨认功能血管,解剖学完整保留。(3)血管保护:Yasagil 等倡导经自然脑沟裂入路,经过20年的临床实践得到肯定,但外侧裂区解剖结构复杂多变,尤其受肿瘤侵入,更加因人而异,所以手术需术者有着极丰富的解剖知识及娴熟的手术操作技术。静脉引流区综合征可导致失语、偏瘫等。显微镜下首先辨认出MCA 主干,然后采用软膜下分离、电凝并剪断从主干发出的供应肿瘤的小血管[6,10],若术前影像学显示肿瘤为混合型,首先离断供应肿瘤的小血管,然后分块切除肿瘤时“桥状”保留功能血管,用明胶海绵及小脑棉保护之,避免操作损伤。当术中动静脉出血时,不可盲目、广泛电凝止血,首先放大纤维镜倍数,用弱电流双极电凝在微量持续冲水下准确电凝血管破口,保证母血管通畅。但是即使这样,也不可避免有微小肿瘤碎片粘附于血管壁上,术后早期放化疗可避免肿瘤过早复发,延长生存时间。
3.4 并发症与处置
(1)脑水肿:外侧裂入路可减少手术造成脑挫裂伤,本组术后重度脑水肿7 例,考虑与长时间手术操作及血管痉挛有关。术后给予适量甘露醇脱水降颅压。(2)血管痉挛:本组病例术中均给予罂粟碱或尼莫地平灌洗术野,术后给予预防血管痉挛用药,但仍有3 例出现血管痉挛,考虑与术中长时间反复剥离联系紧密的肿瘤与血管有关。(3)癫痫:目前临床预防癫痫发作措施有术前药物控制与预防、术中电位监测、术后常规静点或口服抗癫痫药物,3 个月内无发作者停用药物,其中术前癫痫发作者除外。本组患者术后3 个月内无发生癫痫。
3.5 术中辅助操作技术
随着科学不断深入,多种技术开始应用于临床,提高了肿瘤全切率:(1)术中高分辨率超声:能量多普勒成像(PDU)可以在富血管生成的瘤灶范围内显示丰富低速血流信号,与水肿带的超声影像出现明显差异,可以帮助选择安全入路[11-12]。(2)神经导航:通过术中重新注册和适时更新导航数据,可以有效克服术中脑移位影响,提高全切率,但费用高、不方便,使之未得到临床普及[13]。(3)荧光显色技术:荧光引导下为术者在显微镜提供客观的肿瘤边界,提高肿瘤全切率。(4)术中光动力(PDT)技术[14]:此法可辅助手术治疗胶质瘤,可延长生命、提高生存质量。本组中因本院医疗设施水平有限,均未用到以上辅助技术,未来随着这些技术普遍应用,势必对功能区保护及术后生存质量提高、生存时间的延长起到一定作用。
[1] Fang D,Jiang J,Sun X,et al. Attention dysfunction of postoperative patients with glioma[J]. World J Surg Oncol,2014,12(1):317. doi:10.1186/1477 -7819 -12 -317.
[2] Awad AJ,Burns TC,Zhang Y,et al. Targeting MET for glioma therapy[J]. Neurosurg Focus,2014,37(6):E10.doi:10.3171/2014.9.FOCUS14520.
[3] Riblet NB,Schlosser EM,Homa K,et al. Improving the quality of care for patients diagnosed with glioma during the perioperative period[J]. J Oncol Pract,2014,10(6):365 -370.
[4] 史焕昌,孙鸿,张跃康,等.外侧裂区胶质瘤临床特点及手术方法[J].四川医学,2004,25(8):861 -862.
[5] Zhang Y,Wang H,Qian M,et al. Anatomical study of insula and its relation with the adjacent structure[J]. J Craniofac Surg,2014,25(5):1895 -1897.
[6] Yasagil MG,Krisht AF,Ture U,et al. Microsurgery of Insular Gliomas PartIV Surgial treatment and outcome[J].Contemp Neurosurg,2002,24(1):1 -8.
[7] Theofanis T,Chalouhi N,Dalyai R,et al.Microsurgery for cerebral arteriovenous malformations:postoperative outcomes and predictors of complications in 264 cases[J].Neurosurg Focus,2014,37(3):E10.
[8] Meyer FB,Bates LM,Goerss SJ,et al. Awake craniotomy for aggressive resection of primary gliomas located in eloquent brain[J]. Mayo Clin Proc,2001,76(7):677 -687.
[9] 丁育基. 颅脑重症与手术并发症[M]. 北京:北京出版社,2002:27.
[10] Moiyadi AV,Shetty PM,Mahajan A,et al.Usefulness of three-dimensional navigable intraoperative ultrasound in resection of brain tumors with a special emphasis on malignant gliomas[J]. Acta Neurochir (Wien),2013,155(12):2217 -2225.
[11] Jain RK,Tomaso E,duda DG,et al. Angiogenesis in brain tumors[J]. Natrev Neurosci,2007,8(8):610.
[12] Fornage BD,Edeiken BS,Clayman GL. Use of transoral sonography with an endocavitary transducer in diagnosis,fine-needle aspiration biopsy,and intraoperative localization of retropharyngeal masses[J]. Am J Roentgenol,2014,202(5):W481 -W486.
[13] Li FY,Chen XL,Sai XY,et al.Application of intraoperative magnetic resonance imaging and multimodal navigation in surgical resection of glioblastoma[J]. Chin J Surg,2013,51(6):542 -546.
[14] Akimoto J,Haraoka J,Aizawa K.Preliminary clinical report on safety and efficacy of photodynamic therapy using talaporfin sodium for malignant gliomas[J]. Photodiagnosis Photodyn Ther,2012,9(2):91 -99.
