米黑毛霉产凝乳酶发酵条件研究
2015-03-02关晓艳师希雄文鹏程汪月张忠明张卫兵
文 / 关晓艳,师希雄,文鹏程,汪月,张忠明,张卫兵
(甘肃农业大学食品科学与工程学院 甘肃兰州,730070)
米黑毛霉产凝乳酶发酵条件研究
文 / 关晓艳,师希雄,文鹏程,汪月,张忠明,张卫兵
(甘肃农业大学食品科学与工程学院 甘肃兰州,730070)
为了进一步提高米黑毛霉发酵产凝乳酶的活力,采用单因素和正交试验设计,对影响米黑毛霉产凝乳酶活力的起始pH、温度、接种量及发酵时间等主要因素进行了优化。结果表明: 温度对米黑毛霉产凝乳酶活力影响最大,其次是接种量,发酵时间,起始pH 的影响较小。单因素和正交试验结果确定的最佳发酵条件为: 在250mL三角瓶中装发酵培养基(10g麸皮,10g营养液),温度为32℃,发酵时间为120h,接种量为4mL,起始pH为5,凝乳酶活力可达1682.37SU/mL。
米黑毛霉; 凝乳酶; 发酵条件
凝乳酶是奶酪生产过程中使牛奶凝固的关键性酶[1-3]。传统干酪生产中应用的凝乳酶是来自于小牛第四胃粘膜,但随着世界乳酪产业不断快速发展不断壮大,单纯靠宰杀犊牛来获得凝乳酶不仅成本较高而且不能满足乳制品行业快速发展的要求[3-6]。与传统干酪生产中应用的皱胃酶相比,微生物凝乳酶的生产时间短,产量高,受气候、地域、时间等因素的影响较小,用微生物产凝乳酶可以降低其生产成本[7-9],所以微生物凝乳酶成为凝乳酶研究的热点[10-12]。
本试验以米黑毛霉作为研究对象,研究不同起始pH、温度、接种量和发酵时间等对凝乳酶活力的影响,旨在筛选米黑毛霉产凝乳酶的最佳培养条件,为工业化生产奠定基础。
1、材料与方法
1.1 材料
1.1.1 试验菌种
米黑毛霉菌株HL-1: 甘肃省功能乳品工程实验室保藏。
1.1.2主要培养基
活化培养基:马铃薯(去皮)20%,葡萄糖2%,琼脂2%,pH自然。先将马铃薯去皮、洗净、切成小块,称取200g加入1L蒸馏水,煮沸20min,用纱布过滤,滤液用蒸馏水补至1L,再加入20g琼脂,121℃灭菌20min。
发酵培养基:将麸皮与营养液按1:1(w/v)的比例混合,搅拌均匀,在121℃,0.15MPa下灭菌20min。营养液用葡萄糖2.5%(w/w),乳清粉2.0%(w/w)配制,硝酸铵1.0%(w/w),pH自然。
1.1.3主要仪器
HH-SZ65型数显恒温水浴锅,北京医疗设备厂;YZ-280型手提式不锈钢压力蒸汽灭菌锅,上海三申医疗器械有限公司;HZQ-X100型振荡培养箱,哈尔滨市东联电子技术开发有限公司;SW-CJ-ZFD型双人单面净化工作台,苏州净化设备有限公司;PHS-3C型数显酸度计,上海精密科学仪器有限公司;MICRO17TR冷冻高速离心机。
1.2 方法
1.2.1菌株的活化
将米黑毛霉菌株接种于斜面培养基,30℃培养4~5d,待长满黑色孢子后待用。
1.2.2孢子悬浮液的制备
向生长良好的试管斜面种子中加入10mL的无菌生理盐水,刮下孢子,移入装有玻璃珠三角瓶中振荡,在摇床上振荡打散,再用带脱脂棉的漏斗进行过滤,并调整孢子数为106个/mL。
1.2.3粗酶液的制备
将1mL米黑毛霉种子液接入到发酵培养基,28℃的恒温培养3d。培养完成后,加入100mL的蒸馏水,20℃、180r/min振荡浸提1h,浸提液用四层纱布过滤,滤液于8000r/min离心15min,上清液即为粗酶液[13]。
1.2.4凝乳酶活力的测定
采用Arima法[14]。用0.01mol/L的CaCl2溶液溶配制10%的脱脂奶粉液,在室温下放置40min后使用,取5mL10%的脱脂奶粉液在35°C下保温10min,加入0.5mL在35°C保温的粗酶液,迅速混合均匀,准确记录从加入酶液到乳凝固的时间(s)。在上述条件下,把40min凝固1mL100g/L脱脂乳的酶量定义为一个索氏单位(Soxhlet Unit)。
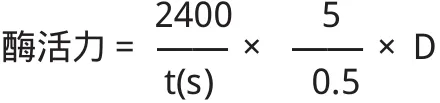
式中,t为凝乳时间,D为稀释倍数。
1.2.5起始pH对发酵产酶的影响
分别选取不同的初始pH值条件:4.5、5.0、5.5、6.0,以1mL的接种量接种至固态发酵培养基,其他条件固定不变,进行发酵培养,28℃培养3d后收集菌体并处理后,测定凝乳酶活力。
1.2.6温度对发酵产酶的影响
分别设定发酵温度为28℃、30℃、32℃、34℃、36℃,以1mL的接种量接种至固态发酵培养基,其他条件固定不变,进行发酵培养,培养3d后收集菌体并处理后,测定凝乳酶活力。
1.2.7接种量对发酵产酶的影响
以接种量分别为1mL、2mL、3mL、4mL、5mL、6mL、7mL、8mL接种至固态发酵培养基,其他条件固定不变,28℃进行发酵培养,培养3d后收集菌体并处理后,测定凝乳酶活力。
1.2.8发酵时间对产酶的影响
分别设定发酵时间为84h、96h、108h、120h、132h,以1mL的接种量接种至固态发酵培养基,其他条件固定不变,28℃进行发酵培养,收集菌体并处理后,测定凝乳酶的活力。
1.2.9正交试验
在单因素试验的基础上,选择起始pH、温度、接种量和发酵时间进行四因素三水平正交试验。
2、结果与分析
2.1起始pH对发酵产酶的影响

图1 起始pH对发酵产酶的影响Fig.1 The effect of initial pH on the MCA
初始pH会对微生物的生长产生影响从而影响发酵产物中目标酶的生成和累积[15]。由图1可见,低酸性的培养环境更加有利于米黑毛霉的生长和代谢产酶,但是pH过高或过低都会降低发酵产物中凝乳酶的产生和累积。当起始pH为4.5~5.5时,凝乳酶活力随pH升高而明显升高,当起始pH达到5.5时酶活力达最大值566.93 SU/mL,起始pH为5.5以上时,凝乳酶活力随起始pH的升高有明显下降。
2.2温度对发酵产酶的影响
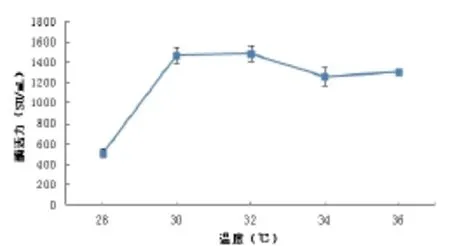
图2 温度对发酵产酶的影响Fig.2 The effect of temperature on the MCA
温度是微生物生长的重要环境条件之一,在发酵过程中,选择最适发酵温度并不单单是选择微生物生长传代速度最快的温度,而是积累所需发酵代谢产物的最佳温度[15]。由图2可见,当发酵温度在28~30℃内,凝乳酶的活力随发酵温度的升高迅速增长;当发酵温度为30℃时,酶活力达到最大值1500.27SU/mL,温度逐渐升高后,酶活力逐渐降低,随温度的升高,降低速率逐渐变慢。
2.3接种量对发酵产酶的影响

图3 接种量对发酵产酶的影响Fig.3 The effect of inoculums size on the MCA
接种量直接关系到各时间段单位体积培养基中微生物数量的多少,接种量过小则发酵时间延长,接种量过大则导致培养基营养供给影响产酶[15]。由图3可见,接种量过低将延长菌体的延滞期,导致菌体的生长减慢,发酵时间延长,当在发酵培养基(10g麸皮,10g营养液)内接种量为1~6mL内,凝乳酶的活力随接种量的增大逐渐增大,增大速率由慢变快,当接种量达到6mL时,酶活力达到最大值1437.16SU/mL,当接种量大于6mL时,酶活力逐渐降低,但随接种量的升高,降低速率逐渐变慢,分析原因是此时培养基的营养已经不能满足微生物的生长需求,微生物之间开始竞争营养物质,影响发酵产酶,当竞争越厉害,产酶量越少酶活越低。
2.4发酵时间对发酵产酶的影响
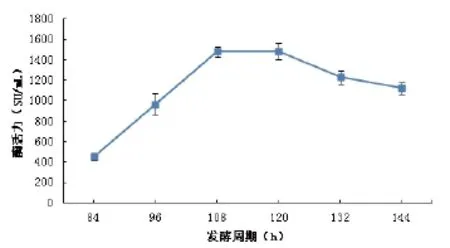
图4 发酵时间对产酶的影响Fig.4 The effect of fermentation time on the MCA
在不同的生长阶段,微生物对营养物质的需求以及进行次级代谢的途径都会有所不同[15]。由图4可见,在发酵前期(108h以前)随着发酵时间的延长,产物中凝乳酶的活性明显呈上升趋势,在发酵后期(120h以后)随着发酵时间的延长,产物中凝乳酶的活性反而开始下降,分析的原因是培养基中营养成分已经不足以满足生长需要,生长进入衰亡期。当发酵时间在84~120h内,凝乳酶的活力随发酵时间的延长迅速增长,但增加速率逐渐变慢;当发酵进行到108~120h时,凝乳酶活力达到较大值,120h酶活力达到1555.66SU/mL,120h后,酶活力逐渐降低。
2.5正交试验
在单因素试验的基础上,通过四因素三水平正交试验考察起始pH、温度、接种量及发酵时间对产酶量的综合影响。正交试验因素水平表见表1,正交试验结果分见表2。
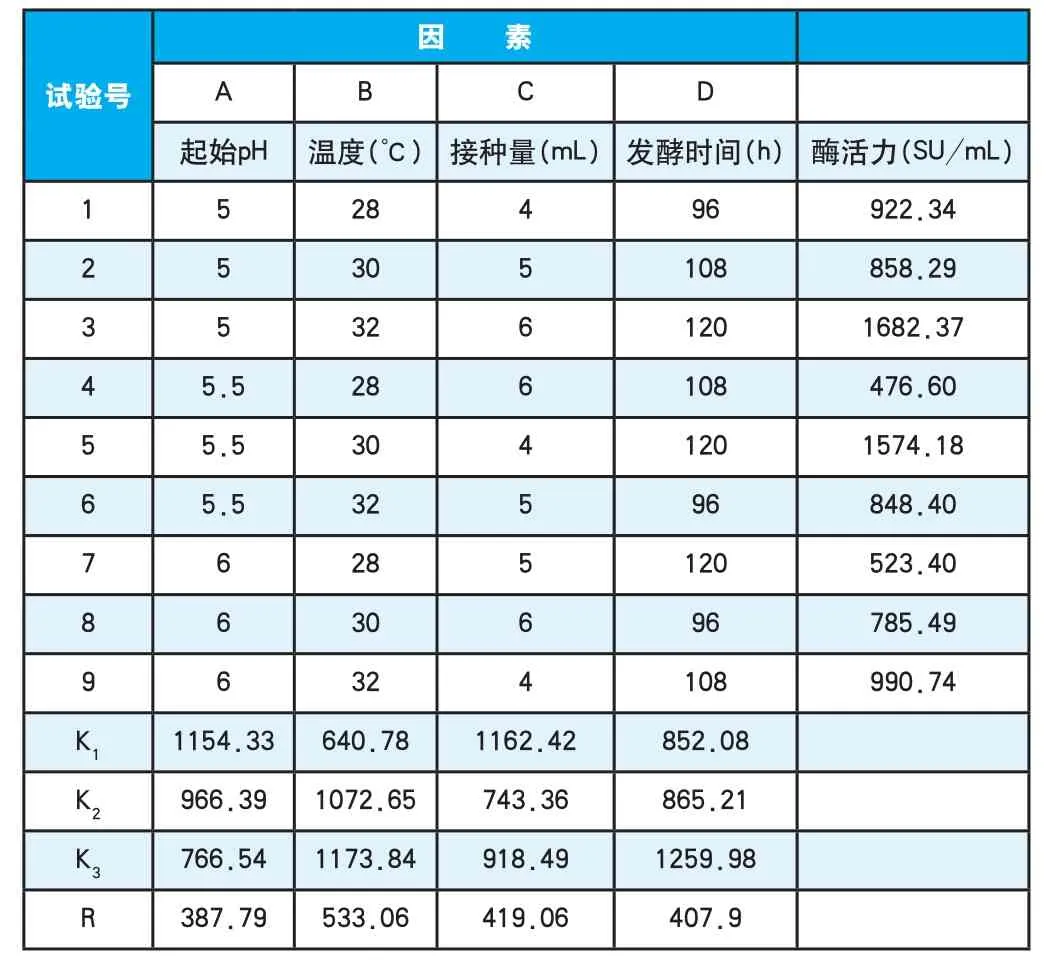
表2 正交试验结果Table 2 The result analyses of orthogonal experiment
对表2的试验结果进行极差分析,结果表明四个因素对凝乳酶活力的影响为温度>接种量>发酵时间>起始pH。在试验因子水平范围内,产酶量最高的组合是A1B3C1D3,即起始pH为5,温度为32℃,接种量为4mL,发酵时间为120h。
为检验正交试验结果的可靠性,将产酶量最高的组合A1B3C1D3进行3次平行试验,测得的平均酶活为1693.52SU/mL,验证试验的酶活与正交试验中的最优组合A1B3C1D3对应的酶活(1682.37SU/mL)相对误差为0.7%,说明试验的结果是可靠的。
4、结论
通过单因素试验,初步确定了有利于米黑毛霉产凝乳酶的起始pH、温度、接种量和发酵时间的最优值及最优范围。在单因素试验的基础上,采用正交试验对发酵条件进一步优化,通过正交试验可以看出,4个因子对产酶的影响作用由大到小依次为温度、接种量、发酵时间、起始pH。最终确定的最佳培养条件为:温度为32℃,接种量为4mL,发酵时间为120h,起始pH为5。
[1]李建涛,陈历俊,姜铁民.解淀粉芽孢杆菌产凝乳酶发酵条件的优化[J].中国食品添加剂,2012(1): 55-60.
[2]El-Bendary M A, Maysa E M,Thanaa H A. Purification and characterization of milk clotting enzyme produced by Bacillus sphaericus[J].Journal of Applied Sciences Research, 2007,3(8): 695-699.
[3] S.Seker,H.Beyenal ,A.TanyolaC .Modeling milk clotting activity in the continuous production of microbial rennet from Mucor miehei[J].Journal of Food Science,1999,64(3):525-529.
[4]孙海蛟,吕敏,黄艾祥.我国干酪凝乳酶研究及应用现状[J].乳品加工,2008,5:50-53.
[5]张超垒,张志国,张玲梅,等.微生物发酵凝乳酶的探讨[J].试验研究,2011,(1):73-74.
[6]高维东,甘伯中,纪银莉,等.微生物凝乳酶的研究进展[J].中国乳品工业.2009,5:34-36.
[7]朱仁俊,石振兴,甘伯中,等.凝乳酶的研究进展[J],中国乳业工业,2009,38 (1):34-42
[8]刘彤,崔艳华,张兰威,等.凝乳酶的研究进展[J],中国乳业工业,2011,38 (1):40-43
[9]刘显庭,张昊,郭慧媛,等.凝乳酶在干酪生中的应用[J].中国乳业,2013(133):54-57.
[10]孙健,宋晓红.总状毛霉凝乳酶的研制及初步应用[J].微生物学通报,1994,21(1):5-10.
[11]矫庆华,钱世钧.微小毛霉凝乳酶的生物合成和性质的研究[J].微生物学报,1992,32 (1): 30-35.
[12]吴进菊,徐尔尼,张凤英,等.中国曲中凝乳酶高产菌株的筛选及产酶条件的研究[J].中国食品学报, 2009, 9(1):124-129.
[13]李学朋,梁琪,张卫兵等,米黑毛霉产凝乳酶固体发酵培养基优化[J].食品工业科技,2012,23:192-197.
[14]Arima K, Iwasake K. Milk-clotting enzyme from microorganisms. Part I Screening test and the identification of the potent fungus[J]. Agricultural Biological Chemistry,1967,31(5):540-545.
[15]廖亮.凝乳酶高产菌株的诱变选育及其发酵条件、产物酶学活性的相关研究[D].北京:北京化工大学,2010:50-57.
甘肃省农业生物技术专项(GNCX-2014-31);甘肃农业大学SRTP项目(20141031)
