苦参碱体外对人髓母细胞瘤D341细胞增殖、凋亡和自噬的作用
2015-03-02周开宇吉海龙毛天明白志强
周开宇, 吉海龙, 毛天明, 白志强
(1. 台州学院医学院附属台州市立医院神经外科, 复旦大学附属华山医院台州分院, 浙江 台州 318000;2. 温州医科大学附属第一临床学院, 浙江 温州 325000)
苦参碱体外对人髓母细胞瘤D341细胞增殖、凋亡和自噬的作用
周开宇1,2, 吉海龙2, 毛天明1, 白志强1
(1. 台州学院医学院附属台州市立医院神经外科, 复旦大学附属华山医院台州分院, 浙江 台州 318000;2. 温州医科大学附属第一临床学院, 浙江 温州 325000)
目的 探讨苦参碱在体外诱导人髓母细胞瘤D341细胞增殖、凋亡和自噬的作用。方法 体外培养细胞,随机分为对照组、苦参碱0.5, 1.0, 1.5和2.0 g·L-1组,作用时间为24,48和72 h。CCK-8法检测细胞增殖,流式细胞仪检测细胞凋亡,透射电镜观察细胞结构,Western蛋白质印迹法检测细胞Bax、Bcl-2、胱天蛋白酶3及自噬相关蛋白微管相关蛋白1轻链3(LC3)和Bcl-2同源结构域蛋白抗体beclin1蛋白表达。随后在苦参碱作用前1 h加入终浓度为5 mmol·L-1的自噬抑制剂3-甲基腺嘌呤(3-MA),观察细胞beclin1和LC3蛋白表达的变化。结果 苦参碱0.5~2.0 g·L-1能明显抑制D341细胞增殖,具有浓度效应关系(r24 h=0.994,r48 h=0.992,r72 h=0.996,P<0.01),而且可诱导D341细胞凋亡(r24 h=0.937,r48 h=0.947,r72 h=0.987,P<0.01);苦参碱浓度为2.0 g·L-1时,对D341细胞增殖的抑制作用(r=0.999,P<0.01)和凋亡的诱导作用(r=0.990,P<0.01)具有时间效应关系。透射电镜观察发现,苦参碱2.0 g·L-1作用24 h,D341细胞出现气穴样的空泡结构,细胞染色质浓缩、边缘化;作用48 h,细胞核染色质浓缩明显,细胞胞浆中可见空泡;作用72 h,细胞核固缩明显,部分细胞可见核裂解,空泡明显增大。Western蛋白质印迹法实验结果表明,苦参碱0.5~2.0 g·L-1增强D341细胞Bax蛋白表达(r24 h=0.981,r48 h=0.967,r72 h=0.998,P<0.01),抑制Bcl-2蛋白表达(r24 h=-0.977,r48 h=-0.989,r72 h=-0.968,P<0.01)。苦参碱作用48 h可增强D341细胞胱天蛋白酶3的表达(r48 h=0.995,P<0.01),作用24, 48和72 h能增强D341细胞beclin1蛋白的表达,具有浓度效应关系(r24 h=0.989,r48 h= 0.986,r72 h=0.966,P<0.01),自噬抑制剂3-MA可抑制此作用(P<0.05)。苦参碱能使D341细胞LC3-Ⅰ蛋白表达减少,LC3-Ⅱ表达增加, LC3-Ⅰ/LC3-Ⅱ比值降低(r24 h=-0.795,r48 h=-0.886,r72 h=-0.901,P<0.05);自噬抑制剂3-MA可抑制苦参碱对LC3-Ⅰ和LC3-Ⅱ蛋白表达的影响 (P<0.05)。 结论 苦参碱体外具有抑制D341细胞增殖、诱导凋亡和促进自噬的作用。
苦参碱; 细胞增殖; 细胞凋亡; 自噬
苦参碱(matrine)是豆科槐属植物中生物碱的主要成分,属于四环的喹嗪啶类,具有利尿解毒、退黄降酶和清热利湿等药理活性,且无明显的毒性作用[1-2]。近年来研究发现,苦参碱能明显地诱导胃癌细胞凋亡,抑制细胞增殖[3]。髓母细胞瘤是来源于原始神经胚胎残余上皮细胞,好发于儿童,恶性程度极高,术后较易复发,对常规的放、化疗不敏感,预后差,严重威胁到儿童的健康[4]。苦参碱对人髓母细胞瘤细胞增殖和凋亡的作用尚少有报道。本研究观察苦参碱对人髓母细胞瘤D341细胞增殖、凋亡和自噬的影响,并观察凋亡相关蛋白和自噬相关蛋白表达的变化,为探索苦参碱对人髓母细胞瘤的作用机制提供线索。
1 材料与方法
1.1 细胞、试剂和仪器D341细胞由北京协和医院细胞库提供。苦参碱由宁波天衡制药有限公司提供,纯度为98%。RPMI 1640培养基和胎牛血清购自美国Gibco公司;AnnexinⅤ-FITC细胞凋亡检测试剂盒由上海蓝基生物科技有限公司提供;CCK-8试剂盒购自日本同仁化学研究所;鼠抗人Bax抗体和Bcl-2抗体购自美国Cell Signaling Technology公司;微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3, LC3)-Ⅰ和Ⅱ和beclin1兔多克隆抗体、辣根过氧化酶标记羊抗兔IgG抗体购自美国Santa Cruz公司;化学发光试剂盒和Western蛋白质印迹试剂盒购自北京Qiangen公司;DBA显色试剂盒购自中杉金桥公司;3-甲基腺嘌呤(3-methyladenine, 3-MA)购自北京乐博生物科技有限公司;其他试剂均由上海蓝基生物科技有限公司提供。细胞培养板,美国Corning公司;透射电子显微镜,日本JEM-1011公司;酶标仪型号:美国BioTekEL-x800;超速离心机,德国Sorvall, D-37520公司;流式细胞仪,美国FACS Calibur Becton-Dickinson公司;Western电泳仪,美国Bio-Rad 164-5051公司;分光光度计,日本 SHIMAZDU UV-2540公司。
1.2 细胞培养将D341细胞置于10%胎牛血清培养液和含1%青霉素-链霉素的RPMI 1640中,并于37℃,5%CO2和饱和湿度的恒温培养箱中培养。
1.3 CCK-8法检测细胞增殖将培养的D341细胞调整为5×107 L-1细胞悬液,取96孔细胞培养板,每孔加入100 μL细胞悬液,再培养24 h;每孔加入200 μL含苦参碱培养基,苦参碱终浓度分别为0.5,1.0,1.5和2.0 g·L-1,同时设立细胞对照组;分别培养24, 48和72 h后每孔加入10 μL CCK-8,培养3 h,混匀10 min,以酶标仪测定各孔的吸光度值(A450 nm)。每浓度设3复孔,计算细胞增殖抑制率。细胞增殖抑制率(%) =(细胞对照组A450 nm-给药组A450 nm) /细胞对照组A450 nm×100%。
1.5 透射电镜观察细胞超微结构体外培养的D341细胞随机分为对照组和苦参碱2.0 g·L-1组,培养24, 48和72 h后,8000×g离心5 min,收集细胞,洗涤,固定,再脱水,包埋,常规超薄切片,透射电镜下观察细胞超微结构。
1.6 Western蛋白质印迹法检测细胞Bax、Bcl-2、胱天蛋白酶3、beclin1和LC3蛋白表达D341瘤细胞接种于24孔板中,每孔200 μL,细胞密度为5×107 L-1,待细胞贴壁生长后再分组。苦参碱组加入苦参碱0.5, 1.0, 1.5和2.0 g·L-1;3-MA预处理组在加苦参碱作用前1 h加入3-MA,3-MA终浓度为5 mmol·L-1;同时设3-MA对照组,只加3-MA,终浓度5 mmol·L-1;对照组只加细胞培养液。各组分别培养24, 48和72 h,收集细胞。加入100 μL细胞裂解液混匀后,放冰上孵育30 min,12 000×g,4℃离心15 min,留上清液,以BCA法测定蛋白质浓度。常规制胶、上样、电泳、转膜、封闭。分别加一抗即抗Bax (1∶5000)、Bcl-2(1∶1000)、胱天蛋白酶3 (1∶1000)、LC3-Ⅰ(1∶200)、LC3-Ⅱ(1∶150)、beclin1和β肌动蛋白(鼠抗1∶1000)抗体,4℃孵育过夜。TBST洗膜,将膜与二抗辣根过氧化酶标记羊抗兔IgG抗体(1∶5000) 室温下摇荡孵育2 h,再TBST充分洗膜。显色、曝光、显影、定影,扫描各条带积分吸光度(integrated absorbance, IA),以β肌动蛋白作内参照,待测蛋白的相对表达水平用IA目标蛋白/IAβ肌动蛋白表示。

2 结果
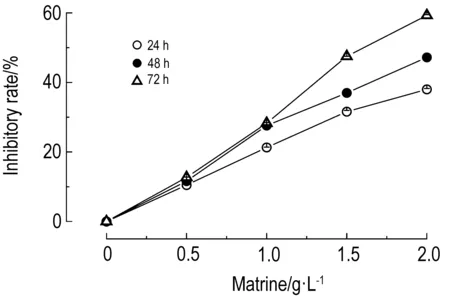
2.1 苦参碱对D341细胞增殖的抑制作用图1结果显示,苦参碱作用24, 48和72 h,苦参碱对D341细胞增殖的抑制作用呈浓度依赖性(r24 h=0.994,r48 h=0.992,r72 h=0.996,P<0.01)。苦参碱浓度为2.0 g·L-1时,对D341细胞增殖的抑制作用具有时间依赖性(r=0.999,P<0.01)。
2.2 苦参碱对D341细胞凋亡的诱导作用图2和图3结果显示,苦参碱能明显诱导D341细胞凋亡,细胞凋亡率与苦参碱浓度呈正相关(r24 h=0.937,r48 h=0.947,r72 h=0.987,P<0.01);在苦参碱浓度为2.0 g·L-1时,诱导D341细胞凋亡的作用随作用时间延长而增加(r=0.99,P<0.01)。
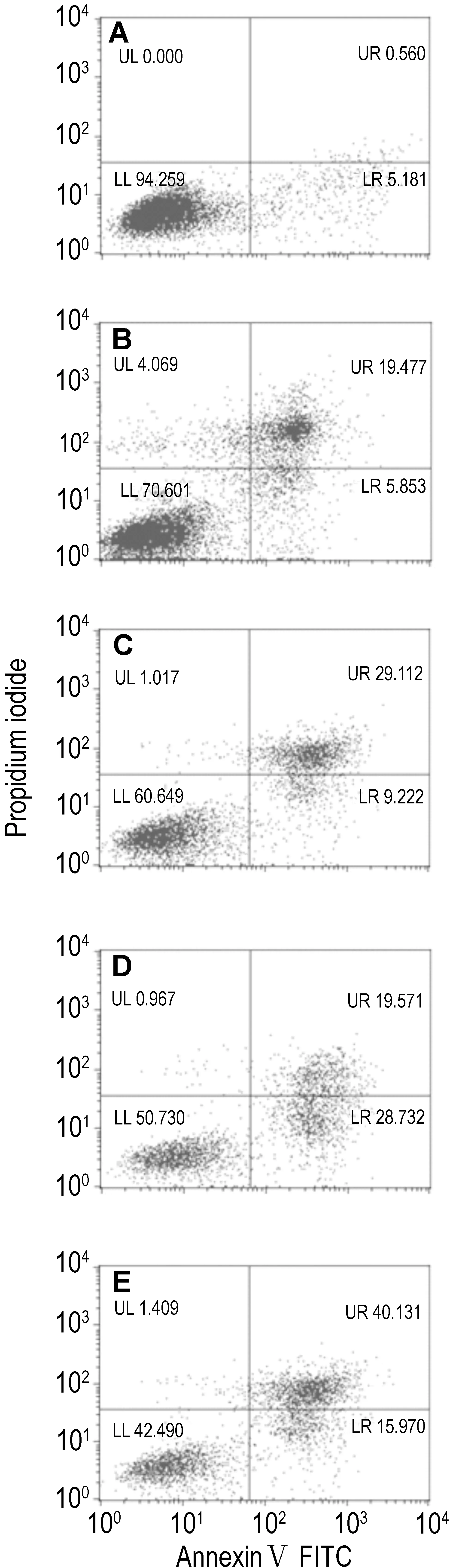
Fig.2 Effect of matrine for 72 h on D341 cell apoptosis by flow cytometry. A, B, C, D and E: matrine 0, 0.5, 1.0, 1.5 and 2.0 g·L-1group, respectively.
2.3 苦参碱对D341细胞超微结构的影响透射电镜观察D341细胞超微结构(图4)发现,对照组细胞膜完整,染色质分布均匀(图4A)。苦参碱作用 24 h,细胞体积变小,出现气穴样的空泡结构,细胞染色质浓缩、边缘化(图4B)。作用48 h,细胞核染色质浓缩明显,部分呈新月状附在核膜周围,细胞胞浆中可见空泡(图4C)。作用 72 h后,细胞核固缩明显,部分细胞可见核裂解,空泡明显增大(图4D)。
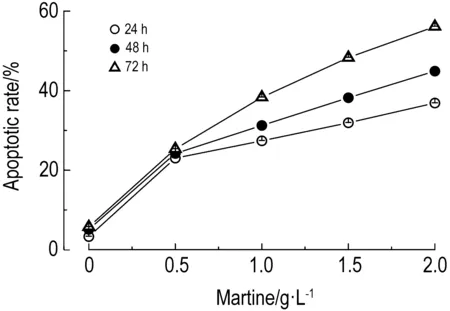

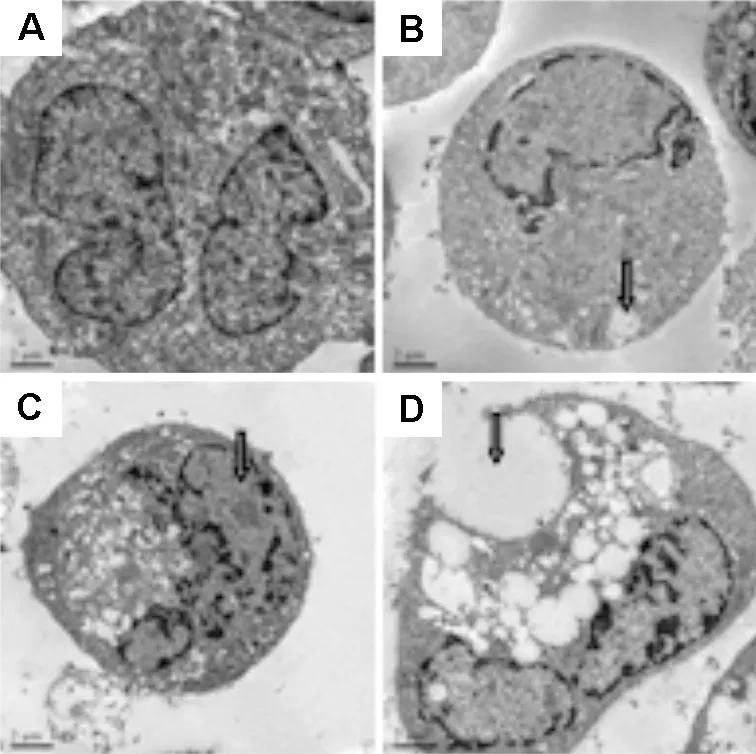
Fig.4 Effect of matrine 2.0 g·L-1on D341 cell ultrastructure observation with transmission electron microscope (×50 000). A: normal control; B: 24 h, the arrow shows the early apoptotic cells with acoustic cavitation bubble structure, chromatin condensation, and marginalization; C: 48 h, the arrow shows nuclear chromatin condensation, more vacuoles in the cytoplasm; D: 72 h, the arrow shows the significantly increased and larger cytoplasmic vacuoles.
2.4 苦参碱对D341细胞Bax、Bcl-2和胱天蛋白酶3蛋白表达水平的变化由图5可以看出,随着苦参碱浓度的增加,D341细胞Bax的表达逐渐增强(r24 h=0.981,r48 h=0.967,r72 h=0.998,P<0.01),Bcl-2的表达逐渐下降(r24 h=-0.977,r48 h=-0.989,r72 h=-0.968,P<0.01)。由图6所示,苦参碱与D341细胞作用48 h,随着苦参碱浓度的增加,D341细胞胱天蛋白酶3的表达逐渐增强(r48 h=0.995,P<0.01)。
2018年10月,在广东省航道事务中心的领导和部署下,韶关、北江航道事务中心开始为北江船闸统一运营管理做好准备工作。广东省航道事务中心联合北江、韶关航道事务中心赴广西西江长洲枢纽开展北江船闸统一管理调研工作。2018年11月,广东省省航道事务中心在广州市召开北江船闸统一运营管理工作专题会议,研究部署北江船闸统一运营管理有关工作。
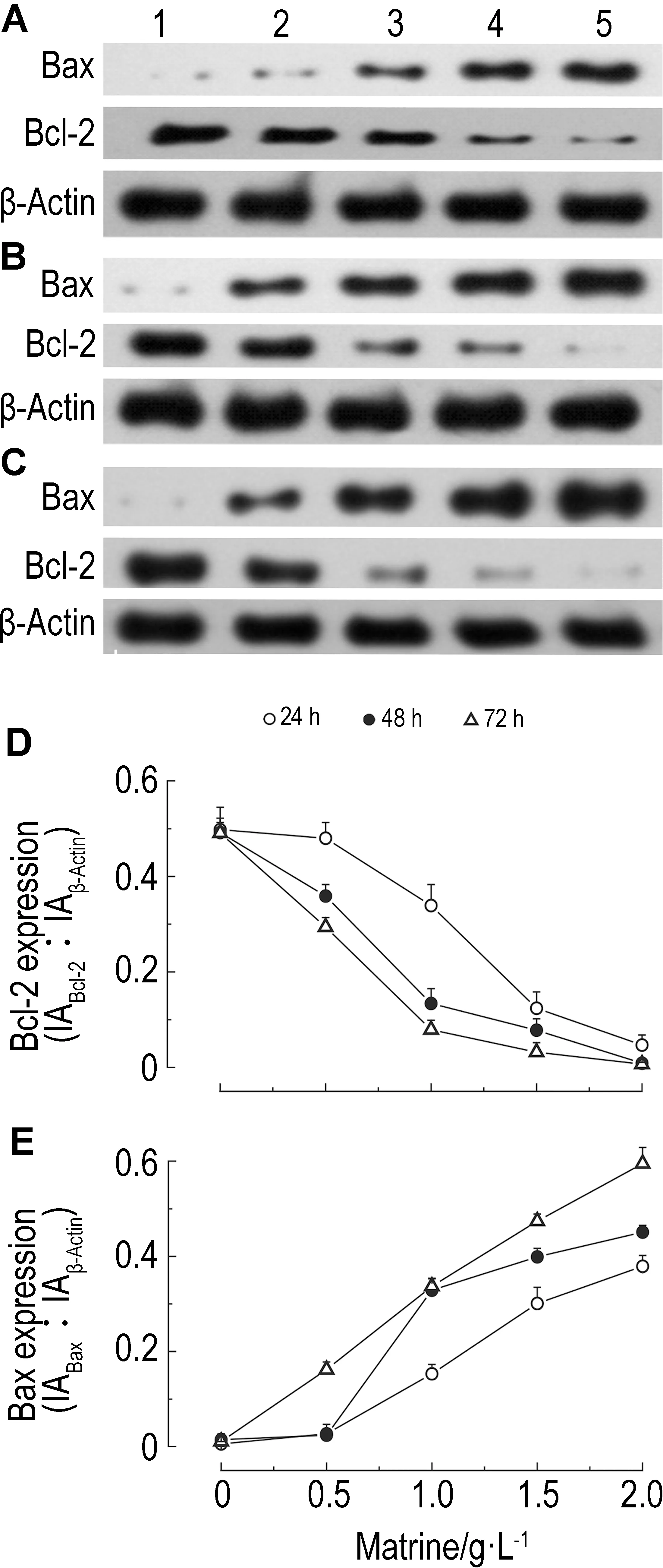



2.5 苦参碱对D341细胞beclin1蛋白表达的影响如图7所示,苦参碱与D341细胞作用24, 48和72 h,随着苦参碱浓度的增加,D341细胞beclin1蛋白的表达增加(r24 h=0.989,r48 h=0.986,r72 h=0.966,


P<0.01)。在苦参碱作用之前加入自噬抑制剂3-MA,可抑制苦参碱导致的beclin1蛋白表达的增加(P<0.05)。


Fig.8 Effect of matrine for 24(A), 48(B) and 72 h(C) on microtubule associated protein 1 light chain-Ⅰ(LC3-Ⅰ) and LC3-Ⅱexpression of D341 cells observed by Western blotting. Lane 1, 2, 3, 4 and 5: matrine 0, 0.5, 1.0, 1.5 and 2.0 g·L-1, respectively; lane 6, 7, 8, 9 and 10: 3-MA+matrine 0, 0.5, 1.0, 1.5 and 2.0 g·L-1, respectively; A2, B2 and C2: the semi-quantitative results of A1, B1 and C1, respectively.
3 讨论
苦参碱具有抗肿瘤作用。Zhang等[5]对前列腺癌进行研究,发现苦参碱能明显抑制前列腺癌细胞增殖,诱导细胞凋亡,增强胱天蛋白酶3和Bax蛋白的表达,降低Bcl-2蛋白的表达。本研究用人髓母细胞瘤D341细胞研究发现,苦参碱对D341细胞增殖亦具有抑制作用,能明显诱导D341细胞凋亡,Bax和胱天蛋白酶3蛋白表达增强,Bcl-2表达降低,与上述研究结果一致。Bcl-2蛋白家族在诱导凋亡的线粒体信号转导途径中起着重要的作用,在肿瘤细胞中高表达[6]。细胞在凋亡过程中主要表现为Bcl-2蛋白表达减少,Bax蛋白表达增加,Bcl-2抑制细胞凋亡的机制可能是拮抗凋亡促进基因Bax表达[7]。因此提示,苦参碱可能是通过激活胱天蛋白酶3的表达、调控Bcl-2和Bax的表达而诱导D341细胞凋亡,抑制D341细胞增殖。另外,本研究还观察了苦参碱对D341细胞自噬的影响。细胞自噬与细胞凋亡和细胞衰老一样,是十分重要的生物学现象,参与生物的发育和生长等多种过程,细胞自噬的异常导致癌细胞的出现。Beclin1是自噬通路上第1个被确认的肿瘤抑制因子,在多种恶性肿瘤中均存在着表达减少的现象,其杂合子的缺失也被认为是细胞发生恶性转化的原因之一[8-10]。LC3是哺乳动物细胞中酵母自噬相关基因agt的同源物[11-12],参与自噬体的形成,有Ⅰ型和Ⅱ型。未发生自噬时,细胞内合成的 LC3 经过加工,成为胞浆可溶性的LC3-Ⅰ型。当自噬发生时,LC3-Ⅰ型经泛素样加工修饰,与自噬膜表面的磷脂酰乙醇胺结合,形成LC3-Ⅱ型。LC3-Ⅱ含量与自噬泡数量成正比。因此,LC3的表达强度与自噬活性密切相关[13]。Deng等[14]曾对肾透明细胞癌进行研究,发现癌细胞已发生转移者,自噬活性明显低于病灶尚呈局灶者;LC3-Ⅱ表达越低,其预后越差。Yu等[15]认为,beclin1蛋白表达可作为胃癌独立的预后监测因素,beclin1表达阴性的胃癌患者,往往有远处转移,预后很差。本研究结果表明,苦参碱能使D341细胞beclin1和LC3-Ⅱ蛋白表达增加,LC3-Ⅰ蛋白表达减少,LC3-Ⅰ/LC3-Ⅱ比值降低,且具有浓度效应关系。自噬抑制剂3-MA可逆转苦参碱对上述蛋白表达的影响。由此表明,苦参碱在抑制D341细胞增殖、诱导D341细胞凋亡的同时,还可以诱导D341细胞自噬。苦参碱诱导D341细胞自噬的作用机制尚待深入研究。本研究为将苦参碱用于治疗人髓母细胞瘤提供了参考。
[1] Yang ZY, Wang L, Hou YX, Wang XB. Effects of matrine on oval cell mediated liver regeneration and expression of RBP-Jκ and HES1[J].MolMedRep, 2013, 7(5):1533-1538.
[2] Zhang F, Wang X, Tong L, Qiao H, Li X, You L,etal. Matrine attenuates endotoxin-induced acute liver injury after hepatic ischemia/reperfusion in rats[J].SurgToday, 2011, 41(8):1075-1084.
[3] Luo C, Zhong HJ, Zhu LM, Wu XG, Ying JE, Wang XH,etal. Inhibition of matrine against gastric cancer cell line MNK45 growth and its anti-tumor mechanism[J].MolBiolRep, 2012, 39(5):5459-5464.
[4] Gajjar A, Stewart CF, Ellison DW, Kaste S, Kun LE, Packer RJ,etal. PhaseⅠ study of vismodegib in children with recurrent or refractory medulloblastoma: a pediatric brain tumor consortium study[J].ClinCancerRes, 2013, 19(22):6305-6312.
[5] Zhang P, Wang Z, Chong T, Ji Z. Matrine inhibits proliferation and induces apoptosis of the androgen-independent prostate cancer cell line PC-3[J].MolMedRep, 2012, 5(3):783-787.
[6] Czabotar PE, Lessene G, Strasser A, Adams JM. Control of apoptosis by the Bcl-2 protein family: implications for physiology and therapy[J].NatRevMolCellBiol, 2014, 15(1):49-63.
[7] Nagahara Y, Morita M, Nakata T, Iba A, Shinomiya T. Loss of Bcl-2 expression correlates with increasing sensitivity to apoptosis in differentiating ES cells[J].CellBiolInt, 2014, 38(3):381-387.
[8] Za Y, Cun YL, Huang YC. Matrine promotes cell apoptosis in human hepatocellular carcinoma cell line SMMC-7721[J].WorldChinJDigestol(世界华人消化杂志), 2010, 18(29):3078-3083.
[9] Shin JY, Hong SH, Kang B, Minai-Tehrani A, Cho MH. Overexpression of beclin1 induced autophagy and apoptosis in lungs of K-rasLA1 mice[J].LungCancer, 2013, 81(3):362-370.
[10] Wirawan E, Lippens S, Vanden Berghe T, Romagnoli A, Fimia GM, Piacentini M,etal. Beclin1: a role in membrane dynamics and beyond[J].Autophagy, 2012, 8(1):6-17.
[11] Beale R, Wise H, Stuart A, Ravenhill BJ, Digard P, Randow F. A LC3-interacting motif in the influenza A virus M2 protein is required to subvert autophagy and maintain virion stability[J].CellHostMicrobe, 2014, 15(2):239-247.
[12] Reggiori F, de Haan CA, Molinari M. Unconventional use of LC3 by coronaviruses through the alleged subversion of the ERAD tuning pathway[J].Viruses, 2011, 3(9):1610-1623.
[13] Giménez-Xavier P, Francisco R, Platini F, Pérez R, Ambrosio S. LC3-Ⅰ conversion to LC3-Ⅱ does not necessarily result in complete autophagy[J].IntJMolMed, 2008, 22(6):781-785.
[14] Deng Q, Wang Z, Wang L, Zhang L, Xiang X, Wang Z,etal. Lower mRNA and protein expression levels of LC3 and Beclin1, markers of autophagy, were correlated with progression of renal clear cell carcinoma[J].JpnJClinOncol, 2013, 43(12):1261-1268.
[15] Yu M, Gou WF, Zhao S, Xiao LJ, Mao XY, Xing YN,etal. Beclin 1 expression is an independent prognostic factor for gastric carcinomas[J].TumourBiol, 2013, 34(2):1071-1083.
(本文编辑: 齐春会)
Effect of matrine on cell proliferation, apoptosis and autophagyof human medulloblastoma D341 cells in vitro
ZHOU Kai-yu1,2, JI Hai-long2, MAO Tian-ming1, BAI Zhi-qiang1
(1.DepartmentofNeurosurgery,TaizhouMunicipalHospitalAffiliatedtoTaizhouMedicalCollege,TaizhouBranchHospitalofHuashanHospitalAffiliatedtoFudanUniversity,Taizhou318000,China; 2.TheFirstClinicalCollegeAffiliatedtoWenzhouMedicalUniversity,Wenzhou325000,China)
OBJECTIVE To explore the effect of matrine induced proliferation, apoptosis and autophagy on human medulloblastoma cell line D341invitro. METHODS D341 cellsinvitrowere incubated with matrine 0, 0.5, 1.0, 1.5 and 2.0 g·L-1for 24, 48 and 72 h, respectively. The proliferation of D341 cells was analyzed using Cell Counting Kit-8 assay. Apoptosis was detected by flow cytometry. The morphologic change of cells was observed under a transmission electron microscope. The expression of Bax, Bcl-2, caspase 3, microtubule associated protein 1 light chain 3 (LC3) and beclin1 was detected by Western blotting, and the expression of LC3 and beclin1 was detected by Western blotting with or without the autophagy inhibitor 3-methyladenine(3-MA). 3-MA was added 1 h before matrine and the final concentration of 3-MA was 5 mmol·L-1. RESULTS Matrine significantly inhibited the proliferation of D341 cells. There was a concentration-effect relationship (r24 h=0.994,r48 h=0.992,r72 h=0.996,P<0.01). Matrine could induce the cell apoptosis (r24 h=0.937,r48 h=0.947,r72 h=0.987,P<0.01). When the concentration of matrine was 2.0 g·L-1, the inhibitory effect on D341 cell proliferation (r=0.999,P<0.01) and the induction of cell apoptosis (r=0.990,P<0.01) had a time-dependence. When the concentration of matrine was 2.0 g·L-1, the ultrastructure of the D341 cells had obvious change. Cells with acoustic cavitation bubble structure, chromatin condensation, and marginalization were observed after matrine treatment for 24 h. After 48 h treatment with matrine, nuclear chromatin condensation and more vacuoles in the cytoplasm were observed. After 72 h treatment with matrine, cells exhibited apoptotic characteristics with obvious nuclear chromatin condensation, and nuclear fragmentation, significantly increased the larger cytoplasmic vacuoles. Western blotting analysis showed that matrine could increase the expression of Bax (r24 h=0.981,r48 h=0.967,r72 h=0.998,P<0.01), and decrease the expression of Bcl-2 (r24 h=-0.977,r48 h=-0.989,r72 h=-0.968,P<0.01). Matrine could increase the expression of caspase 3 when the effect time was 48 h (r48 h=0.995,P<0.01). Matrine also increased the expression of beclin1 (r24 h=0.989,r48 h=0.986,r72 h=0.966,P<0.01). The autophagy inhibitor 3-MA could reduce this effect (P<0.05). Matrine decreased the expression of LC3-Ⅰ but increased the expression of LC3-Ⅱ and thus the ratio of LC3-Ⅰ/LC-Ⅱ was decreased (r24 h=-0.795,r48 h=-0.886,r72 h=-0.901,P<0.05). 3-MA could reduce the effects of matrine on LC3-Ⅰ and LC3-Ⅱ expression of D341 cells (P<0.05). CONCLUSION Matrine can inhibit proliferation, induce apoptosis and promote autophagy of D341 cellsinvitro.
matrine; cell proliferation; apoptosis; autophagy
ZHOU Kai-yu, E-mail: kerry2000year@163.com
浙江省中医药管理局科技计划资助项目(2013ZA133)
周开宇(1972-),男,医学硕士,主任医师,硕士生导师,主要从事神经外科肿瘤的临床及基础研究。
周开宇, E-mail: kerry2000year@163.com, Tel: 13957680507
Foundation item: The project supported by Traditional Chinese Medicine Science and Technology Plan of Zhejiang Province (2013ZA133)
2014-07-21 接受日期: 2015-02-20)
R979.1
A
1000-3002(2015)02-0240-07
10.3867/j.issn.1000-3002.2015.02.009
--------------------
