原矛头蝮蛇毒及其组分对凝血功能的影响
2015-03-02李亚男孙黔云路青瑜
李亚男, 孙黔云, 路青瑜
(贵州省中国科学院天然产物化学重点实验室 药理与活性筛选中心, 贵州 贵阳 550002)
原矛头蝮蛇毒及其组分对凝血功能的影响
李亚男, 孙黔云, 路青瑜
(贵州省中国科学院天然产物化学重点实验室 药理与活性筛选中心, 贵州 贵阳 550002)
目的 研究原矛头蝮蛇毒(PMV)及其组分作用于血液循环系统的部分生物学活性,进一步探讨其毒性机制。方法 采用Sephadex G-75凝胶层析方法分离不同分子质量范围的蛋白组分FⅠ, FⅡ和FⅢ。贫血小板血浆调节富血小板血浆使血小板为3×1011L-1,血小板悬液分别与PMV, FⅠ, FⅡ和FⅢ 0.03 g·L-1预孵育5 min,血小板聚集仪测定PMV及其组分诱导血小板聚集活性;PMV, FⅠ, FⅡ和FⅢ 0.05 g·L-1分别与纤溶酶原0.1 U·L-1预孵育10 min,采用单一时间点测定和酶动力学测定PMV及其组分酶切发色底物S-2251的作用;将大鼠血浆与PMV, FⅠ, FⅡ和FⅢ 1.0 g·L-1分别孵育5和30 min,测定凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)和纤维蛋白原(FIB)水平;PMV, FⅠ, FⅡ和FⅢ 10, 50和250 mg·L-1处理微血管内皮细胞24 h,倒置相差显微镜观察细胞形态,MTT法检测细胞存活;PMV, FⅠ, FⅡ和FⅢ 0.1 g·L-1与含卵磷脂和不含卵磷脂的豚鼠红细胞悬液分别孵育不同时间,计算溶血率。结果 与对照组相比,PMV和高分子质量蛋白组分FⅠ(>71 ku)诱导血小板聚集率显著升高〔(61.0±5.8)%和(56.9±5.9)%vs(12.4±4.1)%〕(P<0.01)。酶切发色底物S-2251结果显示,PMV与中分子质量组分FⅡ(18~37 ku)具有酶切发色底物的作用(P<0.01)。PMV和FⅠ可引起血浆凝固。与对照组相比,FⅡ组分和低分子质量蛋白组分FⅢ(<10 ku)明显使TT, APTT和PT的时间延长(P<0.01)。PMV, FⅠ及FⅡ导致内皮细胞解离悬浮,与对照组相比,细胞存活率下降,分别为(56.8±3.6)%,(71.6±3.8)%和(58.2±5.5)%。在无卵磷脂条件下,PMV和FⅡ可缓慢地引起红细胞轻度溶血;在卵磷脂参与下,PMV和FⅡ引起豚鼠红细胞急剧溶血,与正常对照组相比,在0.5 min内溶血率从(17.7±1.0)%分别升高至(81.0±4.0)%和(81.0±1.0)%(P<0.01)。结论 PMV在体外表现出多方面的血循毒性质的活性,不同分子质量蛋白组分活性机制及作用不同。
原矛头蝮蛇毒; 溶血; 抗凝; 血小板聚集
蛇毒是高度复杂的天然毒蛋白混合物,其中蝰科和蝮科蛇毒属于血循毒,主要表现为损害血液循环系统的功能。原矛头蝮蛇(Protobothropsmucrosquamatus)主要分布于我国长江以南和台湾地区,又名烙铁头蛇,属蝰蛇科原矛头蝮属。目前对原矛头蝮蛇毒(Protobothropsmucrosquamatusvenom, PMV)的研究主要是蛇伤后临床表征的收集,根据临床表象推测PMV破坏凝血功能,但并不清楚PMV对血液循环系统的具体作用。PMV的临床蛇伤表现主要为皮下出血、血尿、全身内脏出血甚至失血性休克[1]。前期研究表明,PMV在大鼠体内表现出明显的血循毒作用[2]。本研究通过观察血小板聚集、酶切活性、溶血活性、凝血指标以及血管内皮细胞活力的变化, 探讨PMV及其不同分子质量范围蛋白组分在体外影响血液循环系统部分功能的生物学活性。
1 材料与方法
1.1 动物、药物、试剂和仪器3只雄性SPF级Sprague-Dawley大鼠,体质量250~270 g,购自重庆腾鑫生物有限公司,合格证号:SCXK(渝)2007-2005;2只雄性体质量2.0~2.5 kg健康大白兔以及1只体质量330 g的雄性豚鼠均购自贵州省实验动物中心,合格证号:SCXK(黔)2012-001。动物福利及实验均符合相关实验动物管理条例和实验动物伦理要求。PMV冻干粉购自湖南省沅陵县徐氏蛇场;蛋白质分离介质Sephadex G-75凝胶和凝胶过滤分子质量测定试剂盒购自美国GE公司;低分子质量蛋白质标准为大连宝生物公司产品;电泳试剂均为美国Sigma公司产品;凝血酶时间(thrombin time, TT)、凝血酶原时间(prothrombin time, PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)和纤维蛋白原(fibrinogen, FIB)测定的试剂盒均购自上海太阳生物技术有限公司;发色底物S-2251为意大利Chromogenix公司产品;MTT购自美国Amresco公司;卵磷脂为杭州微生物试剂有限公司产品;其他试剂均符合实验要求。AKTA Prime蛋白层析系统及Gene Quant紫外分光光度计,瑞典Amersham Pharmacia Biotech公司;Spectra MAX-190连续波长酶标仪,美国MD公司;血小板聚集仪(LBY-NJ4),北京普利生仪器有限公司;5810R冷冻离心机,德国 Eppendorf公司;DYY-8C电泳仪及DYCZ-24D电泳槽,北京市六一仪器厂;Forma 3111型CO2培养箱,美国Thermo公司;Nikon TSl00倒置相差显微镜,日本Nikon公司;Milli Q超纯水系统和Elix纯水系统,美国Millipore公司。
1.2 PMV和蛋白组分的制备取PMV冻干粉1 mg,用1 mL PBS溶解,800×g离心10 min,取上清,为PMV溶液,分装后-20℃保存备用。0.5 g PMV冻干粉溶于3 mL PBS中,溶解后800×g离心10 min,取上清上样于用PBS平衡好的Sephadex G-75凝胶层析柱(2.6 cm×95 cm),制备不同分子质量范围蛋白组分。采用紫外分光光度计测定各组分280 nm吸光度值(A280 nm),A280 nm值为1.0定为蛋白质含量为1 g·L-1。采用凝胶过滤测定蛋白分子质量方法,利用Sephadex G-75凝胶在AKTA Prime蛋白层析系统上精确测定完成,通过白蛋白(67.0 ku)、卵清蛋白 (43.0 ku)、胰凝乳蛋白酶原(25.0 ku)和核糖核酸酶(13.7 ku)求出蛋白分子质量与洗脱体积之间的标准曲线,根据待测组分的洗脱体积计算各组分分子质量范围。采用SDS-PAGE测定PMV及各组分蛋白表观分子质量分布情况。
1.3 血小板聚集率测定健康大白兔心脏穿刺取血10 mL,枸橼酸钠0.109 mol·L-1与血样以1∶9混合抗凝。抗凝全血130×g离心10 min,取上清得到富血小板血浆(platelet rich plasma,PRP);剩余部分2600×g离心15 min;取上清得到贫血小板血浆(platelet poor plasma,PPP),用PPP调节PRP使血小板为3×1011 L-1。取270 μL PRP与30 μL PMV或G-75分离制备的各蛋白组分37℃预孵5 min,PMV及各组分终浓度均为0.03 g·L-1,以PBS作为对照。采用血小板聚集仪测定5 min最大聚集率。
1.4 酶切发色底物活性测定采用单一时间点测定和酶动力学测定方法分别测定PMV及各组分酶切发色底物S-2251的活性,参照文献[3]略加改动。取50 μL PMV或G-75分离制备的各蛋白组分和50 μL纤溶酶原0.1 U·L-1加入96孔板中,37℃恒温孵育10 min后加入100 μL S-2251底物0.75 mmol·L-1,然后37℃恒温避光孵育,单一时间点法测定60 min时A405 nm,酶动力学法每30 min测定一次A405 nm。PMV及各组分终浓度均为0.05 g·L-1。设PBS对照组和不含纤溶酶原对照组。
1.5 凝血指标测定3只SD大鼠腹腔注射1%戊巴比妥钠进行麻醉,下腔静脉取血,枸橼酸钠0.109 mol·L-1与全血1∶9混合抗凝,960×g离心15 min,取上清得大鼠血浆,将大鼠血浆混合后分装,-80℃冻存,使用前37℃水浴快速化冻。将大鼠血浆与PMV或G-75分离制备的各蛋白组分在37℃分别孵育5和30 min,按照TT, APTT, PT和FIB试剂盒说明书加入相关试剂分别进行测定。PMV及各组分在PT和APTT测定中的终浓度为0.3 g·L-1,在TT和FIB测定中终浓度为0.2 g·L-1,实验以PBS作为对照。
1.6 MTT法检测内皮细胞存活率人微血管内皮细胞(human microvascular endothelial cells,HMEC)由本实验室传代培养。HMEC用含20%胎牛血清的1640培养基于37℃、5%CO2和饱和湿度的条件下培养,至汇合成单层时收集待用。取细胞悬液100 μL(1×108 L-1)接种于96孔板,培养24 h后弃去培养液,每孔加入100 μL无血清1640培养基,再加入100 μL不同浓度的PMV或G-75分离制备的各蛋白组分,其终浓度分别为10, 50和250 mg·L-1,对照组加入等体积PBS。继续培养24 h,每孔加入20 μL MTT 5 g·L-1,培养4 h后,每孔加入溶解液50 μL,12 h后用连续波长酶标仪测定A570 nm,计算细胞存活率。细胞存活率(%)=(实验组A570 nm-空白组A570 nm)/(对照组A570 nm-空白组A570 nm)×100%。
1.7 红细胞溶血率测定参考文献[4]方法制备豚鼠红细胞悬液。健康豚鼠麻醉后下腔静脉取血,与等量阿氏液混合,4℃冷藏备用。用生理盐水洗涤红细胞并配制豚鼠红细胞悬液(4×1011 L-1)。取100 μL红细胞悬液于试管中,加入待测样品,再加入100 μL 0.01%卵磷脂或生理盐水,各管均用生理盐水补至1 mL,PMV及经G-75分离制备的各组分,终浓度均为0.1 g·L-1。分别孵育0.5, 30, 60和120 min,将试管置于37℃水浴孵育,每隔5 min轻摇试管1次。孵育完毕,以800×g离心10 min后取上清测定A412 nm,计算溶血率。实验同步设置血球对照管,以减去红细胞自发性溶血所形成的吸收值。溶血率(%)=(样品管A412 nm-血球管A412 nm)/(全溶管A412 nm-血球管A412 nm)×100%。
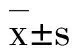
2 结果
2.1 原矛头蝮蛇毒及蛋白组分分子质量PMV经Sephadex G-75凝胶层析分离得到3个主要的蛋白分离峰,分别合并后命名为FⅠ, FⅡ和FⅢ(图1)。凝胶过滤测定各组分的分子质量分布范围分别为FⅠ>71 ku,FⅡ 18~37 ku,FⅢ<10 ku(图2)。采用非还原性12%SDS-PAGE测定PMV及各组分蛋白表观分子质量分布情况(图 3A),并用三羟甲基甘氨酸(tricine)-SDS-PAGE进一步呈现分子质量<10 ku的FⅢ蛋白表观分子质量(图 3B)。
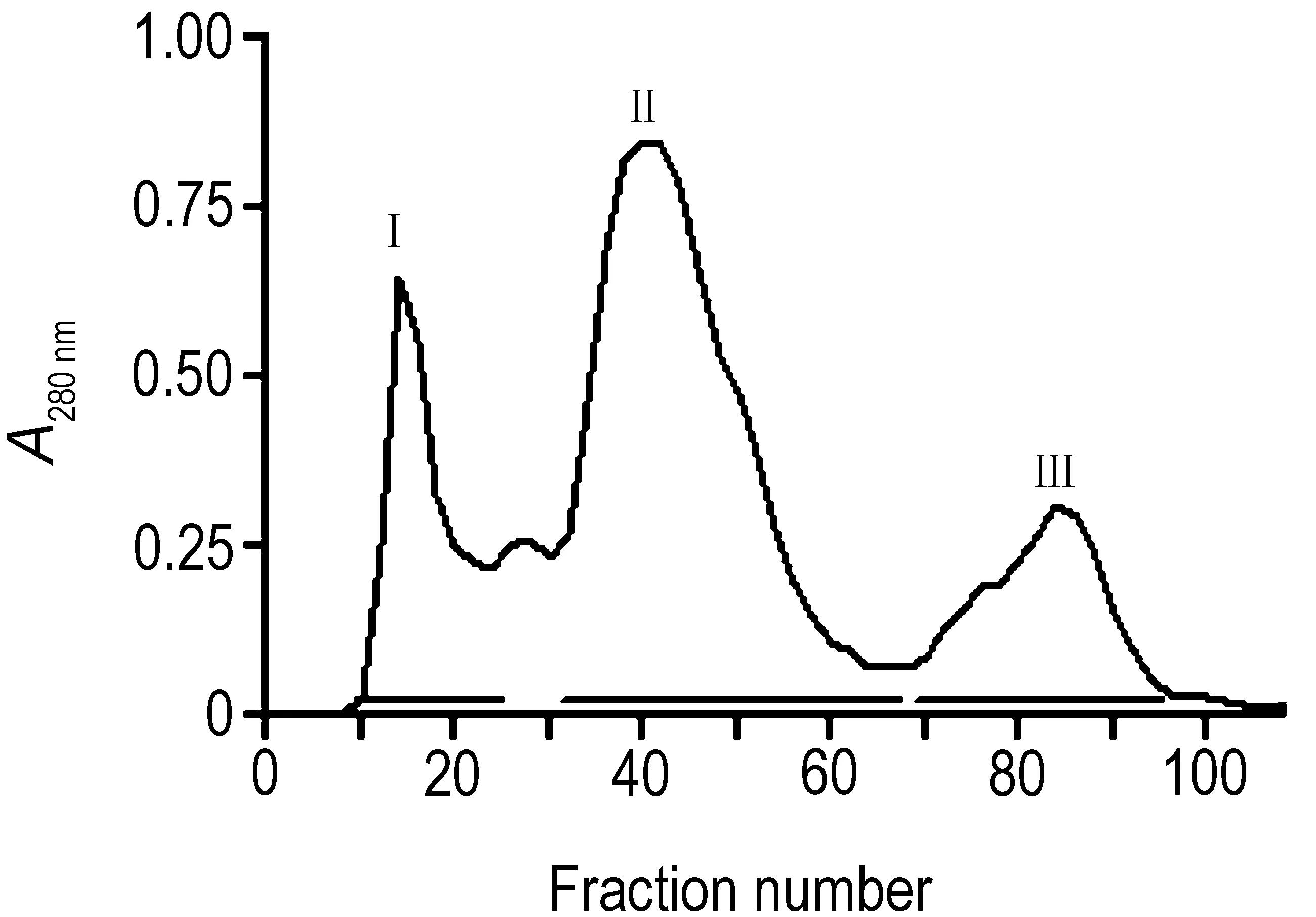
Fig.1 Gel filtration of Protobothrops mucrosquamatus venom (PMV) on Sephadex G-75 column. Total of 0.5 g of PMV was dissolved in 3 mL of PBS. The solution was centrifuged and the supernatant was applied to the Sephadex G-75 column(2.6 cm×95 cm). The column was eluted at a flow rate of 24 mL·h-1and the elutions were collected 4 mL per tube.
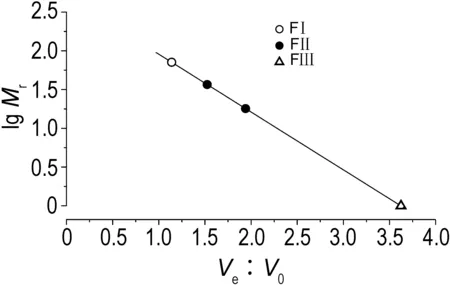

Fig.2 Molecular mass range of fractions by gel filtration on Sephadex G-75 column. The standard curve was generated by callibration markers, and molecular mass range of the fractions was calculated.Mr: relative molecular mass;Ve: elution volume; V0: void volume.
Fig.3 12%SDS-PAGE of PMV and its fractions(F) under non-reducing conditions(A) and tricine-SDS-PAGE of FⅢ under non-reducing conditions(B). A, lane 1:marker; lane 2:PMV; lane 3:FⅢ; lane 4:FⅡ; lane 5:FⅠ; B, lane 1:marker;lane 2:FⅢ.
2.2 原矛头蝮蛇毒及其组分诱导兔血小板聚集的作用血小板聚集实验结果(表1)表明,与对照组相比, PMV和FⅠ 0.03 g·L-1具有明显的诱导血小板聚集的作用,聚集率分别为(61.0±5.8)%和(56.9±5.9)%(P<0.01);FⅡ和FⅢ无诱导血小板聚集的活性。
Tab.1 Effect of PMV and its fractions FⅠ, FⅡ and FⅢ on aggregation of rabbit platelet
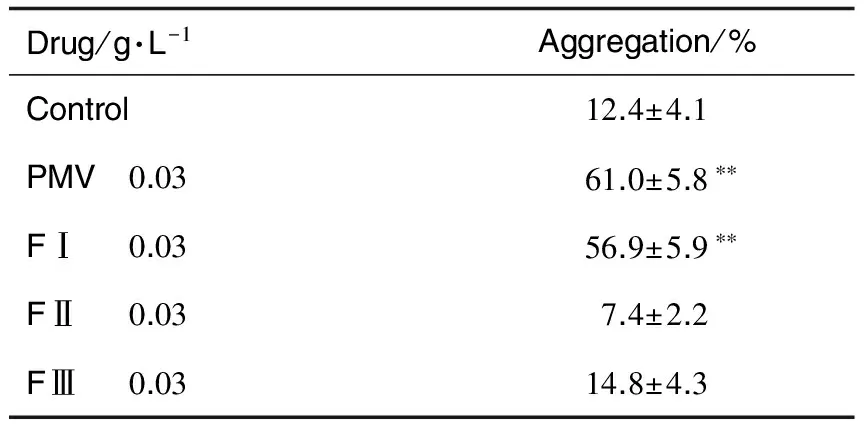
Drug/g·L-1Aggregation/%Control12.4±4.1PMV 0.0361.0±5.8∗∗FⅠ 0.0356.9±5.9∗∗FⅡ 0.037.4±2.2FⅢ 0.0314.8±4.3
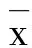
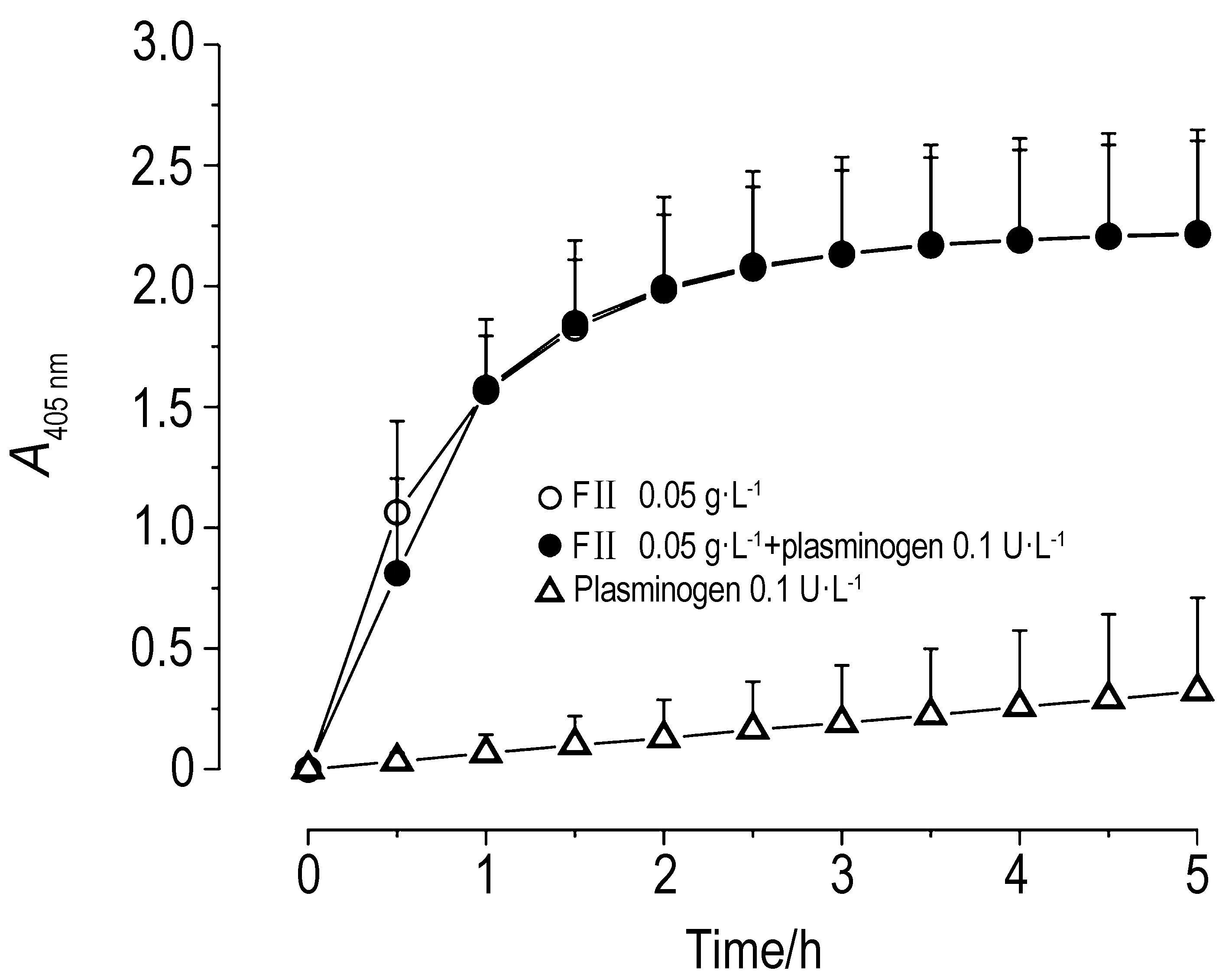
2.3 原矛头蝮蛇毒及其组分的酶切活性酶切发色底物S-2251单一时间点测定结果(表2)表明,PMV和FⅡ在有纤溶酶原或无纤溶酶原情况下均表现出明显的酶切活性(P<0.01)。对具有酶切活性的FⅡ进行酶动力学研究发现,在有纤溶酶原和无纤溶酶原条件下,5 h内FⅡ酶切底物S-2251酶动力曲线基本吻合,且最大反应速率分别为6.25±1.97和(6.26±1.93)milli-units·min-1,两者之间无统计学意义(图4)。
2.4 原矛头蝮蛇毒及组分对大鼠凝血功能的影响PMV和FⅠ与血浆孵育过程中即发生凝固现象,导致无法测定后续的凝血功能指标。表3结果显示,FⅡ和FⅢ与血浆孵育5 min即可导致TT, APTT和PT的延长(P<0.01),孵育30 min后TT, APTT和PT进一步延长,表现出时效性;FⅡ和FⅢ与血浆孵育5 min后即导致纤维蛋白原含量低于试剂盒检测下限(P<0.01)。
Tab.2 Effect of PMV and its fractions FⅠ, FⅡ and FⅢ on hydrolyzing substrate S-2251
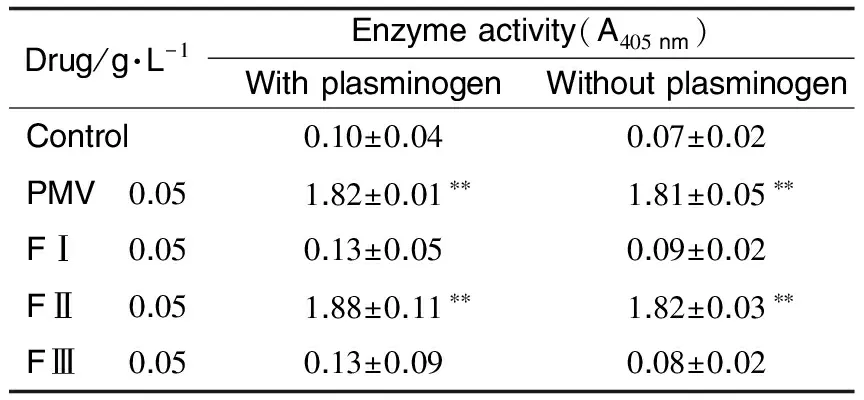
Drug/g·L-1Enzymeactivity(A405nm)WithplasminogenWithoutplasminogenControl0.10±0.040.07±0.02PMV 0.051.82±0.01∗∗1.81±0.05∗∗FⅠ 0.050.13±0.050.09±0.02FⅡ 0.051.88±0.11∗∗1.82±0.03∗∗FⅢ 0.050.13±0.090.08±0.02
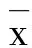
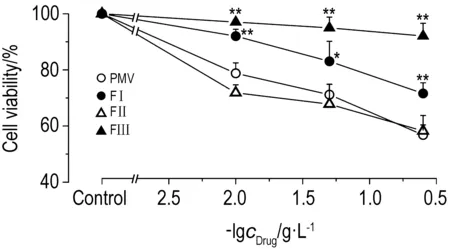
2.5 原矛头蝮蛇毒及组分对人微血管内皮细胞活力的影响形态学观察结果表明,对照组细胞呈铺路石状贴壁生长(图5A),PMV, FⅠ和FⅡ可导致HMEC解离悬浮(图5B,C,D),FⅢ组细胞呈贴壁生长状态,无细胞悬浮(图5E)。MTT检测结果(图6)表明,PMV、FⅠ和FⅡ能抑制内皮细胞存活,表现出一定的量效关系;FⅡ抑制作用强于FⅠ;FⅢ对内皮细胞存活略有抑制。
Tab.3 Effect of PMV and its fractions FⅠ, FⅡ and FⅢ on thrombin time (TT), prothrombin time (PT), activated partial thromboplastin time (APTT) and fibrinogen (FIB) content of rats

GroupTT/s530(min)PT/s530(min)APTT/s530(min)FIB/g·L-15 30(min)Control29.67±0.5830.33±0.5816.33±0.5816.33±0.5849.67±0.5854.67±1.53##〛1.111.16FⅡ41.33±1.53∗∗53.67±1.53∗∗##21.67±0.58∗∗40.67±1.53∗∗##115.67±4.16∗∗127.33±7.77∗∗〛<0.89∗∗<0.89∗∗FⅢ135.67±4.73∗∗183.67±7.37∗∗##89.67±3.51∗∗105.67±4.93∗∗#117.33±4.04∗∗160.67±3.06∗∗##〛<0.89∗∗<0.89∗∗#
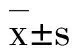
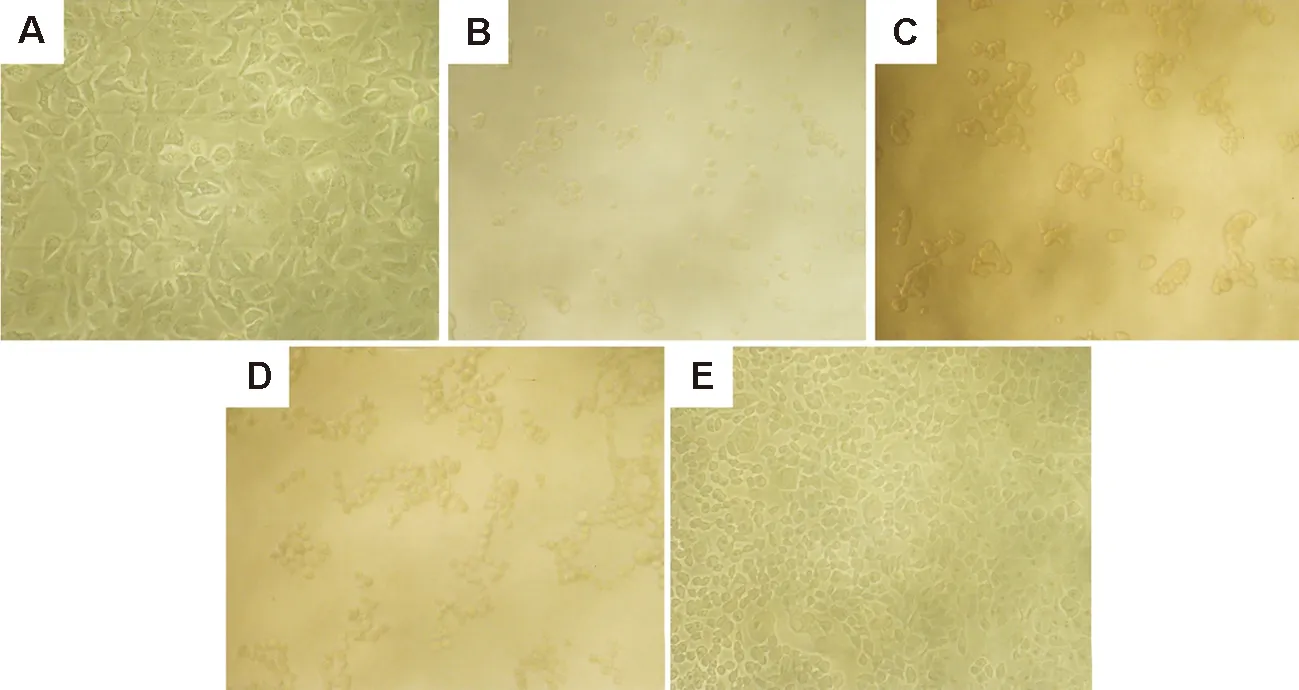
Fig.5 Effect of PMV(B) and its fractions FⅠ(C), FⅡ(D) and FⅢ(E) on adhesion of human microvascular endothelial cells (HMECs)(×100). HMECs were exposured to PBS or drug 250 mg·L-1for 24 h. A: normal control.

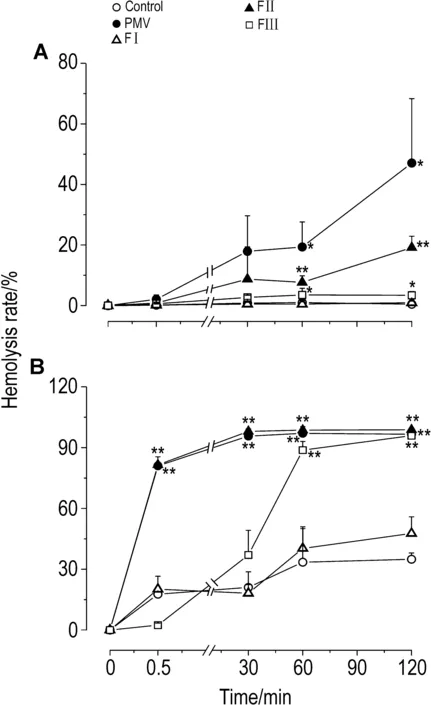
2.6 原矛头蝮蛇毒及组分的溶血活性在无卵磷脂条件下,PMV和FⅡ可缓慢地引起红细胞轻度溶血(图7A)。在卵磷脂参与下,PMV和FⅡ可迅速引起豚鼠红细胞剧烈溶血,孵育30 s后溶血率即达到(81.0±4.0 )%和(81.0±1.0)%(P<0.01);FⅢ的溶血率逐渐上升,孵育60 min后也达到(89.0±4.0) %(P<0.01)(图7B)。

3 讨论
本研究发现,PMV在体外具有显著诱导血小板聚集的活性,而3个蛋白组分中只有FⅠ表现出诱导血小板聚集活性(聚集率>55%),提示FⅠ是PMV中引起血小板聚集的主要功能组分。迄今已报道,PMV中C-型凝集素样蛋白TMVA[5]和L-氨基酸氧化酶TM-LAO[6]都具有诱导血小板聚集活性,其分子质量分别为128.5和110 ku,而FⅠ是分子质量>71 ku的蛋白组分。因此,提示上述2类分子参与FⅠ诱导血小板聚集的作用。S-2251是人工合成的用于检测纤溶酶及纤溶酶原激活物的小肽发色底物。本研究发现,PMV和FⅡ 0.05 g·L-1明显酶切底物S-2251 0.75 mmol·L-1,提示FⅡ是PMV中酶切发色底物S-2251的主要组分。为进一步了解FⅡ中是否存在纤溶酶原激活物,本研究采用酶动力学方法,观察FⅡ酶切底物S-2251的情况。实验结果表明,在有或无纤溶酶原条件下,FⅡ酶切底物S-2251的酶动力曲线基本吻合,且最大反应速率无统计学差异,提示FⅡ中可能不存在激活纤溶酶原的活性物质。迄今已有文献报道,PMV中含有纤维蛋白原水解酶[7-8],而本研究结果提示,PMV中可能不存在纤溶酶原激活物。前期研究发现,大鼠注射PMV后,TT和APTT明显延长[2]。文献报道,出血性蛇毒会引起消耗性凝血障碍[9]。本研究发现,FⅡ和FⅢ明显使大鼠血浆TT,APTT和PT明显延长,推测TT、APTT和PT的延长可能是FⅡ和FⅢ中一些蛋白引起凝血因子的消耗所致。目前,在许多蛇毒中发现了不同的C-型凝集素样蛋白,它们可直接结合凝血因子Ⅸ或Ⅹ从而破坏凝血功能[10],但PMV中是否存在此类蛋白还需要进一步研究。本研究发现,随着FⅡ和FⅢ与血浆孵育时间的增加,FⅢ延长血浆TT,APTT和PT更为明显,FⅡ延长血浆TT和PT更为明显,推测FⅡ和FⅢ对凝血功能的影响可能是其中的酶类所致。纤维蛋白原水平测定中,FⅡ和FⅢ使血浆加入凝血酶后均无法正常凝固,提示FⅡ和FⅢ以不同的方式消耗或降解血浆中纤维蛋白原。因此提示,PMV对凝血功能的影响是多方面的,不同的蛋白组分对凝血功能的作用有所不同。前期研究证明,PMV在体内可引起大鼠全血和PRP中血小板计数下降,TT和APTT延长,以及小鼠尾部出血时间明显延长,表现出显著的抗凝作用[2]。本研究表明,PMV和FⅠ可诱导血小板聚集,激活的血小板在机体内被清除后导致体内血小板数量减少,从而影响机体凝血功能。PMV和FⅠ可引起血浆凝固,提示其中可能含有类凝血酶样的活性物质。类凝血酶在体外使纤维蛋白原变成松散的纤维蛋白,表现为促凝活性。这些松散的纤维蛋白可快速被机体清除,造成机体纤维蛋白原水平降低,从而产生抗凝作用[9]。此外,本研究发现,PMV和FⅡ具有酶切发色底物的活性,提示PMV和FⅡ具有抗凝作用。FⅡ和FⅢ明显延长TT,APTT和PT,提示FⅡ和FⅢ从多方面影响凝血因子。因此,PMV中复杂的蛋白组分在体外对血小板、纤溶系统和凝血因子表现出不同的活性作用,但它们在体内综合作用最终表现为抗凝作用。血管内皮是蛇毒进入猎物体内后攻击的主要靶标,从而引起机体一系列病理生理反应,如水肿、出血和炎症等。本研究表明,PMV,FⅠ和FⅡ引起内皮细胞解离悬浮并抑制内皮细胞存活,提示PMV在体内可能会对血管内皮的结构和功能造成破坏。PMV,FⅠ和FⅡ引起内皮细胞解离的机制可能是某些酶类水解细胞外基质所致[11],也可能是非酶蛋白如去整合素样物质与细胞外基质整合素位点相互结合引起细胞解离悬浮。此外,L-氨基酸氧化酶和磷脂酶A2等一些毒性成分也会导致内皮细胞凋亡或坏死。因此,PMV对内皮细胞的破坏可能是多种蛋白的综合作用。原矛头蝮蛇伤的临床表现中有血尿现象[1]。我们之前的研究发现,大鼠在注射PMV 15 min后,即出现血尿现象,血中血红蛋白含量明显升高。本研究结果发现,只有FⅡ 0.1 g·L-1可引起豚鼠红细胞溶血,提示FⅡ是PMV中引起溶血的主要组分,其溶血现象在卵磷脂存在的条件下更为明显。PMV中含有磷脂酶A2[12],磷脂酶A2可水解红细胞膜的卵磷脂释放出溶血卵磷脂,从而使溶血活性级联放大,表现出强烈的溶血。因此,提示PMV和FⅡ的溶血活性可能主要是磷脂酶A2所引起的。由于各蛋白组分成分仍然复杂,因此,在下一步工作中应从各组分中进一步分离鉴定相关功能蛋白,并对单一蛋白成分进行研究,以更深入、全面的认识其毒性机制。
[1] Luo GP, Yue DY, Xu ZQ. Clinical analysis of delayed hemorrhage followingTrimeresurusmucrosquamatusbite[J].JSnake(蛇志), 2012, 24(3):254-255,257.
[2] Li YN, Sun QY. Anticoagulation effect ofProtobothropsmucrosquamatusvenom[J].ChinJPharmacolToxicol(中国药理学与毒理学杂志), 2013, 27(4):646-649.
[3] Zhang Y, Wisner A, Xiong Y, Bon C. A novel plasminogen activator from snake venom. Purification, characterization, and molecular cloning[J].JBiolChem, 1995, 270(17):10246-10255.
[4] Sun QY, Wang WY, Xiong YL.Invitrohemolyzation of a highly active anticomplement factor from the venom ofNajakaouthia[J].ChinPharmacolBull(中国药理学通报), 2003, 19(8):909-913.
[5] Wei Q, Lu QM, Jin Y, Li R, Wei JF, Wang WY,etal. Purification and cloning of a novel C-type lectin-like protein with platelet aggregation activity fromTrimeresurusmucrosquamatusvenom[J].Toxicon, 2002, 40(9):1331-1338.
[6] Wei JF, Wei Q, Lu QM, Tai H, Jin Y, Wang WY,etal. Purification, characterization and biological activity of an L-amino acid oxidase fromTrimeresurusmucrosquamatusvenom[J].ActaBiochimBiophysSin(生物化学与生物物理学报), 2003, 35(3):219-224.
[7] Ji RS, Sun QY, Yi Y. Purification and characterization of a novel double-stranded serine protease fromProtobothropsmucrosquamatusvenom[J].ChinPharmacolBull(中国药理学通报), 2011, 27(6):818-823.
[8] Ouyang C, Teng CM. Fibrinogenolytic enzymes ofTrimeresurusmucrosquamatusvenom[J].BiochimBiophysActa, 1976, 420(2):298-308.
[9] Ning Z, Li ZF, Li QB. Progress in effect of hemorrhagic snake venom on coagulation function[J].JSnake(蛇志), 2011, 23(4):368-369.
[10] Ishikawa M, Kumashiro M, Yamazaki Y, Atoda H, Morita T. Anticoagulant mechanism of factor Ⅸ/factor Ⅹ-binding protein isolated from the venom ofTrimeresurusflavoviridis[J].JBiochem, 2009, 145(1):123-128.
[11] Ye QL, Sun QY, Li M. Inflammatory mediators releasing and apoptosis of endothelial cell induced by cobra venom metalloproteinase atrase A[J].ChinPharmacolBull(中国药理学通报), 2009, 25(8):1001-1006.
[12] Xu TR, Wang WY, Meng QX, Huang YH, Lu QM, Xiong YL. A novel myotoxin from the venom ofTrimeresurusmucrosquamatus[J].ActaBiochimBiophysSin(生物化学与生物物理学报), 1999, 31(5):483-488.
(本文编辑: 乔 虹)
Effect of Protobothrops mucrosquamatus venom and its fractionson blood coagulation
LI Ya-nan, SUN Qian-yun, LU Qing-yu
(CenterforPharmacologyandDrugScreening,KeyLaboratoryofChemistryforNaturalProducts,GuizhouProvinceandChineseAcademyofSciences,Guiyang550002,China)
OBJECTIVE To investigate the effect ofProtobothropsmucrosquamatusvenom (PMV) and its fractions on functions of the circulatory systeminvitroin order to better understand its toxicity mechanism. METHODS PMV was isolated to three fractions FⅠ, FⅡ and FⅢ with a different molecular mass range by Sephadex G-75 gel filtration chromatography. Platelet rich plasma was adjusted to 3×1011L-1by platelet poor plasma. Platelet suspension was incubated with PMV and its fractions 0.03 g·L-1for 5 min, respectively, and platelet aggregation was determined on an LBY-NJ4 aggregometer. PMV and its fractions 0.05 g·L-1were preincubated with plasminogen 0.1 U·L-1for 10 min before chromogenic substrate cleavage activity was measured by endpoint and enzyme kinetics determination. PMV and its fractions 1.0 g·L-1were incubated with rat plasma for 5 or 30 min, and thrombin time (TT), activated partial thromboplastin time (APTT), prothrombin time (PT) and fibrinogen (FIB) content were assayed. The microvascular endothelial cells were exposed to PMV and its fractions 10, 50 and 250 mg·L-1, respectively, for 24 h, while the morphological change was observed using an inverted phase contrast microscope, and the cell viability was determined by MTT method. PMV and its fractions were incubated with guinea pig red blood cell suspension in the presence or absence of lecithin for different time, and hemolysis was measured. RESULTS Compared with normal control, platelet aggregation rate was significantly increased by PMV and FⅠ (>71 ku)〔(12.4±4.1)%,(61.0±5.8)% and (56.9±5.9)%〕(P<0.01). PMV and FⅡ (18-37 ku) significantly hydrolyzed chromogenic substrate S-2251(P<0.01). PMV and FⅠ caused plasma coagulation. Compared with normal control, FⅡ and FⅢ (<10 ku) remarkably prolonged TT, APTT and PT(P<0.01). Morphological observation revealed that PMV, FⅠ and FⅡ detached the adherent cells. Compared with normal control group, PMV, FⅠ and FⅡ inhibited cell viability, and the survival rate of the cells decreased to (56.8±3.6)%,(71.6±3.8)% and(58.2±5.5)%, respectively. PMV and FⅡ slowly caused slight hemolysis in absence of lecithin. PMV and FⅡ caused significant hemolysis in the presence of lecithin, and the hemolytic rate increased to (81.0±4.0)% and (81.0±1.0)%(P<0.01)in 0.5 min, respectively, compared with (17.7±1.0)% of the control group. CONCLUSION PMV possesses different activities that affect the functions of the circulatory systeminvitro, and the fractions play different roles in toxicity mechanisms.Key words:Protobothropsmucrosquamatusvenom; hemolysis; anticoagulation; platelet aggregation
SUN Qian-yun, Tel: (0851)83805095, E-mail: sunqy@hotmail.com
国家自然科学基金项目(81260494)
李亚男(1985- ),女,硕士研究生,主要从事天然药物成分及生理活性研究;孙黔云(1968- ),男,博士,研究员,主要从事心血管药理与新药发现研究。
孙黔云,Tel: (0851)83805095, E-mail: sunqy@hotmail.com
Foundation item: The project supported by National Natural Science Foundation of China(81260494)
2014-08-15 接受日期: 2015-02-10)
R996.3
A
1000-3002(2015)02-0284-07
10.3867/j.issn.1000-3002.2015.02.016
--------------------
