2014年美国上市新药选编
2015-03-02药学与临床研究编辑部编译
《药学与临床研究》编辑部编译
江苏省药学会,南京 210002
2014年美国上市新药选编
《药学与临床研究》编辑部编译
江苏省药学会,南京 210002
目的:介绍2014年美国上市新药的重点特性。数据来源:药品说明书,选择性补充已发布的研究数据和药品信息参考。数据分析:新药介绍共分十部分,回顾这些新药的适应症、用法用量、主要的药代动力学特性、药物相互作用和其他的警示内容。着重讨论了实际使用时的情况,或将新药与其他适应症相同的老药进行比较。结论:芜地溴铵/维兰特罗复方制剂是用于慢性阻塞性肺病维持治疗的第一个复方经口吸入剂,包含一种长效的β2受体激动剂和一种长效M胆碱能受体阻滞剂。吡仑帕奈和醋酸艾司利卡西平都用于癫痫部分发作患者的附加治疗。吡仑帕奈具有独特的抗癫痫机制而艾司利卡西平与奥卡西平性质相似。阿普斯特用于治疗成年活动性银屑病关节炎,口服吸收有效。阿伐那非是第四个磷酸二酯酶-5(PDE-5)抑制剂,用于改善男性勃起功能障碍,阿伐那非发挥药效比同类药物快。巴多昔芬是选择性雌激素受体调节剂,与雌激素组成复方制剂用于治疗绝经期中重度血管收缩症和预防绝经后骨质疏松。达巴万星、泰地唑胺和奥利万星对革兰阳性菌,包括耐甲氧西林葡萄球菌(MRSA)具有较强的抗菌活性,静脉输注可用于敏感菌引起的急性细菌性皮肤及软组织感染,其中泰地唑胺可口服。维多珠单抗用于常规治疗无效或不耐受患者的中重度活动期溃疡性结肠炎和中重度克罗恩病。阿必鲁肽用于2型糖尿病,是继艾塞那肽和利拉鲁肽后的第三个胰高血糖素样肽-1(GLP-1)受体激动剂。达格列净、恩格列净分别是第二、第三个口服的钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂类降糖药,与卡格列净性质相似。沃拉帕沙的药理作用很独特,它是一种蛋白酶激活受体1拮抗剂,可用于有心肌梗死和外周血管病史患者进一步降低心血管血栓风险。他司美琼是褪黑素受体激动剂,用于治疗非24小时睡眠障碍,这种昼夜节律性睡眠障碍常见于全盲患者。
新药;美国食品药品监督管理局(FDA);药物发展;药物市场;风险评估
本文选择介绍2014年美国上市的部分药物,包括支气管扩张剂、抗癫痫药、抗炎药、勃起功能障碍药物、绝经期药物、抗菌药、炎性肠病药物、降糖药、抗血小板药物、睡眠障碍药(见表1)。
支气管扩张剂
慢性阻塞性肺病(COPD)是美国是第三大致死疾病。吸烟是其最主要致病因。COPD的维持治疗往往包括一种长效的β2受体激动剂(例如沙美特罗,福莫特罗等)和一种长效M胆碱能受体阻滞剂(例如噻托溴铵等),通过口腔吸入。β2受体激动剂和胆碱能受体阻滞剂都可以起到扩张支气管的作用,药物中通常还会加入可吸入的糖皮质激素增加疗效。
芜地溴铵与维兰特罗(umeclidinium bromide/vilanterol trifenatate)
芜地溴铵与维兰特罗组成的复方制剂是第一个由胆碱能受体阻滞剂和β2受体激动剂组成的复方制剂。如果患者使用一种吸入型支气管扩张剂效果不佳时,便可以使用这种由两个作用机制不同的支气管扩张剂组成的复方制剂。该复方通过一个释药装置经口给药。虽然现在也有异丙托溴铵和沙丁胺醇组成的复方制剂,但是这两个药物半衰期短,每日需要多次给药。
芜地溴铵/维兰特罗复方制剂通过口腔吸入给药,每天1次,适用于有慢性阻塞性肺病(COPD),包括慢性支气管炎和/或者肺气肿患者中长期,气流阻塞的维持治疗。研究证明24周内与安慰剂或者复方制剂中单一成分相比,这种新型复方制剂可以增加呼吸第一秒末(FEV1)的用力呼气量。
噻托溴铵的适应症中包括降低COPD急性发作。但是,芜地溴铵/维兰特罗复方制剂没有这项适应症。这个新型复方制剂不能用于缓解急性支气管痉挛、不能用于治疗COPD急性发作、不能用于治疗哮喘。
芜地溴铵/维兰特罗复方制剂的禁忌、风险与单用β2受体激动剂或单用胆碱能受体阻滞剂情况相似。对于牛奶蛋白或者对该复方中任一成分严重过敏者禁止使用。如果出现突发的矛盾性支气管痉挛,应立即停药。因为芜地溴铵的抗胆碱作用,它可能会引起尿潴留及窄角型青光眼加重,患者如发生上述症状应立即与医生联系。如果和其他具有抗胆碱能作用的药物 (例如托特罗定、苯海拉明)合用,芜地溴铵的作用将大大增加,因此尽量避免这类药物一起使用。
需要警惕复方制剂中维兰特罗引起的不良反应。和长效其他β2受体激动剂(LABA)类似,维兰特罗的使用会增加哮喘-相关死亡风险,这条警示语已经作为黑框警示出现在药物说明书中,因此,这个新型复方制剂不能用于哮喘的治疗。对于心血管疾病患者、有惊厥性疾病患者、甲状腺功能亢进患者、糖尿病患者慎用。不要与含其他LABA的药物联用。β受体阻滞剂会降低维兰特罗的支气管扩张作用从而诱发严重的支气管痉挛,因此,需避免联合使用。维兰特罗通过肝脏细胞色素酶系CYP3A4代谢,因此同时使用酮康唑、克拉霉素等CYP3A4抑制剂将使维兰特罗的体内浓度和活性将增加,需谨慎联用。单胺氧化酶抑制剂和三环类抗抑郁药都会增加心血管不良事件风险,需要避免将该复方和这两类药同时使用,如果临床上有必要联用,应谨慎使用,注意监测。
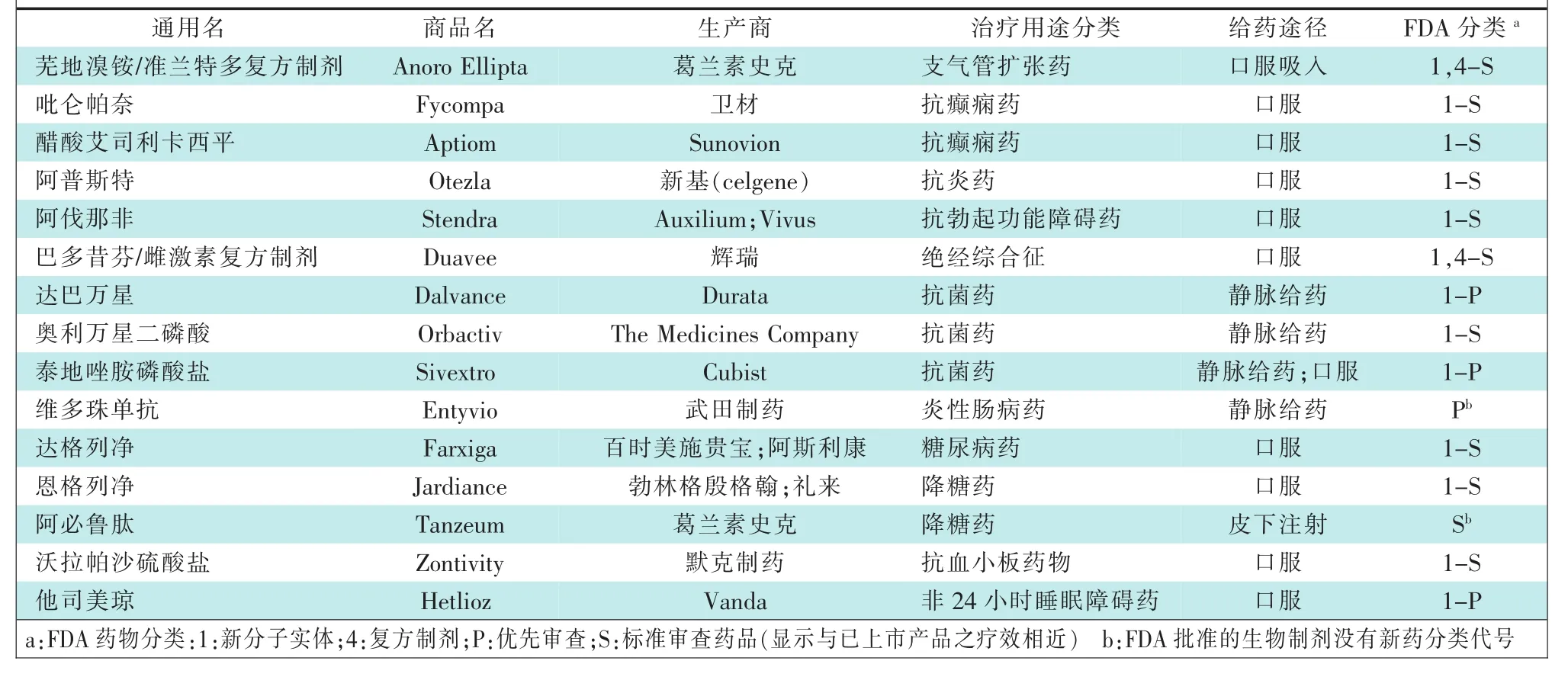
表1 2014年美国上市的部分新药
在临床试验中,芜地溴铵/维兰特罗复方制剂最常见的不良反应主要为咽炎(2%)、腹泻(2%)和手足疼痛(2%)。在妊娠期用药分类中,这个药物被归为C级。妊娠期间仅当潜在获益胜过对胎儿的风险时才能使用。COPD一般不会发生在儿童身上,所以这个药物没有在儿科进行有效性和安全性试验。
通过口腔吸入后,大部分的芜地溴铵和维兰特罗通过肺部吸收。芜地溴铵经CYP2D6代谢,通过P-糖蛋白转运。但是研究发现临床常用与芜地溴铵有关的药物对其代谢影响不大。肝功能不全患者、肾功能不全患者体内芜地溴铵的浓度变化不大。
塑料吸入器内预装芜地溴铵/维兰特罗,药物分别存于2个双铝箔泡条,各条有30个泡壳。每个泡壳内装微粉化的芜地溴铵粉末(62.5 mg芜地溴铵),或微粉化的维兰特罗粉末(25 mg维兰特罗)。吸入器开启后,两泡内的粉末暴露就绪,可顺利经患者口腔气流吸入。这两药粉末还包含一水合乳糖及牛乳蛋白。
芜地溴铵/维兰特复方制剂的推荐剂量为每日一吸,包含62.5 mg芜地溴铵和25 mg的维兰特罗。每日同一时间使用,24 h内不能多次使用。芜地溴铵/维兰特罗吸入器置于塑料托盘上,外加密封的防潮保护膜。初次使用前即从盘中取出。当吸入器计数读数为“0”时,泡壳内药物使用完毕(如果按照推荐剂量一日1次,则可用30天)或者打开贴膜托盘6周后,应该扔掉吸入器,以先到时间为准。
FDA批准芜地溴铵/维兰特复方制剂上市后,又批准了芜地溴铵作为单一口服药物上市。而维兰特罗仍然只能在复方制剂内使用。
抗癫痫药
又有两个治疗癫痫部分发作的新药在美国上市。部分发作仅影响脑部的一小块区域,但是可以波及大脑其他部位。以下分别介绍这两个治疗癫痫发作的新药。
吡仑帕奈(Perampanel fycompa,卫材公司)
吡仑帕奈是非竞争性的α-氨基-3-羟基-5-甲基-4-异恶唑丙酸型谷氨酸受体拮抗剂,通过抑制突触后AMPA受体谷氨酸活性,减少神经元过度兴奋。吡仑帕奈是FDA批准的首个具有该作用机理的抗癫痫药物。
吡仑帕奈用于12岁以上患者癫痫部分发作伴或不伴全身继发性发作的辅助治疗。FDA对吡仑帕奈的批准主要基于3项安慰剂对照的临床试验数据。这些试验中的患者平均患病时间约为21年,服用2~3种抗癫痫药,每28 d的基线癫痫发作频率中位数为9.3~14.3。三项研究中的主要终点均为治疗期间每28 d癫痫发作频率与基线水平比较的变化率。研究结果显示服用吡仑帕奈的患者与服用安慰剂的患者相比,癫痫发作控制率有改善。约50%的患者同时服用至少一种可诱导CYP3A4的抗癫痫药物(例如卡马西平,奥卡西平或苯妥英),导致吡仑帕奈的血药浓度显著降低。
使用吡仑帕奈需要关注它可能引起严重精神行为改变,说明书中将其作为黑框警告,警示医生和患者应注意相关神经精神事件风险,包括易怒、攻击行为、愤怒、焦虑、偏执等。正在服药的患者需要注意观察他们的精神行为上的改变,尤其在高剂量用药和剂量调整期。如果出现上述精神症状,需要减量,如果症状严重或者恶化应立即停药。
抗癫痫药物,包括吡仑帕奈在内都有增加自杀倾向的风险。使用任何抗癫痫药物的患者都应该监测其是否出现抑郁、沮丧的情绪,是否有自杀想法或行为,有无精神行为上的异常改变。
吡仑帕奈临床试验中最常见的不良事件包括眩晕 (32%)、嗜睡(16%)、疲劳(8%)、易怒(7%)、恶心(6%)、平衡失调(5%)、摔倒(5%)、步态障碍(4%)、体重升高(4%)、共济失调(3%)等。年纪大的患者,发生精神事件(眩晕、嗜睡、摔倒等)概率升高。患者服药期间避免进行有潜在危险的活动(如开车、操作机器),直到他们能够处理好这些精神症状。吡仑帕奈8 mg·d-1组和12 mg·d-1组的患者出现精神症状的发生率分别为8%和12%,安慰剂组则为5%,这些行为呈剂量依赖性。精神系统不良事件是导致治疗终止的最主要原因。服药的同时饮酒或者服用其他中枢系统镇静剂有可能增加上述中枢系统反应。
潜在研究表明,滥用吡仑帕奈产生欣快感的概率高于阿普唑仑,但是低于氯胺酮。它潜在的撤药反应尚没有充分研究。这个新药被归为Ⅲ类特殊管制药品。吡仑帕奈在妊娠期用药中归为C级,只有潜在获益胜过对胎儿风险时才能使用。如果妊娠期间有必要使用吡仑帕奈,患者应纳入北美抗癫痫药物孕期注册管理(1-888-233-2334)。吡仑帕奈在小于12岁的患者中的有效性和安全性没有确认。
口服吡仑帕奈后,药物迅速完全吸收。食物不会影响药物的吸收程度但会减慢吸收速度。药物主要通过CYP3A4、CYP3A5发生氧化还原反应以及随后进行葡萄糖醛酸化后失活。接近一半的药物经粪便排泄,四分之一经尿排泄。中度肝功能不全的患者需要减量服用。对于重度肝功能不全的患者、肾功能不全的患者或者正在进行血液透析的患者,吡仑帕奈慎用。
同时使用CYP诱导剂如抗癫痫药奥卡西平会降低吡仑帕奈血药浓度二分之一到三分之二。如果患者已经使用了酶诱导型抗癫痫药,吡仑帕奈的初始治疗剂量应该加大。服用吡仑帕奈的患者应该避免同时服用CYP3A4强诱导剂,例如利福平、金丝桃苷药物。
有报道每日12 mg的吡仑帕奈会降低左炔诺孕酮体内浓度近40%。因此,当服用吡仑帕奈的女性患者同时使用左炔诺孕酮避孕时,建议增加非激素类避孕方法。
对于没有同时服用酶诱导型抗癫痫药的患者,吡仑帕奈的初始剂量建议为每日一次,一次2 mg,睡前服用。可以2 mg为单位加量,但是不能在1周内迅速增加到4~8 mg/日。对于老年患者,剂量调整不要过于频繁,建议每2周进行剂量调整。
推荐维持剂量为每日8~12 mg。每日12 mg与8 mg相比可以更好地降低癫痫发作,但不良反应发生率也随之增加。每个患者的服药剂量应根据临床疗效和患者耐受程度进行调整。
对于同时服用酶诱导型抗癫痫药的患者,吡仑帕奈建议初始治疗剂量为每日4 mg。在临床试验中,这些患者使用吡仑帕奈后癫痫发作率显著下降,而且12mg/日剂量组的下降率高于8mg/日剂量组。服用吡仑帕奈的患者如果加用或者停用其他诱导型抗癫痫药,需要密切关注患者的临床反应和不良反应耐受性,且有必要进行药物调整。
对于中度肾功能不全的患者,应该考虑较温和的剂量调整方式。对于轻度、中度肝功能不全的患者,可以根据药品说明书调整给药剂量。
吡仑帕奈的药品规格为2、4、6、8、10、12 mg。
醋酸艾司利卡西平(EslicarbazepineacetateAptiomTM-Sunovion公司)
醋酸艾司利卡西平与现有抗癫痫药奥卡西平、卡马西平性质相似。口服后在体内转化为艾司利卡西平发挥抗癫痫作用。艾司利卡西平是奥卡西平活性代谢物的S-异构体,主要通过阻滞电压门控钠离子通道发挥抗癫痫作用。
艾司利卡西平临床用于成人癫痫部分发作的辅助治疗。FDA对艾司利卡西平的批准主要基于3项安慰剂对照的临床试验数据。这些试验中的患者平均患病时间约为19年,均服用1~2种抗癫痫药,每28 d的基线癫痫发作频率中位数为8。服用的最常见的抗癫痫药为卡马西平、拉莫三嗪和丙戊酸。三项研究中的主要终点均为治疗期间每28 d癫痫发作频率与基线水平比较的变化率。每一项研究结果均显示,艾司利卡西平可以有效降低癫痫发作。但是在一项最大的临床试验中(纳入约600名患者),28天癫痫发作频率仅1200 mg/日的剂量与安慰剂相比有统计学意义(6.0 vs 7.9),而800 mg/日与安慰剂相比没有统计学意义(6.5 vs 7.9)。
奥卡西平可以单独使用治疗癫痫部分发作,且可以用于2岁以上儿童。但是目前艾司利卡西平还未获批单独使用和用于儿童。
对于艾司利卡西平或者奥卡西平过敏的患者严禁使用艾司利卡西平。有报道使用艾司利卡西平发生血管性水肿、严重皮疹(包括斯蒂夫琼斯综合征)、嗜酸性粒细胞增多和全身脏器损害等过敏症状。如果患者服用艾司利卡西平期间出现上述过敏症状,应立即停药。如果患者之前因为服用奥卡西平出现过上述严重过敏反应,不建议使用艾司利卡西平。
包括艾司利卡西平在内的抗癫痫药都曾发现增加患者的自杀倾向。因此,临床上需要密切监测患者的情绪、行为变化。
艾司利卡西平(800 mg/日)在临床试验中最常见的不良事件包括眩晕(32%)、头痛(13%)、嗜睡(11%)、恶心(10%)、复视(9%)、视物模糊(6%)、呕吐(6%)、已疲劳(4%)、共济失调(2%)、震颤(2%)等。艾司利卡西平800 mg·d-1和1200 mg·d-1组的患者因为出现不良反应而停药的比例分别为14%和25%,安慰剂组则为7%。
剂量调整期出现眩晕等精神症状不良反应的概率增大,老年患者更易患精神症状。同时服用卡马西平的患者可增加眩晕可能性,需要考虑调整这两个药物的剂量。随着艾司利卡西平剂量增加,会发生认知功能障碍例如记忆丧失,方向障碍等。患者应避免同时服用包括酒精饮品在内的其他具有中枢神经系统作用的药物。
有患者在服用艾司利卡西平时出现低钠血症,因此服药期间需要监测患者血浆中钠离子、氯离子浓度,尤其需关注同时服用其他可降低血钠水平药物的患者。另有报道称该药会引起肝功能和甲状腺功能的异常,故建议用药前先评估肝功能。如果患者出现黄疸或者严重的肝脏损伤立即停药。
艾司利卡西平在妊娠期用药中归为C级,只有潜在获益胜过对胎儿潜在风险时才能在妊娠期使用。如果妊娠期间认为有必要使用艾司利卡西平,患者应纳入北美抗癫痫药物孕期注册管理(1-888-233-2334)。艾司利卡西平能够通过乳汁分泌,因此哺乳期患者或选择停止哺乳,或应停服此药。艾司利卡西平在18岁以下的患者中的有效性和安全性未见确认。
醋酸艾司利卡西平的口服生物利用度较高,食物不会影响它的药物代谢。进入体内后首先通过一相代谢反应生成艾司利卡西平。90%以上药物经尿液排泄,其中接近三分之二以艾司利卡西平形式存在,三分之一以葡萄糖醛酸结合物形式存在。因此对于中重度肾功能不全患者,建议减量服用。轻中度肝功能不全患者不需要调整剂量,而重度肝功能不全的患者未建立临床研究,故不建议使用。
不建议艾司利卡西平和奥卡西平联合用药,因为二者作用机制相同。酶诱导型抗癫痫药例如苯妥因、苯巴比妥、扑米酮可能会降低艾司利卡西平的体内药物浓度,需要增加后者的给药剂量。卡马西平也会降低艾司利卡西平的体内浓度,两药联用会增加不良反应发生概率。因此需要根据疗效及患者耐受程度对两药的剂量进行调整。艾司利卡西平和苯妥英的联合使用时需要监测患者的血药浓度。
艾司利卡西平对CYP2C19有抑制作用,对CYP3A4有诱导作用,如联用经这两个酶代谢的药物应注意监测。有报道称艾司利卡西平会降低血浆中炔雌醇和左炔诺孕酮的浓度,需要避孕的女性患者需要加量或者使用非雌激素类药物避孕。艾司利卡西平的推荐初始剂量为一次400 mg,每日一次。一周后,增加到800 mg并作为维持剂量。800 mg/日服用至少一周后,部分患者可以增加剂量到最大建议维持量1200 mg/日,但其不良反应发生率也相应增加。
对于中重度肾功能不全的患者,起始剂量为每次200 mg,每日一次。2周后,剂量可以增加到400 mg/日并作为维持剂量。部分患者可以增加到最大建议维持剂量600 mg/日并从中获益。
如果患者不能继续艾司利卡西平治疗,则需要逐渐减少剂量至停用以避免撤药反应造成癫痫突发的可能。
醋酸艾司利卡西平片的规格有200、400、600、800 mg。
抗炎药
目前美国有近800万人患有银屑病,其中40%的患者会发展为银屑性关节炎,伴有关节疼痛、肿胀、僵硬等症状。通常使用非甾体抗炎药作为银屑性关节炎的初始治疗药物。对于严重的银屑型骨关节炎,治疗药物主要有:改善症状的治疗风湿病的药物(DMARDs;如甲氨蝶呤)、糖皮质激素、肿瘤坏死因子(TNF)抑制剂(如阿达木单抗、利妥昔单抗、依那西普、格利木单抗、英夫利昔单抗)及白介素-12/23抑制剂优特克单抗(ustekinumab)。
阿普斯特(apremilast,OtezlaTM-新基医药)
阿普斯特为磷酸二酯酶-4(FDE-4)抑制剂,获准经口服治疗成年患者活动性银屑病关节炎。磷酸二酯酶-4可以介导cAMP向AMP转化,AMP进一步引发炎症。阿普斯特通过拮抗磷酸二酯酶-4,抑制AMP生成来减少炎症发生。罗氟司特(roflumilast)是另一个磷酸二酯酶-4抑制剂,临床上用于治疗严重的慢性阻塞性肺部疾病。
FDA对阿普斯特的有效性评估主要基于3项安慰剂对照的临床试验数据。纳入研究的活动性银屑病关节炎患者均正在服用或者之前曾使用过DMARDs,还有一些患者之前曾使用过TNF抑制剂等生物制剂。三项研究的主要终点均为服药16周后患者达到美国风湿病协会(ACR)的20标准(病情较基线改善20%及以上)的百分比。如果16周后患者的肿胀、疼痛关节改善没有达到20%,认为无效。
在三项研究中,患者服用阿普斯特治疗后达到ACR20的患者百分数分别为38%、32%和41%,而安慰剂分别为19%、19%,和18%。在ACR评估中,服用阿普斯特的患者可见7项指标有所改善(如肿胀关节数,疼痛关节数,疼痛程度)。服药16周后患者达到ACR50标准或ACR70标准的百分比分别为16%、11%、15%和4%、1%、4%。但是这个结果与安慰剂相比没有统计学差异。
临床试验中未将阿普斯特与其他药物直接比较,但仍可观察到单独使用阿普斯特在改善ACR指标上不及TNF抑制剂和优特克单抗。阿普斯特正在进行治疗银屑病和强直性脊柱炎的评估,预计两项适应症将很快获批。
阿普斯特临床试验中最常见的不良事件包括恶心 (9%)、腹泻(8%)和头痛(6%)等。应根据初始剂量下胃肠道反应情况进行剂量调整。报道称1%的患者有抑郁、沮丧情绪,0.2%的患者有自杀倾向。对于有自杀倾向的患者须慎用阿普斯特。患者一旦开始服用阿普斯特,患者本人及家属或者护工须重点关注这些情绪变化。
10%的患者会出现体重下降5%~10%,安慰剂组体重下降3%。服药期间需监测患者体重而且当体重快速下降时,应考虑立即停药。
阿普斯特被归为妊娠期用药C级,只有潜在获益胜过对胎儿潜在风险时才能在妊娠期使用。怀孕患者服用此药需进行孕期注册管理(877-311-8972)以监测用药安全。阿普斯特能否从乳汁中分泌尚未知,因此哺乳期患者慎用此药。18岁以下患者服用此药的疗效和安全性数据尚未建立。
与TNF抑制剂和优特克单抗这些静脉用药相比,阿普斯特口服有效。口服后,阿普斯特的完全生物利用度为73%。食物不会影响它的吸收。阿普斯特主要通过CYP3A4代谢,后经葡萄糖醛酸化和水解反应生成代谢产物。约58%和39%的药物以代谢物的形式分别通过尿液和粪便排出。严重肾功能不全患者需减量服药。
阿普斯特和利福平等强效CYP450酶诱导剂合用,代谢加快疗效下降。因此,不建议将阿普斯特与酶诱导剂(如利福平、卡马西平、苯巴比妥和苯妥英钠)联用。
初次使用阿普斯特前5日需要逐日调整剂量。第一天,早上服用10 mg;第二天,早晚各10 mg;第三天,早10 mg,晚20 mg;第四天,早晚各20mg;第五天,早20 mg,晚30 mg。第6天开始采用维持剂量即早晚各30mg。严重肾功能不全的患者(肌酐清除率小于30mL·min-1),每日早上服药,晚上不用药,建议维持剂量为每日一次,每次30mg。
阿普斯特薄膜衣片规格为10、20、30 mg。有一种二周用量的启动治疗包装,内含三种规格的阿普斯特片,可方便患者调整初始剂量。另有维持治疗包装,内装含2个泡卡,各含14片阿普斯特30 mg。
治疗男性勃起功能障碍的药物
阿伐那非(Avanafil,StendraTM-Auxilium公司,Vivus公司)
阿伐那非是第四个磷酸二酯酶-5抑制剂(PDE-5),用于改善男性勃起功能障碍,之前上市的有西地那非、他达那非、伐地那非。海绵体内NO释放使得阴茎勃起,NO激活鸟苷酸环化酶引起环磷酸鸟苷(cGMP)浓度增加,使海绵体内肌肉松弛,血液流入阴茎。PDE-5会引起海绵体中cGMP浓度下降,因此PDE-5抑制剂会增加NO作用。因为需要性刺激诱发NO释放,所以PDE-5抑制剂在无性刺激情况下无效。
临床试验证明与安慰剂相比,每一个PDE-5抑制剂对于治疗男性勃起功能障碍都更为有效,并且因长期服药或者疾病引发的男性勃起功能障碍患者也能因此获益。PDE-5抑制剂的疗效相似,未见直接头对头比较,如何选择主要考虑起效时间和持续时间。他达那非持续时间长,剂量选择范围大,但是起效较慢。阿伐那非起效较快,大多数患者可在开始性生活前15 min服药。西地那非和伐地那非则需提前60 min服药。PDE-5抑制剂都可用于改善男性勃起功能障碍。但其中他达那非无需选定在性生活前用药,可以每天小剂量服药达到改善男性勃起功能障碍作用,还可用来治疗良性前列腺增生(BPH)。但是目前,阿伐那非尚未获BPH适应症许可。
阿伐那非的不良反应及风险与西地那非、他达那非、伐地那非相似。和其他磷酸二酯酶抑制剂一样,阿伐那非不能和任何形式的有机硝酸盐类一起使用。在危及生命情况下必须给予硝酸盐时,应确保与末次阿伐那非的用药间隔在12 h以上,并密切照护患者血流动力学情况。PDE-5抑制剂有扩血管作用,可引起血压上升,减弱降压(α受体阻滞剂)的作用。对于正在服用α受体阻滞剂的患者,PDE-5抑制剂应该从最低剂量开始。正在服用PDE-5抑制剂的患者,α受体阻滞剂同样应从最低剂量开始。酒精也有血管舒张作用,因此服用阿伐那非的患者如果饮酒,可能发生体位性症状(例如体位性低血压,眩晕)。
如果患者有心血管疾病不适宜进行性生活,不建议使用阿伐那非,因其有增加心血管病患者性生活中潜在的心脏病风险。急性心肌梗死患者,危及生命的心律失常,近6个月内行冠状动脉血运重建术,静息血压低于90/50 mmHg,或者高于170/100 mmHg,或者不稳定心绞痛患者均未纳入阿伐那非临床试验中。
PDE-5抑制剂一般引起阴茎勃起持续时间不会超过4 h,一般不会引起持续勃起症(超过6 h的伴有疼痛的阴茎勃起)。如果勃起时间超过4 h,患者需要立即进行治疗。对于患有镰状细胞贫血症、多发性骨髓瘤或者有阴茎畸形(例如派若尼氏症)的患者阿伐那非和其他PDE-5抑制剂慎用。使用PDE-5抑制剂的患者很少会发生突然的单眼或者双眼失明,一旦发生前部缺血性视神经病变(NAION)可能和服用这些药物有关。如果患者出现上述反应应该立即停药并进行治疗。使用PDE-5抑制剂也会出现突然的听力下降或丧失并伴随耳鸣、眩晕,此时应该停药并考虑治疗。阿伐那非(100 mg)临床试验中最常见的不良事件包括头痛(7%)、面部潮红(4%)、鼻塞(3%)、鼻咽炎(3%)和后背疼痛(2%)。阿伐那非有引起过敏反应报道(皮肤瘙痒、眼睑肿胀),患者如果对阿伐那非片剂中任一成分有过敏史,须慎用。阿伐那非在出血性疾病患者和活动性消化性溃疡患者中的安全性尚未确认。
阿伐那非口服后吸收迅速,30~45min内达到最高血药浓度。虽然高脂饮食会降低吸收速度,但是仍可不考虑食物影响。在肝脏通过CYP3A4代谢后形成弱活性或者无活性的代谢物,62%通过粪便排出,约21%通过尿液排出。轻中度肝功能不全和肾功能不全无需调整剂量。对于重度肝功能、肾功能不全患者尚无用药资料,故不建议使用。
同时使用CYP3A4抑制剂会增强阿伐那非活性,应避免和强CYP3A4抑制剂(如克拉霉素、伊曲康唑、利托那韦)联合使用。如果患者正在服用中效CYP3A4抑制剂(如地尔硫艹卓、氟康唑、维拉帕米),建议阿伐那非的最大剂量为50mg,但是24小时之内只能服用1次。
阿伐那非开始剂量为100mg,性生活15min前开始服用。根据个体效果和耐受性,剂量可以调整到最大200mg,或者降低到50mg。最大剂量服药间隔不能少于1天。阿伐那非片规格为50、100、200mg。
绝经期药物
美国大约有3300万绝经期女性,其年龄分布为45~59岁,平均绝经年纪在51岁。绝经期女性卵巢功能减退,引起雌激素和其他激素水平下降。雌激素水平下降可导致血管收缩综合征如潮热,骨流失,增加骨质疏松风险。50岁以上美国妇女近50%骨密度偏低,骨质疏松风险增高。60多年来,绝经期综合征一直使用雌激素替代疗法进行治疗。虽然雌激素能降低绝经期综合征,但是单独使用有罹患子宫内膜癌的风险。为此,雌激素一般和孕激素同时服用。
雌激素/醋酸巴多昔芬复方制剂 (conjugated estrogens and bazedoxifene actate,DuaveeTM-辉瑞制药)
近期,一种雌激素/醋酸巴多昔芬复方制剂被批准用于治疗绝经期综合症。该复方中含有的雌激素(如普力马林)已经使用数十年,而巴多昔芬是一个新药,它是雌激素激动/拮抗双向调节剂,即选择性雌激素受体调节剂(SERM),在某些组织内它可激活雌激素受体,但在其它组织(如子宫)内又可抑制雌激素活性。该复方是首个获批用SERM代替孕酮的复方制剂,它还可以降低单用雌激素治疗绝经后综合症而引发的子宫内膜增生风险。
雌激素/醋酸巴多昔芬复方制剂主要用于治疗未行子宫切除术患者绝经期中重度血管收缩症状(如潮热)和预防绝经后骨质疏松。和其他雌激素复方一样,该复方应尽量缩短给药时间且充分权衡治疗的效益和风险。如果单纯预防绝经后骨质疏松,仅当患者有明确骨质疏松风险才可应用本复方,且应认真考虑使用非雌激素药物。
在一项安慰剂对照试验中,雌激素/醋酸巴多昔芬复方制剂有效降低绝经期潮热感觉证明其对绝经期血管收缩症的有效性。对绝经期骨质疏松预防作用的研究发现该新药可以有效地提高腰椎骨密度和双髋骨密度。
雷洛昔芬(raloxifene)用于治疗和预防绝经后妇女骨质疏松以及降低绝经后乳腺癌的风险。奥培米芬(ospemifene)2013年上市,主要用于治疗女性绝经期外阴和阴道萎缩引起的中至重度性交疼痛。
在安慰剂对照试验中,雌激素/醋酸巴多昔芬复方制剂最常见的不良事件包括肌肉痉挛(8%)、恶心(8%)、腹泻(8%)、消化不良(7%)、上腹痛(7%)、口咽痛(7%)、颈痛(5%)和头晕(5%)。
雌激素/醋酸巴多昔芬复方制剂的使用禁忌和风险包括单用雌激素引起的禁忌和风险。对于原因不明的异常子宫出血,已知或怀疑为乳腺癌或有乳腺癌病史,已知或者怀疑为雌激素相关性肿瘤,动静脉栓塞病史或活动期,已知蛋白C、蛋白S凝血酶缺陷或者其他的凝血障碍,已知肝功能不全或肝脏疾病,或者对组方中任一成分过敏的患者禁用。雌激素/醋酸巴多昔芬复方制剂在妊娠期用药中归为X级。孕期女性、准备怀孕女性和哺乳期女性禁用。
单用雌激素治疗的临床试验中卒中、深静脉血栓、65岁以上女性痴呆发生率增加。雌激素/醋酸巴多昔芬复方制剂也将上述不良反应列为黑框警告。本复方的黑框警告同时指出雌激素治疗不能用于预防心血管疾病和痴呆,而且雌激素单独服用(称作非对抗的雌激素,unopposed estrogen)有增加未行子宫切除患者罹患子宫内膜癌风险。
雌激素治疗会引起心脏疾病、高甘油三酯血脂、胆囊疾病、视力异常、甲状腺功能减退的发生率增加。服药期间需要监测甲状腺功能。同时进行甲状腺激素替代治疗和雌激素替代治疗的患者应增加甲状腺激素剂量。正在服用雌激素/醋酸巴多昔芬复方制剂的患者不能再服用其他雌激素、SERM、孕激素类药物。
雌激素/醋酸巴多昔芬复方制剂口服吸收好,但是巴多昔芬绝对生物利用度仅约为6%。雌激素部分通过CYP3A4代谢,而巴多昔芬通过肝脏小肠尿苷二磷酸葡萄糖醛酸基转移酶(UGT)代谢。雌激素主要通过尿液排泄,巴多昔芬主要通过胆汁消除,然后经粪便排泄。尚未对肾功能不全者和75岁以上患者进行研究,不建议上述患者服用。
和CYP3A4抑制剂如克拉霉素、伊曲康唑、西柚汁合用会增加雌激素的暴露,CYP3A4诱导剂例如卡马西平、利福平会降低雌激素血药浓度。UGT酶诱导剂如卡马西平、利福平会加快巴多昔芬代谢,减少其暴露。每片雌激素/醋酸巴多昔芬复方制剂含0.45 mg雌激素和20 mg巴多昔芬。建议每日服一片。服用该复方预防绝经后骨质疏松的患者,如果每日钙摄入不足建议同时补充钙和维生素D。
抗菌药
皮肤和软组织感染是革兰阳性链球菌和葡萄球菌感染的常见症状,尤其是耐甲氧西林葡萄球菌(MRSA)引起的感染近年迅速增加。社区获得的MRSA皮肤感染一般可口服甲氧苄啶-磺胺甲恶唑(复方磺胺甲恶唑)、克林霉素或者多西环素治疗。院内感染的MRSA皮肤感染(如蜂窝组织炎、大面积脓肿、创伤感染)患者一般(至少在初始阶段)需要静脉给予抗生素。针对这类感染,万古霉素仍然非常有效,其他可选的药物还有利奈唑胺(辉瑞,斯沃TM)、达托霉素(克必信TM)、特拉万星(VibativTM)和头孢洛林(CeftarolineTM)。利奈唑胺有口服和静脉给药两种剂型。
2014年有三种抗生素批准用于治疗敏感菌引起的急性细菌性皮肤和皮肤软组织感染 (acute bacteria skin and skin structure infections,ABSSSI),分别是达巴万星(DalvanceTM-Durata公司)、泰地唑胺 (SivextroTM-Cubist公司)和奥利万星二磷酸 (OrbactivTMMedicines公司)。FDA已授予上述抗生素 “合格抗感染产品”(Qualified Infectious Disease Product,QIDP)资格。QIDP是对抗生素设立的新药特批通道,2012年7月美国 《FDA安全与创新法》(FDA Safety and Innovation Act)下 《抗生素激励计划》(Generating Antibiotic Incentives Now,GIAN)设立该通道,旨在激励抗生素研发,以应对严重威胁生命的细菌感染。简单地说,QIDP=研究阶段快速通道(fast track)+审批阶段优先审评(priority review)+5年市场独占权。达巴万星(Dalvance-Durata公司)
达巴万星是首个获得FDA批准的QIDP,它由5含有结构类似的脂糖肽混合物,通过干扰细胞壁生物合成产生杀菌作用,其作用机制同特拉万星。达巴万星获准用于治疗革兰阳性菌所致急性细菌性皮肤和皮肤结构感染(ABSSSI)的成年患者。这些致病的革兰阳性菌包括金黄色葡萄球菌 (S.aureus)(含耐甲氧西林金黄色葡萄球菌[MRSA])、化脓性链球菌(S.pyogenes)、无乳链球菌(S.agalactiae)、咽峡炎链球菌群(包括咽峡炎链球菌[S.anginosus]、中间型链球菌[S. intermedius]、星群链球菌[S.constellatus])。仅当证明或强烈怀疑由敏感细菌所致的感染才能使用达巴万星。
体外研究显示,达巴万星对万古霉素敏感的屎肠球菌(Enterococcus faecium)和粪肠球菌[E.faecalis],以及万古霉素中介的金黄色葡萄球菌有活性,但尚不知其临床意义。
研究显示,每周一次静脉注射达巴万星可实现与每日两次静脉注射万古霉素后改为口服利奈唑胺治疗同样的效果。新药组在第1天和第8天分别予1 g和500 mg达巴万星静脉治疗;对照组在静脉给予至少3日万古霉素(1 g或15 mg·kg-1,q12h)后再口服利奈唑胺(600 mg,q12h)10~14天。该研究的主要终点为早期应答,即用药48~72 h红斑蔓延停止,皮损面积较基线减少20%以上。汇总分析显示,达巴万星组和万古霉素-利奈唑胺组达到主要研究终点的患者比例分别为79.7%和79.8%,证明达巴万星与万古霉素疗效相当。
达巴万星偶见引起严重过敏反应,有上述过敏反应的患者应禁用达巴万星。使用达巴万星前,应仔细询问患者既往对糖肽类药物(包括万古霉素)的过敏史。
如果达巴万星静注过快,可能出现“红人综合征”(比如上身发红、荨麻疹、瘙痒和/或皮疹)。停止或减慢输注可能使症状消失。为降低风险,达巴万星静脉输注时间不得低于30 min。
临床研究阶段达巴万星最常见的不良反应是恶心 (6%)、头痛(5%)和腹泻(4%)。由于全身用抗生素常见的不良反应——难辨梭状芽孢杆菌(又称艰难梭菌)-关联腹泻(CDAD)也见于使用达巴万星后,故患者使用达巴万星出现腹泻,应考虑到CDAD。部分患者使用达巴万星后转氨酶水平升高,肝功能异常的报告数与对照组相当。
达巴万星被归为妊娠用药C类,妊娠期间仅当潜在获益胜过对胎儿风险时才可使用。尚不可知达巴万星是否经乳汁排泄,故哺乳妇女慎用。同特拉万星一样,达巴万星在儿童中的安全性和有效性数据尚未建立;而万古霉素和利奈唑胺则获准可同时用于儿童和成年人。
由于达巴万星作用时间很长,故只需2剂方案即可达到疗效,2剂用药间间隔一周。达巴万星大部分以原型药代谢,经尿排泄,故严重肾损患者用药需减量。
达巴万星给药方案为静脉输注历时30 min,推荐剂量为2剂用药:1000mg接着一周后500mg。对肾功能受损患者,已知肌酐清除率小于30 mL·min-1和不接受定期血液透析,达巴万星的推荐2剂方案是750 mg接着一周后375 mg。定期血液透析患者无需剂量调整。
达巴万星是500 mg西林瓶包装的冻干粉,必须使用25 mL注射用无菌水重建,操作应轻轻旋转和倒置间交替小瓶直至其内容物被完全溶解,避免起泡,重建的小瓶含20 mg·mL-1达巴万星为透明,无色至黄色溶液。重建达巴万星溶液从小瓶转移至一个含5%葡萄糖注射液,被稀释溶液必须有最终达巴万星浓度1 mg·mL-1至5 mg·mL-1。
泰地唑胺磷酸盐(SivextroTM-Cubist公司)
泰地唑胺磷酸盐是一种前药,在体内通过磷酸酶水解成活性的泰地唑胺。它是一种恶唑啉酮类抗菌素,结构类似利奈唑胺。泰地唑胺结合细菌核糖体50S亚基从而阻止细菌蛋白质合成和细菌繁殖。泰地唑胺可口服或静脉输注,用于治疗成人革兰阳性敏感菌引起的ABSSSI。这些致病菌包括金黄色葡萄球菌(含MRSA)、化脓性链球菌、无乳链球菌、咽峡炎链球菌群(包括咽峡炎链球菌、中间型链球菌、星群链球菌,以及粪肠球菌)。泰地唑胺仅用于被证明或强烈怀疑由敏感细菌所致的感染。
体外试验显示,泰地唑胺对万古霉素和利奈唑胺不敏感的葡萄球菌和肠球菌有活性,但尚不知其临床意义。
两项非劣效性对比试验证实,泰地唑胺(200 mg qd给药6天)的效果与利奈唑胺(600 mg bid给药10天)相当。其中第一项试验的患者都采用口服给药,而第二项试验则先静脉用药1天以上再转为口服给药。主要终点是治疗开始48~72 h后,皮损面积不增加(第一个试验)或皮损面积减少20%以上(第二个试验)。泰地唑胺在两项试验中达到主要临床终点的比例分别为80%和85%。
有报道使用利奈唑胺出现骨髓抑制,建议每周行全血细胞计数检查。对中性粒细胞缺乏症(中性粒细胞计数<1000/mm3)患者使用泰地唑胺的安全性和有效性未见报道,建议这类患者考虑替代疗法。
临床常见不良反应是恶心(8%)、头痛(6%)、腹泻(4%)。几乎所有全身用抗菌药物,包括泰地唑胺,曾报道艰难梭菌(C.difficile)相关腹泻。故患者出现腹泻时应考虑的抗生素原因。
泰地唑胺被归为妊娠用药C类,妊娠期间仅当潜在获益胜过对胎儿风险时才应使用。泰地唑胺是否经乳汁排泄尚不清楚,故哺乳期妇女慎用。18岁以下患者使用泰地唑胺的有效性和安全性未见报道,但利奈唑胺的适应症则包括成人和儿童。
体外研究显示泰地唑胺具有可逆的单胺氧化酶(MAO)抑制活性。目前尚未进一步研究该结果对临床使用有何影响,且使用MAO抑制剂的患者都未被纳入泰地唑胺的临床研究中。然而,利奈唑胺的说明书将患者正在使用MAO抑制剂或两周内使用过MAO抑制剂都列为药物禁忌。利奈唑胺的说明书还对使用五羟色胺能药物作出警示 (如选择性五羟色胺再摄取抑制剂SSRIs可能出现五羟色胺综合征)。鉴于泰地唑胺与利奈唑胺的结构相似,建议使用五羟色胺能药物的患者考虑用其他抗菌药物替代。
泰地唑胺的绝对生物利用度接近90%,口服-静脉给药方式转换时无需调整剂量。该药主要通过肝脏代谢,约80%以非活性的硫酸盐形式经粪便排泄。肝肾功能损害的患者也无需调整剂量。
泰地唑胺的推荐剂量是200 mg qd使用6天。相比之下,利奈唑胺给药更频繁,需要每天给药2次共10天,儿童患者甚至需要每天给药3次。泰地唑胺磷酸盐有200 mg薄膜衣片和注射用200 mg冻干粉两种剂型。注射用泰地唑胺冻干粉需要在4 mL注射用水中重建,然后转移至250 mL 0.9%氯化钠注射液中。泰地唑胺注射液与其他含二价离子(如Mg2+,Ca2+)的注射液不能配伍,如乳酸林格液。
当静脉输注泰地唑胺时,输注时间为1小时。
奥利万星二磷酸(OrbactivTM-Medicines公司)
奥利万星是一种脂糖肽类抗菌药,他和达巴万星、特拉万星的性质相似,通过作用于细胞壁干扰细菌膜稳定性而产生杀菌作用。
OrbactivTM是FDA批准的唯一一种可以单剂量治疗ABSSSIs的抗生素。患者仅接受一次OrbactivTM输液,整个治疗方案便已结束。此药上市前患者往往需要多次静脉输注抗生素,而奥利万星单剂量治疗方案,将显著减少患者的剂量负担。奥利万星用于治疗由敏感革兰阳性菌导致的ABSSSIs成人患者。该致病的革兰阳性菌包括金黄色葡萄球菌(包括MRSA)、化脓性链球菌、无乳链球菌、停乳链球菌、咽峡炎链球菌群(包括咽峡炎链球菌、中间型链球菌、星座链球菌,以及粪肠球菌)。仅当确证或强烈怀疑由敏感菌所致的感染才能使用奥利万星。
体外研究显示,针对某些药物耐药的革兰阳性菌株,奥利万星也有活性,但尚不知其对应的临床意义。
两项非劣效性试验证实,奥利万星(1200 mg,Ⅳ)仅注射一次与万古霉素(1 g或15 mg·kg-1体重,每天2次)注射7~10天的疗效相当。主要终点包括早期临床应答(指治疗后48~72 h,皮损较基线减少或停止扩散,无发热,无需再次使用抗生素)。两项研究共85%的患者用药48~72 h内皮损面积降低20%以上,与万古霉素疗效相当。
奥利万星偶见引起严重过敏性反应,对奥利万星过敏者禁用。有糖肽类药物过敏史包括万古霉素过敏的患者应慎用奥利万星。
糖肽类抗菌药物相关的输注不良反应(如瘙痒、荨麻疹、红斑)也见发生于奥利万星。减量使用或停用奥利万星可使上述症状消退。
奥利万星常见不良反应为恶心(10%)、头痛(7%)、呕吐(5%)、腹泻(4%)、四肢及皮下脓肿(4%)。几乎所有全身抗菌药物包括奥利万星,都曾报道过艰难梭菌相关腹泻。故使用奥利万星后出现腹泻症状应考虑为抗生素所致的艰难梭菌相关腹泻。
大量使用奥利万星的患者出现骨髓炎的概率大于万古霉素。使用奥利万星一旦出现骨髓炎应采用其他药物替代。
虽然奥利万星对凝血系统没有影响,但奥利万星和大量华法林共同给药有出血风险,需要频繁监测凝血情况。凝血试验中所采用的磷酸脂试剂具有凝血激活的作用,而奥利万星可与磷酸脂试剂结合,阻断后者的凝血作用。凝血测试发现奥利万星用药24 h内可延长凝血酶原时间(PT)和国际标准化比值(INR),用药48 h内可延长活化部分凝血活酶时间(aPTT)。所以奥利万星用药24 h内所监测的华法林抗凝效果是不可靠的。因奥利万星用药48 h内可造成aPTT假性增高,故在此期间禁用肝素钠。当患者服用奥利万星48 h内需要监测aPTT,应采用非磷酸脂质试剂依赖的凝固测试,如采用凝血因子Xa(生色)试验或替换其他不需要监测aPTT的抗凝药。
奥利万星为孕期用药C级,仅当潜在获益超过对胎儿风险时才应使用。如同达巴万星和泰地唑胺,18岁以下青少年患者使用奥利万星的有效性和安全性未见报道;而万古霉素可用于成人和儿童。
奥利万星的末端半衰期约245 h,如此长的半衰期才得以使奥利万星单剂量给药方案满足ABSSSI的治疗要求。奥利万星以原型在粪和尿中缓慢排泄,用药2周粪和尿中药物回收率分别小于用药剂量的1%和5%。对有轻中度肾损或轻中度肝损患者无需调整用药剂量。重度肝损或重度肾损患者用药资料缺乏。
奥利万星的推荐剂量是1200 mg静脉输注不少于3h。药物以每瓶400mg冻干粉包装,一次推荐剂量3瓶。每瓶冻干粉都用40 mL注射用水重建,再经5%葡萄糖注射液(D5W)稀释后供注射。稀释方法为:从1000 mL的D5W中吸取120 mL倒掉,再分别从三个重建的小瓶中各抽吸40 mL加入至D5W中,使溶液终浓度1.2 mg·mL-1。贮存于室温的稀释后静脉输注液应在6 h内使用,或存于冰箱(2至8℃)时在12h内使用。奥利万星溶液重建时仅能使用D5W,而不能使用氯化钠注射液,因氯化钠与奥利万星产生沉淀。
用于炎性肠病的药物
炎性肠病主要包括溃疡性结肠炎(Ulcerative colitis)和克罗恩病(Crohn disease)。预计美国有62万溃疡性结肠炎患者和50万克罗恩病患者。溃疡性结肠炎是一种慢性非特异性炎症,病变累及直肠和结肠的黏膜及黏膜下层;克罗恩病是一种慢性肉芽肿性炎症,病变可累及胃肠道各部位,但多见于回肠。除炎症和疼痛外,溃疡性肠病和克罗恩病患者还多见胃肠道出血、腹泻、减重等并发症。这两种疾病按严重程度分级都可分为轻度、中度、重度三个阶段。炎性肠病的病因尚不明确,一般认为该病是由基因、免疫、环境(如外源物质引起的宿主反应)这三种因素相互作用的结果。
治疗溃疡性结肠炎和克罗恩病的目标是诱导和维持黏膜愈合。氨基水杨酸盐(例如美沙拉嗪)常用于治疗轻中度溃疡性结肠炎,但不推荐用于治疗克罗恩病。其它用于溃疡性结肠炎和/或克罗恩氏病的药物包括皮质类固醇(如布地奈德、氢化可的松、强的松),免疫调节剂(如硫唑嘌呤、巯嘌呤、甲氨蝶呤、环孢素、他克莫司)和肿瘤坏死因子(TNF)拮抗剂。TNF拮抗剂阿达木单抗(修美乐TM,HumiraTM)和英夫利昔单抗(类克TM,RemicadeTM)适应症都包括溃疡性结肠炎和克罗恩病,而戈利木单抗(SimponiTM)适用于溃疡性结肠炎,赛妥珠单抗(CimziaTM)适用于克罗恩病。那他珠单抗(TysabriTM)最初用于治疗多发性硬化症的复发,但随后也被批准用于治疗克罗恩病。
维多珠单抗(Vedolizumab,Entyvio-武田制药公司)
维多珠单抗是人源化单克隆抗体,它与整合素α4β7特异性结合,是一种整合素受体拮抗剂。整合素α4β7主要表达于记忆性T淋巴细胞表面,其配体——黏膜地址素细胞黏附分子(MAdCAM-1)主要表达于内皮细胞表面。整合素α4β7与MAdCAM-1相互作用,介导淋巴细胞穿越内皮细胞间隙,渗入胃肠道炎症部位,对溃疡性结肠炎和克罗恩病的慢性炎症产生有重要影响。故维多珠单抗通过抑制整合素与MAdCAM-1的相互作用,抑制记忆性T淋巴细胞穿过内皮细胞并阻止其进入胃肠道的炎症部位。维多珠单抗仅特异型拮抗整合素α4β7,不像那他珠单抗还会同时拮抗整合素α4β1,故不会导致因拮抗整合素α4β1与其配体——血管内皮细胞粘附因子(VCAM-1)结合而引发的中枢神经系统副作用。
维多珠单抗通过静脉输注,用于治疗成人中重度活动期溃疡性结肠炎和轻至重度活动期克罗恩病,但使用该药仅限于患者对一种TNF拮抗剂或免疫调节剂已反应不足,或不能耐受;或对皮质激素应答不足,不能耐受,或显示依赖性。维多珠单抗对溃疡性结肠炎的适用为诱导和维持临床反应,诱导和维持临床缓解,改善内窥镜粘膜外观,实现无皮质激素缓解;对克罗恩病的适用为实现临床应答,临床缓解和无皮质激素缓解。
维多珠单抗的有效性在安慰剂对照的GEMINI系列研究中得到证实,对各适应症的缓解率显著高于安慰剂,且维多珠单抗对溃疡性结肠炎的疗效优于克罗恩病。
临床研究显示维多珠单抗偶见严重过敏性反应,近1500患者中仅1人发生严重过敏反应。一旦出现过敏反应则应停用维多珠单抗。对该药及辅料过敏的患者禁用。维多珠单抗像其他可影响免疫作用的药物一样,也会增加感染的风险。故患者在严重感染活跃期直到感染被控制前,都不能使用维多珠单抗。如果维多珠单抗治疗期间出现感染,应考虑停药。在使用维多珠单抗治疗前,所有患者应按照最新的免疫指南接种疫苗,且为灭活疫苗(如注射流感疫苗)。
另一种整合素受体拮抗剂那他珠单抗,曾见渐进多灶性脑白质病(progressive multifocal leukoencephalopathy,PML)风险。PML是一种罕见却有致命危险的中枢神经系统(CNS)感染。PML由约翰·坎宁安病毒[John Cunningham,JC]引发,在免疫受损患者中易感,故那他珠单抗在这类患者中的使用受限。鉴于整合素受体拮抗剂曾发生的PML风险,维多珠单抗的临床研究曾积极监测患者的PML风险。结果显示维多珠单抗暴露患者未发现PML病例,但仍应密切监护患者神经学体征和症状(如四肢倦怠、视力障碍、思维混乱、记忆减弱、性格变化)的新发甚至恶化。
维多珠单抗常见不良反应为鼻咽炎(13%)、头痛(12%)、关节痛(12%)、恶心(9%)、发热(9%)、上呼吸道感染(7%)、乏力(6%)、咳嗽(5%)。使用维多珠单抗曾被报道转氨酶和/或胆红素的升高,一旦出现黄疸或其他肝损症状就应立即停药。
维多珠单抗为孕期用药B级,仅当潜在获益胜过对胎儿风险时才能使用。儿童患者使用维多珠单抗的有效性和安全性未见报道。维多珠单抗采用静脉滴注给药,滴注时间不少于30 min,不能采用静脉推注。应由专业人员全程监护输注过程,准备处理应对过敏反应。维多珠单抗的推荐剂量为每次300 mg,在第0、2和6周注射,以后每8周注射一次,若在第14周时未显示治疗获益则应终止治疗。
注射用维多珠单抗冻干粉规格为300 mg西林瓶装,需置冰箱冷藏。临用前小瓶内加4.8 mL无菌注射用水重建,轻轻旋转小瓶15秒至冻干粉溶解,但不可剧烈摇晃或倒置。同法吸取小瓶内5 mL重建液体加入250 mL 0.9%氯化钠溶液中供注射使用。完整的重建和稀释指导见产品说明书。
降糖药
2型糖尿病治疗药物家族再添三位新成员。
达格列净(dapagliflozin propanediol,FarxigaTM-百时美;施贵宝;阿斯利康公司)
达格列净是第二个口服的钠-葡萄糖协同转运蛋白2(sodiumglucose cotransporter 2,SGLT2)抑制剂类降糖药,第一个此类药物为卡格列净。SGLT2负责肾脏中葡萄糖的重吸收。通过抑制SGLT2,达格列净和卡格列净抑制葡萄糖的重吸收,增加葡萄糖排泄从而起到降血糖的作用。
和卡格列净一样,达格列净的临床适应症为配合饮食控制和运动改善2型糖尿病成人患者的血糖控制。临床研究显示,无论是卡格列净单药使用还是联用其他降糖药物(例如二甲双胍、格列美脲、格列吡嗪、吡咯列酮、西格列汀、胰岛素)都能有效降血糖。
服用达格列净不但可以降低空腹血糖 (fasting plasma glucose concentration,FPG)和糖化血红蛋白(HbA1c)浓度,还可降低部分患者的体重。在安慰剂对照试验中,患者服用达格列净5 mg/日和10 mg/日,其HbA1c<7%的比例分别为44%、51%,安慰剂为32%。与其他降糖药联合使用,HbA1c和FPG降低程度更好。达格列净用药24后体重降低平均1~3kg,而服用其他降糖药的患者则减重很少甚至增重。
不建议将达格列净用于1型糖尿病及酮症酸中毒患者。有0.3%的患者服用本品后会出现严重过敏反应,故严重过敏反应者应禁用。
因为达格列净和卡格列净都会升高血肌酐,降低肾小球滤过率(eGFR),老年患者和肾功能不全患者更容易受到影响。对于严重肾功能不全患者(eGFR<30 mL/min/1.73 m2),终末期肾病和进行透析的患者,禁用达格列净。开始治疗和治疗过程中,需对患者进行肾功能监测。患者的eGFR<60 mL/min/1.73 m2时不能启用达格列净,如果治疗过程中eGFR持续低于该值时也即停药。达格列净会引起血管内容积减少导致低血压反应。特别是老年患者、肾功能不全患者、低血压患者和服用利尿剂患者,使用前需要评估患者体液容量变化。
虽然达格列净不会引起低血糖反应,但当与胰岛素或者胰岛素增敏剂联用时,会增加低血糖风险。 所以,如果要联合用药,需减少胰岛素或者胰岛素增敏剂的剂量。
达格列净(10 mg/日)临床试验中最常见的不良事件包括女性生殖器霉菌感染(例如外阴道念珠菌感染)(7%)、鼻咽炎(6%)、尿路感染(4%)、尿频(4%)、后背疼痛(4%)、男性生殖器霉菌感染(3%)、恶心(3%)和血脂升高(3%)等。
在达格列净的22项临床试验中,共纳入6000名以上患者服用达格列净其中,发现10例(0.17%)新诊断膀胱癌,而近3500名安慰剂/对比药治疗患者中仅1例发病。尽管还没有充分的数据证明这些事件与使用达格列净有关或者达格列净是否会影响膀胱肿瘤。但是,不建议使用达格列净膀胱癌活动期患者,有膀胱癌史的患者也应慎用。FDA已经要求进行达格列净上市后膀胱癌风险的评估。
达格列净在妊娠期用药中归为C级,只有潜在获益胜过对胎儿潜在风险时才能在妊娠期使用。尚不知道达格列净能否在乳汁中分泌,因此哺乳期患者应停止哺乳或停用此药。18岁以下患者的疗效和安全性数据未知。
达格列净的口服生物利用度接近78%,与高脂肪餐同时服用不会显著影响它的生物利用度,可空腹服用。达格列净在体内经过尿苷二磷酸葡萄糖醛酸基转移酶UGT1A6代谢成无活性的葡萄糖醛酸代谢物。约75%的药物以代谢物的形式从尿中排出。中度肾功能不全患者服用达格列净不但血糖控制欠佳,而且会引起肾功能不良反应,应避免使用。对于重度肾功能不全患者,鉴于达格列净作用部位主要在肾脏,上述不良反应在所难免,也应禁用此药。对于肝功能不全患者,达格列净不需调整剂量。达格列净初始治疗剂量为每日早晨服用5 mg。如果患者能够耐受,且还需要进一步控制血糖,剂量可增至每日早晨10 mg。如果患者的eGFR持续降低,至低于60 mL/ min/1.73 m2应停药。达格列净薄膜衣片规格为5、10 mg。
恩格列净(empagliflozin,Jardiance-勃林格殷格翰制药,礼来制药)
恩格列净是一类新型的糖尿病口服治疗药物,是第3个获批的钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂。此前强生公司的卡格列净(canagliozin,InvokanaTM)和阿斯利康公司的达格列净(dapagliozin,FarxigaTM)先后于2013年和2014年初上市。肾脏每天要滤过160~180 g葡萄糖,几乎所有这些葡萄糖被重吸收后将重新回到血液循环中。主要表达于近端肾小管的SGLT2是参与这一过程的主要转动蛋白。恩格列净等SGLT2拮抗剂通过拮抗SGLT2,减少葡萄糖的重吸收,增加尿糖排泄从而降低血糖和HbA1c。像卡格列净和达格列净一样,恩格列净获批作为膳食控制和锻炼的辅助用药,每日一次,用于改善2型糖尿病成人患者的血糖。其临床使用包括单药治疗,联合二甲双胍、格列美脲、匹格列酮或胰岛素。
使用恩格列净可降低HbA1c、空腹血糖及部分患者的体重。在评价恩格列净单药(每日10 mg或25 mg两组)治疗疗效和安全性的安慰剂-对照研究中显示:第24周时,恩格列净每日10 mg剂量组、25 mg剂量组以及安慰剂组患者达到 HbA1c<7%的比例分别为35%、44%和12%,恩格列净组和安慰剂组分别平均降低体重3 kg和0.4 kg。联用恩格列净治疗组的HbA1c下降值、空腹血糖降低值,以及达到HbA1c<7%患者比例与恩格列净单用组的结果类似。
不建议将恩格列净用于1型糖尿病和糖尿病酮症酸中毒治疗。
同属于SGLT2抑制剂的恩格列净也有增加血浆肌酐浓度和降低肾小球滤过率(eGFR)的风险。老年及肾功能不全患者用此药的肾功能损害风险增加。严重肾损害患者(eGFR<30 mL/min/1.73 m2)、终末期肾病、透析患者禁用恩格列净。应在恩格列净治疗前后定期评价肾功能:eGFR<45 mL/min/1.73 m2不要使用恩格列净。卡格列净对肾损害患者也有类似建议,达格列净则建议eGFR<60 mL/min/1.73 m2就须禁用。
SGLT2抑制剂可致血管内容积收缩,由此可能发生低血压症状。在开始恩格列净治疗前,尤其是针对肾损患者、老年人、低收缩压患者及利尿剂使用患者,应评估患者的体液容量状态。虽然恩格列净不易引发低血糖,当它与胰岛素或胰岛素促分泌剂(如磺酰脲类)联用时,患者低血糖风险增加,此时应考虑降低这些降糖药的剂量。
恩格列净在临床研究阶段(单用恩格列净10 mg每日)常见的不良反应为尿路感染(9%)、女性霉菌性生殖器感染(如外阴阴道念珠菌病[5%])、血脂异常(如LDL-C增加[4%])、尿量增加(3%)、男性霉菌型生殖器感染(如龟头炎3%),以及上呼吸道感染(3%)。
达格列净的说明书提示此药有产生膀胱炎的风险;而恩格列净和卡格列净未见相关风险提示。
恩格列净归于药物孕期分类C级,除非用药获益大于对胎儿的风险,否则孕期不能使用。尚不知恩格列净是否经乳汁排泄,哺乳期使用须谨慎。尚未确定恩格列净在18岁以下未成年人群中的安全性和有效性。
食物对恩格列净的药代动力学影响不具有临床意义,故恩格列净的使用可不考虑食物的影响。恩格列净在人血浆主要经尿苷-二磷酸-葡萄糖醛酸转移酶(UGT)途径代谢为三个葡萄糖醛酸结合物(2-O-,3-O-,和6-O-葡萄糖醛酸),系统暴露量不到药物总量的10%。药物经尿、粪便排泄比例分别为55%、40%。药物在粪便中几乎全部以原型排泄,尿液中的原型药物约占一半。eGFR≥45 mL/min/ 1.73 m2的患者及肝损患者使用恩格列净无须调整剂量。
因SGLT2抑制剂增加尿糖排泄,可致糖尿测验呈假阳性。故服用SGLT2抑制剂患者不建议用尿糖检测监控血糖,应换其他方法。
恩格列净片有10 mg和25 mg两种规格。
阿必鲁肽(tanzeum-葛兰素史克公司)
阿必鲁肽是FDA批准的第三个胰高血糖素样肽(GLP-1)受体激动剂,此前先后上市的是艾塞那肽(exenatide,ByettaTM,百泌达TM)及其缓释剂(BydyreonTM)和利拉鲁肽(liraglutide,VictozaTM,诺和力TM)。GLP-1受体激动剂能促进葡萄糖依赖的胰岛素分泌,减慢胃排空,进而减少葡萄糖消耗,降低2型糖尿病患者的餐后血糖水平。阿必鲁肽是一种重组融合蛋白,由修饰后人源GLP-1(与人缘GLP-1序列片段7~36的同源性达到97%,仅第8位Ala由Gly取代)串联二聚体融合重组人血白蛋白组成。由于修饰后的GLP-1序列具有二肽基肽酶-4(dipeptidyl peptidase,DDP-4)抗性,对DDP-4的蛋白水解作用产生抗力,再加上重组人血白蛋白的空间位阻,可减缓GLP被DDP-4裂解为无活性的片段,延长半衰期至5天左右,从而能够每周给药1次实现药效。而同类药物利拉鲁肽和艾塞那肽则分别需要每天给药1次和2次。
阿必鲁肽获批每周1次皮下注射结合饮食控制与运动用于改善2型糖尿病成人患者血糖,可以单独使用或与现有治疗方案联合使用(包括二甲双胍、格列美脲、匹格列酮和/或胰岛素,但不含餐时胰岛素)。阿必鲁肽获批是基于Harmony项目的8项临床试验结果支持,共计纳入阿必鲁肽治疗者超2000例。研究显示,阿必鲁肽与安慰剂及阳性对照药物相比,达到了降低HbA1c水平的主要目标并可降低空腹血糖浓度(FPG)。阿必鲁肽与利拉鲁肽分别降低HbA1c为0.8%和1.0%,差别未能达到预设的非劣效性界值为0.3%。
阿必鲁肽的使用限制、警示及风险与其他GLP-1激动剂类似。阿必鲁肽不能用于1型糖尿病或糖尿病酮症酸中毒患者,也不建议作为饮食和锻炼控制不佳患者的一线治疗。尚未建立阿必鲁肽在严重胃肠道疾(如糖尿病胃轻瘫)患者中的研究数据,故不建议此类患者使用阿必鲁肽。临床报道GLP-1激动剂包括阿必鲁肽,偶见急性胰腺炎发生;故怀疑为胰腺炎时,应及时终止阿必鲁肽。未见胰腺炎史患者使用阿必鲁肽的资料,建议胰腺炎史患者选用其他降糖药。
GLP-1受体激动剂的临床前研究发现啮齿类动物用药后新发甲状腺C细胞瘤,包括甲状腺髓样癌(medullary thyroid carcinoma,MTC)的风险增加。尚不知阿必鲁肽在人体使用是否诱发上述肿瘤,但其说明书以黑框警示,禁止有MTC家族史患者及多发性内分泌肿瘤综合征2型患者使用阿必鲁肽。
阿必鲁肽常见不良反应为上呼吸道感染(14%)、腹泻(13%)、恶心(11%)和注射部位反应(11%)。曾报道1例患者出现严重过敏,一旦出现过敏应立即停药。
许多糖尿病患者使用降糖药(如磺酰脲类)体重增加。与此相反,使用GLP-1激动剂的患者体重多有下降。例如使用阿必鲁肽和利拉鲁肽的患者,用药32周较基线体重分别平均降低0.6 kg和2.2 kg。
阿必鲁肽在药物妊娠分级中为C级,除非临床获益大于对胎儿的风险,本药孕期禁用。由于阿必鲁肽的作用时间很长,故准备怀孕前应停止用药1月以上。18岁以下未成年人用药数据未见报道。
阿必鲁肽单用时不易发生低血糖。但联用胰岛素促分泌剂(如磺酰脲类)或胰岛素时,低血糖风险增加,此时应考虑降低联用降糖药的剂量。阿必鲁肽延缓胃排空,与其他药物同时口服可致吸收率及活性改变,尤其当这些药物存在口服吸收不完全或吸收过程高度不可控的情况则更需注意。
皮下注射阿必鲁肽3~5天到达血药峰浓度。阿必鲁肽的代谢是通过蛋白水解酶将其降解为多个小肽和氨基酸片段,消除时间约为5天,故适于每周给药1次。肾功能损坏患者无需调整药物剂量,但因阿必鲁肽发生胃肠道副反应(如恶心、呕吐、腹泻、脱水)较频繁,可能加剧肾功能损害。
阿必鲁肽的推荐剂量是30 mg每周1次,注射部位在腹部、大腿、上臂的皮下区域。如果血糖控制不佳,其剂量可提高至50 mg每次。如果3日内忘记给药,应尽快补上,然后恢复平时给药时间;如忘记给药超过3日,则患者需等至下次给定期给药时间再予单次剂量。
阿必鲁肽单剂注射笔内装冻干粉为30 mg或50 mg,应放冰箱冷藏(2~8℃)贮存。临用前可在室温(不超过30℃)保存4周。阿必鲁肽的重建和使用需见说明书要求。重建所用稀释液存于注射笔中,旋转注射笔上的透明盒至恰当位置使溶液与冻干粉充分混合。重建后,8 h内使用药物。
每周用药一次的艾塞那肽长效制剂也需要临用时重建;但艾塞那肽和利拉鲁肽普通剂都是预充注射剂,不需重建。
抗血小板药物
研究表明,抑制血小板聚集可以减少血栓性心血管事件(如心肌梗死、高危人群卒中)的发生。阿司匹林通过降低血栓素A2(thromboxane A2)的活性抑制血小板聚集;氯吡格雷、普拉格雷、替卡格雷则通过与血小板的二磷酸腺苷(ADP)受体P2Y12键合,抑制血小板激活和聚集。蛋白酶激活受体(Protease-activated receptors,PARs)尤其是PAR-1有助于血栓的形成。PAR-1对凝血酶亲和力高,主要分布在血小板,平滑肌细胞和内皮细胞上。
硫酸沃拉帕沙是一种选择性血小板PAR-1受体拮抗剂,适用于有心肌梗死(MI)或外周动脉疾病(PAD)史患者的降低心血管血栓风险。沃拉帕沙不仅能抑制凝血酶-诱导的血小板聚集,还能抑制凝血酶受体激动肽(TRAP)诱导的血小板聚集,是首个具有此类作用的药物。现有的临床研究主要比较了沃拉帕沙联用能否增加阿司匹林和/或氯吡格雷的疗效;而单独使用沃拉帕沙,或将其联合除阿司匹林、氯吡格雷以外药物的研究非常有限。
沃拉帕沙的有效性在一项超过2600名患者的多中心安慰剂对照试验(如沃拉帕沙或安慰剂+阿司匹林和/或氯吡格雷)中获证。主要复合终点包括心血管死亡、心肌梗死、脑卒中和急性冠脉综合征。关键的次要终点则包含除急性冠脉综合征以外的其他主要终点事件。在排除卒中和短暂性脑缺血(TIA)病史的患者中,3年期生存分析显示,沃拉帕沙和安慰剂出现主要终点事件的比率分别为10.1%、11.8%,出现次要终点事件的比例分别为7.9%和9.5%。
沃拉帕沙的主要危险因素是出血风险,约25%的患者有出血症状。1%的患者出现致命性出血、颅内出血(ICH),或需要进行干预的出血。故有卒中、短暂性脑缺血、颅内出血病史的患者禁用沃拉帕沙。活动病理性出血,如ICH或胃溃疡患者禁用沃拉帕沙。该风险已载于沃拉帕沙说明书中并标注黑框警示。
使用沃拉帕沙时如果出现严重出血,应立即停药。因沃拉帕沙半衰期较长,短时间的停药对于治疗出血效果不佳。停药后抑制血小板聚集的作用将持续大约4周时间。目前尚未见适合的方法来对抗沃拉帕沙的抗血小板作用。
应避免将沃拉帕沙与华法林或者与其他的抗凝血药同时使用。另有非甾体抗炎药、选择性5-羟色胺再摄取抑制剂(SSRIs)、5-羟色胺去甲肾上腺素再摄取抑制剂可能增加沃拉帕沙的出血风险。
沃拉帕沙在妊娠期用药中归为B级,只有潜在获益胜过对胎儿潜在风险时才能在妊娠期使用。尚不清楚沃拉帕沙能否经乳汁分泌,因此哺乳期患者可选择停药或停止哺乳。沃拉帕沙在儿童中的有效性和安全性尚未确立。
沃拉帕沙的口服生物利用度接近100%。它通过CYP3A4和CYP2J2代谢,约60%的药物通过粪便排泄。沃拉帕沙的有效半衰期为3~4天,表观终末清除半衰期为8天,对血小板的抑制作用具有剂量-浓度相关性,停药后作用持续4周以上。
肾功能不全和轻中度肝功能不全的患者不需要调整沃拉帕沙的剂量。因重度肝功能不全患者固有的出血风险,也不建议此类患者使用沃拉帕沙。
沃拉帕沙是CYP3A4酶的底物,故与CYP3A4酶抑制剂合用(例如克拉霉素、伊曲康唑)后作用增强;与CYP3A4诱导剂合用(例如卡马西平、利福平)后作用减弱。应避免沃拉帕沙与上述药物联合使用。
硫酸沃拉帕沙薄膜衣片含2.5 mg硫酸盐即2.08 mg沃拉帕沙。推荐每日一次,每次1片服药,是否与食物同服均可。
治疗非24小时睡眠障碍的药物
非24小时睡眠障碍即昼夜24小时节律紊乱,是完全失明患者的常见疾病。虽然大多数全盲患者仍然能够感知光亮得以正常入睡,但是美国仍有10万患者无法感知足够光亮来维持正常的夜间睡眠规律。他们或入睡困难或久睡不醒,或醒后困顿,难以建立或者遵循正常的作息,有人甚至黑白颠倒,昼睡夜醒。
褪黑素通过与下丘脑上的受体作用,影响睡眠和昼夜节律,是“人体生物钟”。褪黑素在晚上分泌,遇光则消退。虽然褪黑素在美国作为食物补充剂帮助睡眠,但是FDA还未批准将其用于临床。雷美替安(ramelteon)是美国上市的第一个褪黑素受体激动剂,用于治疗入睡困难型失眠。
他司美琼(tasimelteon,hetliozTM-Vanda公司)是非选择性褪黑素受体激动剂,它所激动的MT1、MT2这两个受体都与昼夜节律控制有关。他司美琼是首个获批治疗非24-小时睡眠觉醒障碍的药物,其疗效在两项安慰剂对照试验中确证,研究纳入的患者均为患有非24-小时睡眠觉醒疾病的盲人。服用他司美琼的患者与安慰剂组相比,夜间睡眠时间增加28 min,日间睡觉减少27 min。临床试验中,他司美琼没有与褪黑素和雷美替安进行比较。
他司美琼在临床试验中最常见的不良反应为头痛(17%)、噩梦(10%)、上呼吸道感染(7%)、尿路感染(7%)、谷丙转氨酶升高(10%)等。用药后还可见嗜睡,或注意力不能高度集中。
他司美琼在妊娠期用药中归为C级,只有潜在获益胜过对胎儿风险时才能在妊娠期使用。尚未知他司美琼在儿童中的有效性和安全性。
他司美琼与高脂食物同服时Cmax较空腹给药降低44%。因此,他司美琼不能与食物同服。他司美琼主要通过CYP1A2和CYP3A4代谢,近80%的药物以代谢物的形式从尿液中排出。肾功能不全、轻中度肝功能不全患者不需要调整剂量。重度肝功能不全患者没有相关资料,不建议使用。
同时使用氟伏沙明或者其他CYP1A2抑制剂会显著增加他司美琼的暴露和活性,应避免联合使用。强CYP3A4诱导剂如利福平会显著降低他司美琼的活性,避免使用。吸烟会诱导CYP1A2代谢,他司美琼在吸烟人群中疗效低于不吸烟患者。
他司美琼的推荐剂量为20 mg,每夜睡前相同时间点服用,不与食物同服。服药后应限制患者活动并准备睡觉。因为昼夜节律中的个体差异,可能在服药数周或数月后起效。他司美琼胶囊规格为20 mg。
继续教育编号:2015-01-01-3-3-J发布日期:2015-02-25截止日期:2016-02-25学 分:1分(3学时)
资质证明:《药学与临床研究》是经江苏省卫生厅下属江苏省继续医学教育委员会认证通过的继续教育服务提供机构。
活动方式:将问题页剪下后答题,复印无效(累计5期答题页一并寄回编辑部,可授予Ⅱ类学分证书5分)
利益关系声明依照江苏省药学会和《药学与临床研究》继续教育委员会的商业支持标准,任何参与学术教育或公益活动的内容提供者都应披露与其相关商业支持的财务关系。本活动内容提供者个人或其亲属在过去12个月与商业支持无任何利益关系。
