冬虫夏草、虫草菌丝体及蛹虫草中核苷类成分的测定
2015-03-02梅雪艳李媛媛沈于兰江苏省无锡药品检验所无锡408江南大学无锡
梅雪艳,李媛媛,沈于兰江苏省无锡药品检验所,无锡 408;江南大学,无锡 4
冬虫夏草、虫草菌丝体及蛹虫草中核苷类成分的测定
梅雪艳1,李媛媛2,沈于兰1
1江苏省无锡药品检验所,无锡 214028;2江南大学,无锡 214122
目的:建立高效液相色谱法定量测定冬虫夏草、虫草菌丝体及蛹虫草中的腺嘌呤、腺苷、虫草素的含量,为冬虫夏草及其代用品的质量研究及开发利用提供科学依据。方法:采用资生堂MG Ⅱ C18(4.6 mm×250 mm,5 μm)色谱柱,以乙腈-水梯度洗脱,检测波长为260 nm,流速1.0 mL·min-1,外标法定量测定。结果:腺嘌呤、腺苷、虫草素分别在0.001239~0.3098 mg· mL-1、0.001241~0.3102 mg·mL-1、0.000813~0.2032 mg·mL-1范围内与峰面积呈良好的线性关系(r=0.9999);平均回收率(n=3)分别为97.9%、97.0%、95.8%。结论:本法简便准确,灵敏度高,通用性好,适用于冬虫夏草及其代用品中腺嘌呤、腺苷、虫草素的定量测定。
冬虫夏草;腺嘌呤;腺苷;虫草素;高效液相色谱法
冬虫夏草为麦角菌科真菌冬虫夏草Cordyceps sinensis(Berk.)Sacc.寄生在蝙蝠蛾科昆虫幼虫上的子座及幼虫尸体的复合体[1],具有补益功效,有免疫调节、抗肿瘤、降血糖、抗氧化等多种药理作用[2]。冬虫夏草主要主产于我国青藏高原海拔3000~5000 m的高寒地带,生长条件苛刻,导致资源有限。故市场上出现众多冬虫夏草替代品,其可分为两种:一种是利用从冬虫夏草中分离的不同菌种经深层发酵培养而成的虫草菌丝体[3];一种为半人工培养,将虫草菌接种于蚕蛹等虫体后,在适宜的环境条件下,使其长出同野生冬虫夏草形态近似的子实体[4]。核苷类成分为冬虫夏草及其代用品中的主要成分,有抗肿瘤、调节机体免疫力等药理活性。
文献报道,测定冬虫夏草中核苷类成分的方法主要有高效液相色谱法[4]、毛细管电泳法[5]和液质联用法[6],现有文献中多只选择核苷类成分中腺苷和虫草素为质控指标进行评估。本文建立了HPLC法测定冬虫夏草及其替代品中核苷类成分的含量,采用简单的梯度洗脱系统同时分离并定量测定腺苷、腺嘌呤,虫草素三个成分(腺嘌呤为核苷类成分的重要组成,且其在冬虫夏草及其替代品中含量差异较大,可作为区分依据,故本文增加了测定腺嘌呤这一成分)。该方法通用性好,简便准确,分离时间快于文献报道的方法。同时选择了天然冬虫夏草、虫草菌丝体及蛹虫草作为检测对象,并对检测结果进行了系统的分析,可为冬虫夏草及其代用品的质量研究及开发利用提供科学依据。
1 仪器与试药
1.1仪器
梅特勒电子天平AG-285、XP-6电子天平;Agilent 1200高效液相色谱仪系统。
1.2 试药
腺苷、腺嘌呤、虫草素对照品购自中国食品药品检定研究院,批号 110879-200202、110886-201102、110858-200202;冬虫夏草购自中国食品药品检定研究院(批号121201-201103);虫草菌丝体胶囊(均为药品,厂家A批号:LF12004,厂家B批号:121147,厂家C批号:121146);蛹虫草由江苏省蚕桑研究所提供。
乙腈为色谱醇,其它试剂为分析纯;水为二次纯化水。
2 方法与结果
2.1 色谱条件
色谱柱为资生堂MGⅡ C18(4.6 mm×250 mm,5 μm);以乙腈-水为流动相、梯度洗脱(洗脱程序见表1);检测波长:260 nm;流速:1.0 mL·min-1;进样量:10 μL;柱温:35℃。

表1 流动相梯度洗脱程序
2.2 溶液的制备
2.2.1 对照品溶液 精密称取腺苷、腺嘌呤、虫草素对照品各5 mg于10 mL量瓶中,加20%甲醇溶解并稀释至刻度,摇匀,作为对照品储备液。
2.2.2 供试品溶液 取样品粉末 (过2号筛)0.5 g,精密称定,置10 mL量瓶中,加20%甲醇约8 mL,超声处理30 min,加20%甲醇至刻度,摇匀,滤过,为续滤液,即得。
2.3 专属性实验
在“2.1”项色谱条件下,腺嘌呤、腺苷、虫草素峰形良好,保留时间分别为16.9、24.6、25.8 min(见图1),分离度均大于1.5,样品中杂质不干扰样品测定。

图1 (A)腺苷、腺嘌呤、虫草素对照品溶液色谱图;(B)冬虫夏草正品供试品溶液色谱图;(C)蛹虫草供试品溶液色谱图;(D)人工虫草菌丝体供试品溶液色谱图
2.4 标准曲线及线性范围
精密量取腺苷、腺嘌呤、虫草素对照品储备液,用20%甲醇经适当比例稀释,分别配成310.2、155.1、31.02、6.204、1.241 μg·mL-1(腺苷);309.8、154.9、30.98、6.196、1.239 μg·mL-1(腺嘌呤);203.2、 101.6、20.32、4.064、0.8130 μg·mL-1(虫草素)的对照品溶液。按“2.1”项下色谱条件进行测定,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线,分别得回归方程为:A=32678.32C+11.90,r=0.9999(腺苷);A=56730.43C+13.47,r=0.9999(腺嘌呤);A=34496.00C-9.42,r=0.9999(虫草素)。腺苷、腺嘌呤、虫草素在上述浓度范围内线性关系均良好。
2.5 精密度实验
精密吸取腺苷、腺嘌呤、虫草素对照品混合溶液,按照“2.1”项下色谱条件连续进样5次,测定峰面积,结果腺苷RSD为0.3%,腺嘌呤RSD为0.9%,虫草素RSD为0.4%。
2.6 重复性实验
取同一份的样品5份,按“2.2.2”项下方法制备供试品溶液,依法测定,腺苷的含量RSD为1.3%;腺嘌呤的含量RSD为1.3%;虫草素的含量RSD为0.9%。
2.7 稳定性实验
取供试品溶液,室温放置,分别在0、2、4、6、8 h进样,依法测定,记录峰面积,结果5次进样测定腺苷峰面积RSD为0.4%,腺嘌呤峰面积RSD为0.6%,虫草素峰面积RSD为0.8%,结果表明,供试品溶液在8 h内稳定。
2.8 加样回收率实验
取同一批蛹虫草样品(腺嘌呤含量0.093 mg·g-1,腺苷1.126 mg·g-1,虫草素1.754 mg·g-1)9份,每份0.25 g,精密称定,3份为一组,分别精密加入腺嘌呤浓度为0.02519 mg·mL-1,腺苷浓度为0.3002 mg· mL-1,虫草素浓度为0.4521 mg·mL-1的混合对照品溶液0.5、1、2 mL。按照“2.2.2”项下方法制备供试品溶液,以“2.1”项下色谱条件测定,计算加样回收率。腺嘌呤的平均加样回收率为97.68%;腺苷平均加样回收率为96.95%;虫草素的平均加样回收率为95.76%。
2.9 样品测定
取冬虫夏草及其代用品各2份,分别按照“2.2.2”项下方法制备供试品溶液,精密吸取对照品溶液与供试品溶液各10 μL,注入高效液相色谱仪,按照“2.1”项下色谱条件测定色谱峰面积,以外标法计算腺嘌呤、腺苷、虫草素的含量,结果见表2。
3 讨 论
3.1 实验中选择甲醇-水、乙腈-水进行等度、梯度洗脱,结果表明当使用乙腈-水系统进行梯度洗脱时,腺嘌呤、腺苷、虫草素峰型良好,三个主峰以及供试品中主峰与杂质峰能得到基线分离,故选用乙腈-水系统进行梯度洗脱。梯度程序0~10 min使用100%水洗脱供试品中极性较大的杂质干扰,10.1~19 min使用3%的乙腈洗脱腺嘌呤成分,19.1~29 min使用8%的乙腈洗脱腺苷及虫草素。
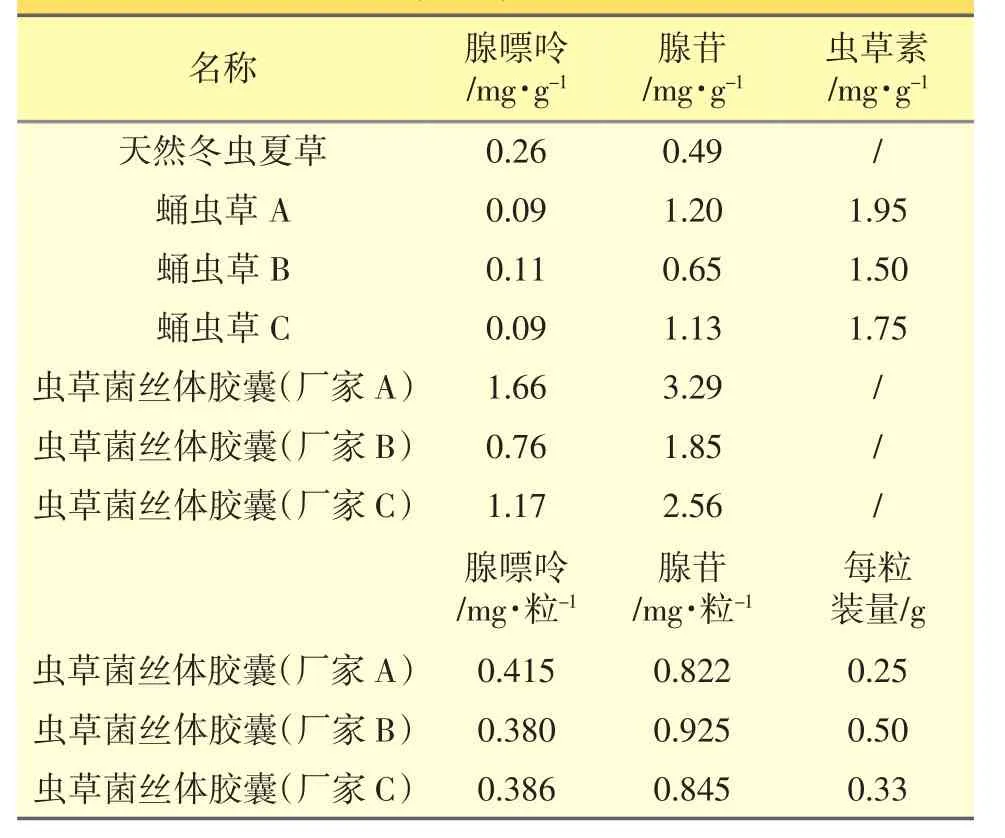
表2 腺嘌呤、腺苷、虫草素的含量测定
3.2 从表2看出,冬虫夏草、虫草菌丝体和蛹虫草中,腺嘌呤的含量依次为虫草菌丝体、冬虫夏草、蛹虫草;腺苷的含量依次为虫草菌丝体、蛹虫草、冬虫夏草;而虫草素只在蛹虫草中被测出,冬虫夏草和虫草菌丝体中均未测得,与文献报道情况相符[4,6]。可见冬虫夏草和蛹虫草、虫草人工菌丝体在核苷类成分构成比例上存在差异,而虫草素为蛹虫草中较特有的成分。
虫草菌丝体胶囊(厂家A)为麦角菌科真菌虫草头孢(Cephalospovium sinens is Chen.sp.nov)经液体深层发酵所得菌丝体的干燥粉末制成的胶囊;虫草菌丝体胶囊(厂家B)为发酵冬虫夏草菌粉[Cs-CQ80中华被毛孢 Hirsutella sinensis Liu,Guo,Yu-et Zeng(1989)经液体深层发酵所得菌丝体的干燥粉末]制成的胶囊;虫草菌丝体胶囊(厂家C)为发酵虫草菌粉(Cs-4)的干燥粉末制成的胶囊。三种虫草菌丝体的来源菌株不同,因此所含腺嘌呤和腺苷的百分含量及比例也不相同。但厂家根据其不同虫草菌丝体胶囊中核苷类成分量的不同,制定了不同的装量。从表2看出,当折算到每粒含量时,厂家A、B、C的腺嘌呤、腺苷含量基本持平。
[1] 国家药典委员会.中华人民共和国药典 (一部)[S].北京:北京化学工业出版社,2010:106.
[2] 梁宗琦.中国真菌志,第32卷虫草属[M].北京:科技出版社,2007.
[3] 王尊生,俞永信,袁勤生.虫草属真菌的生物活性成分[J].中草药,2004,35(10):附8-11.
[4] 代君君,范 涛,吴传华,等.人工栽培蛹虫草研究的概述[J].安徽农业科学,2007,35(18):5469-71.
[5] Li SP,Li P,Ji H,et al.The contents and their change of nucleosides from natrual cordyceps sinensis and cultured cordyceps mycelia[J].Acta Pharm Sin, 2001,36(6):436-9.
[6] 杨 钊,迟少云,张春辉,等.冬虫夏草及其代用品中腺苷和虫草素的LC-MS-MS定量分析研究 [J].中国中药杂志,2007,32(19):2018-20.
SimultaneousDetermination ofAdenine Adenosine and Cordycepin in Cordyceps sinensis and Its Substitutes
MEI Xue-yan1,LI Yuan-yuan2,SHEN Yu-lan1
1Wuxi Institute for Drug Control of Jiangsu Province,Wuxi 214028;2Jiangnan University,Wuxi 214122
Objective:To establish an HPLC method for simultaneous determination of adenine,adenosine and cordycepin in Cordyceps sinensis and similar products.Methods:A SHISEIDO MGⅡ C18(4.6 mm×250 mm,5 μm)was used as the analytical column and the mobile phase was acetonitrile-water for gradient elution at a flow rate of 1.0 mL·min-1.The UV detection wavelength was set at 260 nm.Results:Linear calibration curves were obtained in the concentration ranges of 0.001239~0.3098 mg·mL-1(adenine), 0.001241~0.3102 mg·mL-1(adenosine)and 0.000813~0.2032 mg·mL-1(cordycepin)(r=0.9999);The average recoveries (n=3)of adenine,adenosine and cordycepin were 97.9%,97.0%and 95.8%.Conclusion:The method is simple,rapid and reliable for the determination of adenine,adenosine and cordycepin in Cordyceps sinensis and similar products.
Cordyceps sinensi;Adenine;Adenosine;Cordycepin;HPLC
R927.2
A
1673-7806(2015)01-027-03
梅雪艳,女,高级工程师,主要从事药品监管及药物分析研究 E-mail:mxy6036@163.com
2014-06-26
2014-08-14
