人参皂甙Rgl体外抑制人骨肉瘤肿瘤干细胞增殖的研究
2015-02-28徐子彧杜心如
徐子彧 杜心如 骆 辉
人参皂甙Rgl体外抑制人骨肉瘤肿瘤干细胞增殖的研究
徐子彧 杜心如 骆 辉
目的探讨人参皂苷Rg1体外抑制人骨肉瘤肿瘤干细胞的作用。方法体外培养MG-63人骨肉瘤细胞,镜下观察并行CD133免疫荧光染色;实验分为生理盐水组、20 μg/mL人参皂苷Rg1组和40 μg/mL人参皂苷Rg1组;采用四唑盐比色法(MTT)检测人参皂苷Rg1对人骨肉瘤肿瘤干细胞增殖抑制作用;DAPI核染检测人参皂苷Rg1诱导人骨肉瘤肿瘤干细胞凋亡,并分析细胞的光密度和面密度变化。结果培养MG-63人骨肉瘤细胞CD133呈阳性反应; MTT法实验结果显示:20 μg/mL和40 μg/mL人参皂苷Rg1对人骨肉瘤肿瘤干细胞的抑制率分别为23.47%和41.84%,明显低于生理盐水组(P<0.05,P<0.01);DAPI核染检测结果显示:与生理盐水组比较,人参皂苷Rg1组人骨肉瘤肿瘤干细胞的光密度和面密度值均明显减小,差异有统计学意义(P<0.01)。结论人参皂苷Rg1对人骨肉瘤肿瘤干细胞的增殖具有抑制作用。
人参皂苷Rg1;骨肉瘤;肿瘤干细胞;增殖
(The Practical Journal of Cancer,2015,30:799~802)
骨肉瘤是骨骼系统常见的骨原发恶性肿瘤,以青少年多见,由于早期诊断难度大,因此,该病的转移率和病死率较高;近年来,手术技术的进展和新辅助化疗的应用提高了骨肉瘤患者的5年之内生存率;然而,受骨肉瘤细胞耐药和免疫逃逸影响,骨肉瘤的病死率仍居高不下[1]。
近年研究发现,人骨肉瘤细胞中存在小部分与正常干细胞相似的自我更新和分化能力的细胞,即骨肉瘤肿瘤干细胞[2]。依据肿瘤干细胞的生物学特性,目前的治疗技术未能将将这部分细胞完全清除;但这小部分细胞的存在,能够继续自我更新,不断增殖和分化形成新的肿瘤细胞和组织,从而转移和复发[3]。因此,针对性地抑制这些细胞的增殖具有重要的临床意义。人参皂苷是人参的主要活性成分,人参皂苷Rg1对人骨肉瘤肿瘤细胞的抑制作用已得到研究证实[4-5],但关于人参皂苷Rg1对人骨肉瘤中肿瘤干细胞的作用少见报告。
1 材料与方法
1.1 材料
MG-63人骨肉瘤细胞由上海远慕生物科技有限公司提供;人参皂苷(纯度95%)购于南京安培化工科技有限公司;DMEM/F12培养基购于Gibco公司;胎牛血清由杭州四季青公司生产;胰蛋白酶,多聚赖氨酸,碱性成纤维细胞生长因子,表皮生长因子,溴化二甲噻唑二苯四氮唑蓝(MTT)和二甲基亚砜均为Sigma公司产品;胰蛋白酶,L--谷氨酰胺,DAPI和山羊血清购于博士德生物工程有限公司;兔抗人CD133单克隆抗体购于上海钰博生物科技有限公司;山羊抗兔Cy3-IgG荧光二抗为美国Invitorgen生物技术公司提供;酶标仪AD340型为美国Beckman Coulter公司产品;IX70-S8F型倒置相差显微镜购自日本OLYMPUS公司。
1.2 实验方法
1.2.1 人骨肉瘤细胞培养[6]取人骨肉瘤细胞株,胰蛋白酶消化约5 min,胎牛血清液终止消化,吹打成单细胞悬液,1 000 r/min离心5 min,弃上清,用无血清DMEM/F12培养液(含L-谷氨酰胺2 mmol/L、胰岛素4 U/L、表皮生长因子20 μg/L、碱性成纤维细胞生长因子20 μg/L和青霉素100 U/mL)重悬细胞,将细胞终浓度调整为5×106L-1,在37℃、5%CO2的饱和湿度培养箱中培养,此后每2 d换液1次,连续培养7 d;在细胞对数生长期大约80%时,用0.25 mL/L胰酶消化、离心,用无血清培养基重新吹打成单细胞悬液,按1∶2比例传代,再接种于培养孔板进行培养,然后进行相应实验检测。
1.2.2 CD133免疫荧光染色[7]细胞采用4%多聚甲醛固定30 min,用含有山羊血清和TritonX-100的封闭液孵育1 h,PBS漂洗,然后进行一抗兔抗人CD133单克隆抗体混合液(含有山羊血清和TritonX-100)处理24 h,漂洗后进行二抗山羊抗兔Cy3-IgG荧光处理,漂洗,防淬灭荧光剂进行封片,镜下摄像。
1.2.3 实验分组 将培养的CD133阳性细胞球按1 ×106个接种于96孔板,采取随机法分为3组:生理盐水组,20 μg/mL人参皂苷Rg1组和40 μg/mL人参皂苷Rg1组。分别给予生理盐水、人参皂苷Rg1进行干预;1次/d,3组均干预2周,再进行相关实验检测。
1.2.4 MTT检测[8]在细胞终止培养前4 h,将20 μl的MTT溶液加入孔板细胞中,继续培养4 h,二甲基亚砜振荡溶解,摇床混匀10 min,采取全自动酶标仪在波长为490 nm下测定细胞的吸光度值(OD值)。细胞抑制率(%)=[(对照组OD值-治疗组OD值)/对照组OD值]×100%。
1.2.5 CD133阳性细胞凋亡检测 采用细胞核(DAPI)染法检测,具体方法为:吸弃培养板内液体,每孔加入100 μL DAPI(1∶2000),室温孵育5 min,漂洗3次,镜下观察和拍照。细胞凋亡分析采取CMIAS-II多功能真彩病理图像分析系统进行分析,每组随机选10张图片,每张图片随机选10个视野,测量计算所识别的光密度和面密度,分别取两者平均值进行分析。
1.3 统计学方法
应用SPSS 17.0软件对所得数据进行分析,以¯x± s表示计量资料,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 人骨肉瘤CD133+细胞的培养与鉴定
培养3 d后大部分细胞聚集生长,有成团趋势,少数细胞发出突起,细胞有较好的折光性,类似干细胞球;免疫荧光检测显示:干细胞表面标志CD133在人骨肉瘤类肿瘤干细胞中呈阳性表达。
2.2 人参皂苷Rg1抑制人骨肉瘤肿瘤干细胞增殖
MTT法实验结果显示:人参皂苷Rg1干预后细胞的增殖抑制明显,OD值分别为0.75±0.26和0.57± 0.31;20 μg/mL人参皂苷Rg1对人骨肉瘤肿瘤干细胞的抑制率为23.47%,显著低于生理盐水组(P<0.05);40 μg/mL人参皂苷Rg1组的抑制率为41.84%,极明显低于生理盐水组(P<0.01),见表1。
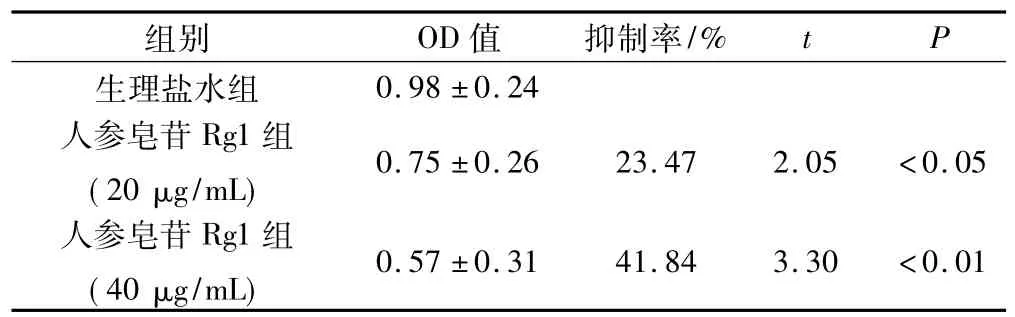
表1 人参皂苷Rg1对人骨肉瘤细胞增殖抑制作用(¯x±s,n=10)
2.3 人参皂苷Rg1诱导人骨肉瘤肿瘤干细胞凋亡
DAPI核染检测结果显示:与生理盐水组比较,人参皂苷Rg1干预后人骨肉瘤肿瘤干细胞的DAPI染色显著减弱,见图1。图像分析发现,与生理盐水组比较,人参皂苷Rg1组人骨肉瘤肿瘤干细胞的光密度和面密度值均明显减小,差异有统计学意义(P<0.01),见表2。

图1 人骨肉瘤肿瘤干细胞DAPI染色A为20 μg/mL人参皂苷Rg1组;B为40 μg/mL人参皂苷Rg1组;C为生理盐水组。

表2 人参皂苷Rg1诱导人骨肉瘤肿瘤干细胞凋亡(¯x±s,n=10)
3 讨论
肿瘤干细胞首次分离是来自于人类白血病,此后从乳腺癌、肺癌、脑肿瘤和前列腺癌等肿瘤中也陆续分离出肿瘤干细胞[9]。从人骨肉瘤中分离肿瘤干细胞是在2005年Parker Gibbs等利用去血清悬浮培养法分离得到[10]。这些细胞具有较强的自我更新能力,并能够不断增殖、分化,形成新的肿瘤细胞[10]。实验检测显示,骨肉瘤细胞主要表达间充质干细胞特有的表面标志物。目前发现的骨肉瘤肿瘤干细胞的表面标志物有CD133、CD24、Stro-1和CD90等[11]。在本研究中,参照以往培养方案获得人骨肉瘤肿瘤干细胞,镜下大部分细胞聚集生长,有成团趋势,少数细胞发出突起,细胞有较好的折光性,类似干细胞球;免疫荧光检测发现干细胞表面标志CD133在人骨肉瘤类肿瘤干细胞中呈阳性表达;因此,在本研究中得到较好特性的人骨肉瘤肿瘤干细胞。
人参皂苷是人参的主要成分之一,对心血管系统、神经系统和免疫系统均发挥了重要调节作用;人参皂苷可通过阻止细胞增殖周期的G0/G1期或诱导细胞死亡的作用机制抑制肿瘤细胞的增殖[5]。近年研究发现,人参皂苷Rg1具有较强的离体和整体抗肿瘤作用[12],且对人成骨肉瘤MG-63细胞的增殖具有抑制和诱导分化作用[4]。然而,人参皂苷Rg1对人骨肉瘤肿瘤干细胞的增殖是否具有抑制作用尚待阐明。
本研究采取常规人骨肉瘤细胞培养方法,结合前期实验结果,采用低、高溶度人参皂苷Rg1分别干预培养的CD133阳性细胞,进行MTT检测和DAPI核染色,分别对人参皂苷Rg1干预效果进行分析。MTT法实验结果显示:人参皂苷Rg1干预后人骨肉瘤CD133阳性细胞的增殖明显被抑制,与生理盐水组比较,差异有统计学意义(P<0.01)。DAPI核染检测结果显示:人参皂苷Rg1能明显诱导人骨肉瘤CD133阳性细胞凋亡,与生理盐水组比较,人参皂苷Rg1组人骨肉瘤CD133阳性细胞的光密度和面密度值均明显减少(P<0.01)。以上结果均提示,人参皂苷Rg1对体外培养人骨肉瘤肿瘤干细胞的增殖具有显著的抑制作用,结合以往人参皂苷Rg2抗肿瘤或骨肉瘤的作用,其作用机制可能与本研究结果有关。
总之,肿瘤干细胞的发现为人骨肉瘤的临床治疗指明了新的方向,人参皂苷Rg1抑制人骨肉瘤肿瘤干细胞增殖作用为临床治疗带来了新的希望。然而,对肿瘤干细胞的认识目前仍处于初步阶段,包括细胞分离培养、增殖信号通路和细胞微环境作用等也尚不明确[12]。本研究仅仅从体外细胞培养角度,结合中药人参皂苷Rg1的作用进行了探讨。下一步本课题准备建立人肉瘤肿瘤干细胞动物模型,从在体水平探讨人参皂苷Rg1对肿瘤及其干细胞的作用。
[1]Kansara M,Teng MW,Smyth MJ,et al.Translational biology of osteosarcoma〔J〕.Nat Rev Cancer,2014,14(11): 722-735.
[2]Poletajew S,Fus L,Wasiutyński A.Current concepts on pathogenesis and biology of metastatic osteosarcoma tumors〔J〕.Ortop Traumatol Rehabil,2011,13(6):537-545.
[3]Basu-Roy U,Basilico C,Mansukhani A.Perspectives on cancer stem cells in osteosarcoma〔J〕.Cancer Lett,2013,338(1):158-167.
[4]石松林,李祺福,刘庆榕,等.人参皂苷Rgl组合诱导人成骨肉瘤MG-63细胞分化过程中Prohibitin的表达与定位变化〔J〕.中国生物化学与分子生物学报,2008,24 (2):180-187.
[5]张有为,窦德强,陈英杰,等.人参皂苷对人体骨肉瘤细胞QRST增殖的影响〔J〕.中草药,2001,32(3):232-236.
[6]欧阳振,王栓科,康学文,等.人骨肉瘤细胞株中类肿瘤干细胞的分离培养及鉴定〔J〕.肿瘤2008,28(1):36-39.
[7]宫晨,郭风劲,秦亮,等.LY294002抑制PI3K/Akt通路对人骨肉瘤类肿瘤干细胞增殖的影响〔J〕.中华实验外科杂志,2011,28(12):2215-2217.
[8]Chistiakova IA,Polianskaia GG.Influence of human fetalmesenchymal stem cells on glioma cell proliferation.A consequence of cellular crosstalk〔J〕.Tsitologiia,2014,56 (11):800-808.
[9]Karlic H,Herrmann H,Schulenburg A,et al.stem cell research-basis and challenge for diagnosis and therapy〔J〕.Wien Klin Wochenschr,2010,122(13-14):423-436.
[10]Parker Gibbs C,Kukekov VG,Reith JD,et al.Slem-like cells in bone sarcomas:implications for tumorigenesis〔J〕.Neoplasia,2005,11(7):967-976.
[11]流小舟,黎承军,吴苏稼.肿瘤干细胞与骨肉瘤关系的研究进展〔J〕.江苏医药,2014,40(6):701-703.
[12]郭洪章,王栓科,康学文,等.肿瘤干细胞与骨肉瘤相关研究进展〔J〕.国际骨科学杂志,2006,27(5):269-272.
Inhibitory Effect of Ginsenoside Rg1 on Proliferation of Human Osteosarcoma Cancer Stem Cells in Vitro
XU Ziyu,DU Xinru,LUO Hui.Beijing Chaoyang Hospital,Beijing,100020
ObjectiveTo investigate the inhibitory role of ginsenoside Rg1 on proliferation of human osteosarcoma cancer stem cells in vitro.MethodsMG-63 human osteosarcoma cell were cultured in vitro,then observed under the microscope and received CD133 immunofluorescence staining.The study was divided into normal saline water group,20 μg/mL ginsenoside Rg1 group and 40 μg/mL ginsenoside Rg1 group.Inhibitory effect of ginsenoside Rg1 on proliferation of cancer stem cells of human osteosarcoma cells in vitro was detected by MTT colorimetric method.Induction of apoptosis of ginsenoside Rg1 on proliferation of cancer stem cells of human osteosarcoma cells in vitro was measured by DAPI staining method,optical density and area density were analysed.ResultsMG-63 human osteosarcoma cell cultured in vitro were CD133+positive.MTT assay showed that inhibitory rates of 20 μg/mL and 40 μg/mL ginsenoside Rg1 were 23.47%and 41.84%,respectively,which were obviously lower than that of normal saline group(P<0.05,P<0.01).DAPI staining method showed that compared with normal saline water group,optical density and area density of cancer stem cells of human osteosarcoma cells in vitro remarkably decreased,there had statistical difference(P<0.01).ConclusionGinsenoside Rg1 can inhibit the proliferation of cancer stem cells of human osteosarcoma cells in vitro.
Ginsenoside Rg1;Osteosarcoma;Cancer stem cells;Proliferation
10.3969/j.issn.1001-5930.2015.06.003
R738.1
:A
:1001-5930(2015)06-0799-04
2015-04-20
2015-04-28)
(编辑:吴小红)
100020北京朝阳医院骨科
