胃癌中TGFβ1和Smad7 mRNA的表达及临床意义*
2015-02-28张德利李春辉
张德利, 马 艳, 李春辉
(承德医学院附属医院麻醉科, 河北 承德 067000)
胃癌的发生是一个多因素、多步骤的过程,涉及到多方面机制。研究表明转化生长因子 β(TGFβ)/Smads信号通路中任何一个环节出现异常都可能导致信号转导的紊乱,从而导致胃癌的发生与发展。本研究通过检测正常胃组织和胃癌中TGFβ1、Smad7基因以及蛋白的表达,分析它们与胃癌分化程度、淋巴结转移的关系。
1 资料与方法
1.1 研究对象:收集我院2011年12月至2012年9月手术治疗后经病理证实的胃癌组织标本60例,同时收集正常胃组织20例(切缘距离肿瘤边缘10cm以上认为正常胃组织)。60例胃癌患者中,男性38例,女性22例;年龄43-77岁,平均年龄54.8±9.7岁;其中低分化者32例,高中分化者28例;有淋巴结转移者35例,无淋巴结转移者25例。
1.2 RT-PCR所用试剂:AMV第一链cDNA合成试剂盒(BK1040)(上海生工生物工程技术服务有限公司);引物合成(上海生工生物工程技术服务有限公司);50bp DNA Ladder(北京天根生化有限公司MD108);肌动蛋白(β-actin)上游引物序列:5'-CAT GTA CGT TGC TAT CCA GGC -3',下游引物序列:5'-CTCCTTAATGTCACGCACGAT-3'。TGF 1上游引物序列:5'-GGCCAGATCCTGTCCAAGC-3',下游引物序列:5'-GTGGGTTTCCACCATTAGCAC-3'。Smad7上游引物序列:5’-TTCCTCCGCTGAAACAGGG-3’,下游引物序列:5’-CCTCCCAGTATGCCACCAC -3’。
1.3 方 法
1.3.1 提取RNA及RNA定量:①充分预冷研钵,把组织从液氮罐中取出放入研钵中仔细研磨,控制每例标本质量100mg左右,研磨成粉末状后,加Trizol试剂1mL,将其击成碎块,至1.5mLEP管中,混匀室温静置5min,4℃,离心12000rpm10min,将上清移入新EP管。
1.3.2 反转录:反转录过程:1μg总RNA为模板逆转录成cDNA,反转录反应条件为:25℃,10min;37℃,50min;70℃,15min;4℃,5min。反转录反应体系见表1。

表1 反转录体系
1.3.3 聚合酶链反应
1.3.3.1 PCR 扩增反应体系,见表 2。

表2 PCR扩增反应体系
1.3.3.2 循环设置:①TGF 1扩增条件:94℃预变性5min,一个循环;94℃ 变性 30s,55℃ 退火 30s,72℃ 延伸30s,共35个循环;72℃总延伸6min。②Smad7扩增条件:94℃预变性5min,一个循环;94℃变性30s,53℃退火45s,72℃延伸 30s,共 30个循环;72℃总延伸6min。③琼脂糖凝胶电泳结果分析:取20μL扩增产物及6μL的DNA Ladder进行2%琼脂糖凝胶电泳(120V,45min),紫外荧光数字成像仪下照像,采用Image pro plus 7.0软件统计各条带的积分光密度值,以积分光密度值比值分析各组间差异。
1.4 统计学分析:采用SPSS17.0统计软件,计量资料用均数±标准差(±s)表示,组间比较用方差分析,以P<0.05为差异有显著性。
2 结果
在胃癌组织中,TGFβ1,Smad7 mRNA的表达明显高于对照组(P<0.05),低分化胃癌组织中TGFβ1和Smad7 mRNA水平明显高于高中分化胃癌组织(P<0.05)。TGFβ1,Smad7 mRNA的表达与胃癌的分化程度有关(图1)。见表3。
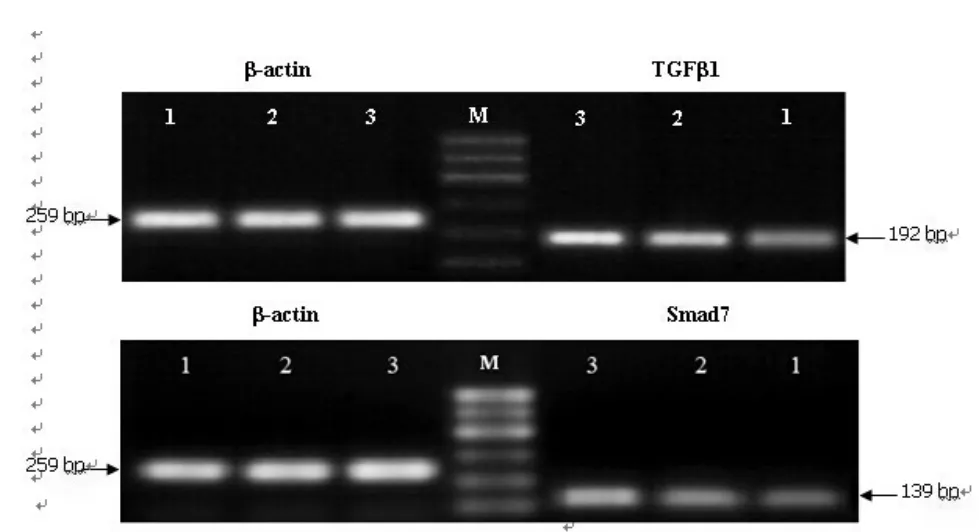
图1 TGFβ1、Smad7 mRNA在各组织中的表达(±s,n=6)M:100 bp DNA Marker;1:正常胃癌组织;2:高中分化胃癌组织;3:低分化胃癌组织

表3 TGFβ1 mRNA、smad7 mRNA水平的表达在不同临床病理特征中的关系
3 讨论
TGFβ是重要的细胞因子之一,对细胞分裂和增殖具有抑制作用。研究结果显示,恶性细胞对TGFβ产生抵抗作用与肿瘤的发生关系密切,TGFβ信号通路一旦改变,对靶细胞失去有效抑制作用,甚至可能促进肿瘤的发展[1]。Smad蛋白家族指的是TGFβ信号传递通路中的中转分子,从胞质进入胞核[2]。Smad7在基础状态下大部分位于细胞核中,Smad7是TGFβ信号传导途径中必需的下游分子,与多种恶性肿瘤的生物学行为有关。Smad7异常表达,拮抗了TGFβ通路,从而使其不能有效监督肿瘤细胞过度增生,导致肿瘤发生[3]。
TGFβ1调控的基因通常依赖于TGFβ1活化的下游分子R-smad(受体-smad)中的一个,即Smad2或Smad3,Smad3磷酸化和核转位主要发生在活化的细胞,Smad2激活主要发生在静止和中间细胞[4]。在炎症性肠病(IBD)病人肠道内Smad3磷酸化水平下降,伴有Smad7显著增高。研究结果表明,Smad7可通过抑制Smad3的活化磷酸化、影响Smad3/Smad4异源复合物的形成及核转位,最终拮抗TGFβ对细胞的生长抑制效应。在肿瘤的发生、发展过程中 TGFβ1与Smad7的表达是互相调节,共同发挥作用的。有研究发现,TGF-β作用较长时间(2d)后,可直接导致兴奋性信号分子Smad3的基因表达水平下降,抑制性信号分子Smad7的基因表达水平显著上升,而使胞内TGF-β信号转导功能下调,细胞对TGF-β的反应减弱。Smad3功能受高表达Smad7抑制,不能有效启动介导生长终止基因的转录,使细胞生长发生紊乱,从而有可能向恶性化发展[5,6]。此外,在体外正常皮肤成纤维细胞中,TGF-β可使Smad7的表达快速而短暂地被诱导,这就提示Smad7是TGF-β早期即刻基因作用的靶点,作用是自身负反馈调节。说明TGF-β刺激Smads信号通路功能的活化,同时对内源性Smads的表达也起到了潜在的调节作用[7]。
有研究报道TGFβ1在前列腺癌、结肠癌等恶性肿瘤中呈过度表达,其过度表达在肿瘤转化、进展中起重要作用并与预后相关[8]。本实验研究发现胃癌组织TGFβ1呈过表达状态,随着胃癌临床病理分期的进展,TGFβ1表达逐渐加强,提示我们TGFβ1有可能促进胃癌的进展。这与Naef等[9]的研究结果一致,另外TGFβ1在肿瘤中高表达的原因还可能由于胃癌组织细胞失去了对TGFβ1的敏感性,导致TGFβ1的反馈性表达升高。近来的报道显示,Smad7基因扩增与胃癌,结肠癌患者的预后不良有着密切的关系。表明TGF-β信号转导抑制因子Smad7过表达是肿瘤细胞抵抗TGF-β的生长抑制作用的机制之一。最近的研究还显示,Smad7可以不依赖于TGF-β而独立发挥其生物学功能,并与肿瘤细胞凋亡的发生有关。
[1] Pennis on M,Pasche B.Targeting transforming growth factor- beta signaling[J].Curr Opin Oncol,2007,19(6):579 -585.
[2] Derynck R,Zhang Y E.Smad- dependent and smad- independent pathways in TGF - beta family signalling[J].Nature,2003,425(6958):577 -584.
[3] Singh P,Wig JD,Srinivasan R.The Smad family and its role in pancreatic cancer[J].Indian Cancer,2011,48(3):351-360
[4] Liu C,Gaca MD,Swenson ES,et al.Constitutive nuclear localization of smads in activated cells in TGF-beta-independent[J]Biol Chem,2003,278(13):1172 - 1176.
[5] Flanders KC.Smads as a mediator of fibrotic response[J].Int Exp Pathol,2004,85(2):47.
[6] Monteleone G,Kumberova A,Croft NM,et al.Blocking Smad7 restores TGF-beta1 siganaling in chronic inflammatory bowel disease[J].Clin Invest,2010,108(4):601 -605.
[7] Tian F,DaCosta Byfield S,Parks WT,et al.Reduction in Smad2/3 signaling enhances tumorigenesis but suppresses metastasis of breast cancer cell lines[J].Cancer Res,2003,63(23):8284-8292.
[8] Fitchev PP,Weislak SM,Lee C,et al.Thrombospondin-1 regulates the normal prostate in vivo through angiogenesis and TGF - beta activation [J]Lab Invest,2010,90(7):1078-1090
[9] Naef M,Ishiwata T,Friess H.Differential localization of TGF beta isoforms in human gastric mucosa and overexpression in garstric carcinoma[J].Int Cancer,2007,71:131 -137.
