小球藻替代鱼粉对鲫生长、体组成、肝脏脂肪代谢及其组织学的影响
2015-02-27西罗智黄超朱晓鸣刘
石 西罗 智黄 超朱晓鸣刘 胥
(1. 华中农业大学水产学院, 湖北省淡水健康养殖协同创新中心, 武汉430070; 2. 中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室, 武汉 430072; 3. 盘锦光合蟹业有限公司, 盘锦124200)
小球藻替代鱼粉对鲫生长、体组成、肝脏脂肪代谢及其组织学的影响
石 西1罗 智1黄 超1朱晓鸣2刘 胥3
(1. 华中农业大学水产学院, 湖北省淡水健康养殖协同创新中心, 武汉430070; 2. 中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室, 武汉 430072; 3. 盘锦光合蟹业有限公司, 盘锦124200)
设计了5组等氮(粗蛋白约38%)的饲料, 饲料中小球藻的添加量分别为0(对照)、17%、34%、51%和68%, 替代0(对照组)、21.8%、43.6%、65.5%和87.3%的鱼粉, 探讨小球藻替代鱼粉对初始体重为(5.54± 0.08) g的鲫幼鱼生长、体组成、肝脏组织学及脂肪代谢相关酶活性的影响, 实验期为8周。实验结果表明: 随着小球藻替代鱼粉水平的增加, 鲫的增重率呈现先增加后下降的趋势; 与此相反, 饲料系数呈现先下降后增加的趋势。随着小球藻替代比例的增加, 肝体比和脏体比有增大的趋势, 而各个处理组肠脂比差异不显著。小球藻替代鱼粉使鲫肌肉和肝脏的蛋白含量降低, 而肝脏的脂肪含量随着替代比例的增加先上升后下降。当饲料中小球藻替代鱼粉的水平从0增加到65.5%, 肝脏生脂酶如G6PD、ME和FAS酶的活性显著增加, 而当饲料小球藻替代水平更进一步增加到87.3%, 肝脏生脂酶如G6PD、ME和FAS酶的活性下降。各个处理组6PGD酶活性没有显著差异。小球藻替代鱼粉对鲫的肝脏组织结构产生不利影响, 替代组的肝细胞体积有所增大,部分肝细胞出现细胞核溶解、核消失、肝细胞坏死。以增重率和饲料系数为因变量进行二次线性回归分析, 表明小球藻对鱼粉的最适替代比例分别为47.14%和49.88%。
鲫; 小球藻; 鱼粉; 生长性能; 脂肪代谢
鲫是我国常见的淡水鱼类, 因为其味道鲜美,产肉率高, 营养价值丰富, 在我国各地广泛养殖,养殖效益较好[1]。鲫养殖产量年年增加, 特别在长江流域, 鲫已成为淡水养殖的主要品种。从整个养殖产量来讲, 鲫产量较大, 对饲料的需求较大。但对于鲫配合饲料的重要蛋白源——鱼粉, 受资源的限制和需求量增加的影响, 价格居高不下[2], 从而引起鲫的养殖成本升高。加之养殖水产品价格受市场影响,在一些淡水鱼类饲料配方中鱼粉的添加空间十分有限。这就使得利用植物蛋白源替代鱼粉来降低饲料配方成本成为水产动物营养与饲料研究的热点。
水产饲料占水产养殖成本的 50%以上, 蛋白是最昂贵的饲料原料[3]。研究表明, 利用植物蛋白部分或者全部替代鱼粉, 对鱼类的生长和饲料利用无不利影响[4,5], 有些甚至取得了更好的生长效果[6]。微藻的蛋白含量丰富, 而且含有多种不饱和脂肪酸,经常被用来提高食品或者动物饲料的营养价值, 世界上每年有 30%的藻类用于饲料生产[7], 微藻也广泛应用于水产饲料的生产[8]。
小球藻是最早实现商业化生产的微藻之一, 小球藻粉蛋白质含量高, 营养丰富, 是优良的单细胞饲料蛋白源。小球藻含有人体所需的20种氨基酸、多种维生素和微量元素, 以及亚麻酸、亚油酸、胡萝卜素等, 常被用于人类的营养健康产品[9]。在鱼类营养方面, 小球藻经常用来培育鱼苗[7], 而且在饲料中适量添加小球藻可以促进鱼类生长, 提高免疫力[10]。小球藻中含有丰富的生物活性物质, 小球藻生长因子CGF (Chlorella growth factor) 可以促进细胞生长以及增加葡萄糖的耐受性[11,12]。此外, 小球藻已被证明具有抗肿瘤活性、增强免疫力和抗动脉硬化的糖脂、多肽和糖蛋白[9]。
不少研究者已经开展了使用植物性蛋白源替代鱼粉的研究, 但主要集中在豆粕、棉粕、菜粕等, 对于小球藻的研究较少。为此, 本文选用小球藻作为蛋白源部分替代鱼粉, 研究不同小球藻替代水平对鲫生长、体组成、肝脏脂肪代谢及其组织学的影响,旨在为小球藻在鲫饲料工业的利用提供理论参考。
1 材料与方法
1.1 实验鱼
本实验鲫鱼饲养实验在盘锦光合蟹业有限公司进行, 从当地养殖场购买幼鲫 1000尾[初始体重为(5.54±0.08) g]。正式实验前先暂养于室内静水水族缸中, 药浴消毒, 并用对照组饲料驯养2周, 让其适应实验条件。
1.2 实验设计与饲料
实验以小球藻和鱼粉为蛋白源配制五组等氮(38%)饲料, 鱼粉为秘鲁白鱼粉(粗蛋白66.14%), 小球藻为盘锦光合蟹业有限公司生产, 为海水小球藻,经低温烘干得到, 其营养成分为: 粗蛋白 43.97%、粗脂肪 13.98%、灰分 16.13%。饲料中小球藻的添加量分别为0(对照组)、17%、34%、51%和68%, 分别替代鱼粉的比例分别为0(对照组)、21.8%、43.6%、65.5% 和87.3%(对照组、RM 21.8、RM 43.6、RM 65.5、RM 87.3)。各原料粉碎过80目筛, 称量后混匀, 利用制粒机制成颗粒饲料, 70℃条件下干燥, 置于–20℃冰箱中储存、备用。实验饲料的配方及营养组成见表1, 饲料蛋白源、必需氨基酸含量和必需氨基酸指数见表2。
1.3 饲养实验
本实验在室内静水养殖系统中进行。将所有实验鱼放养在15个水族缸(容积: 300 L)中, 每个水族缸中放养20尾无畸形、标准体型的鱼, 水源为曝气自来水。每种饲料设三个重复, 将饲料完全随机地分配到三个水族缸中。每天按照体重的 3%—5%作为投喂量, 并根据鱼体质量变化调整投喂量, 每天投喂两次(9:00、16:00)。喂食期间, 每天喂食前清除排泄物, 然后换水1/3, 并及时监测水质变化。整个实验期间, 水温在(22—27)℃ , pH 为 8.50±0.30, 其间不断充气增氧, 保持溶氧不低于5 mg/L。每2周和实验末对实验鱼进行称重, 并清洗水族缸。实验持续8周。

表1 实验饲料的原料组成及营养成分Tab. 1 Ingredients and compositions of the experimental diets (%)
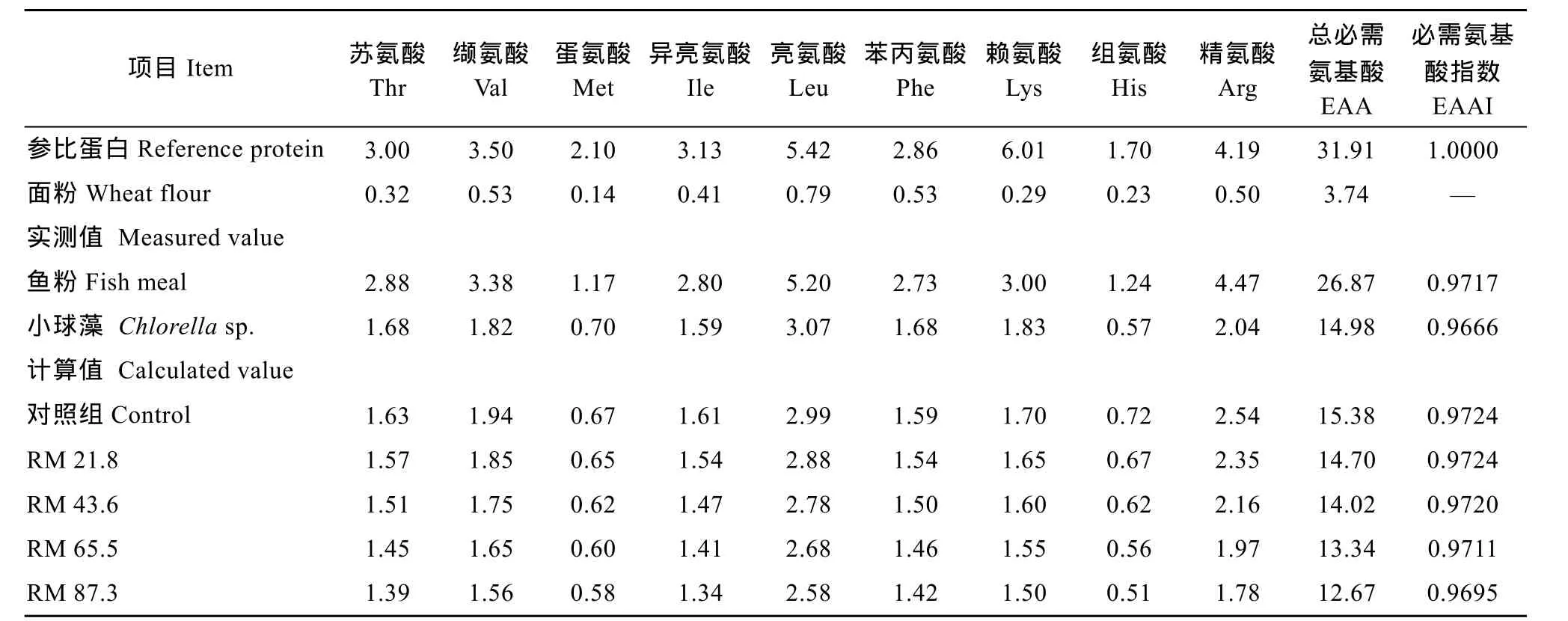
表2 实验原料和饲料的必需氨基酸含量(%干物质)Tab. 2 Essential amino acid profile of the experimental ingredients and diets (% dry matter)
1.4 样品采集
实验开始时, 测定鲫的初始体重。养殖实验结束后, 先将实验鱼饥饿 24h, 对每个缸的实验鱼进行称量, 计算增重率(Weight gain rate, WGR) 、饲料系数(Feed conversion ratio, FCR)、摄食率(Feeding rate, FR)。每个水族缸随机取6尾鱼, 测定体长、全长, 然后解剖, 取内脏、肠脂和肝脏后称重, 计算肝体比(Hepatosomatic index, HSI)、脏体比(Viscera somatic index, VSI)、肠脂比(Intraperitoneal fat ratio, IPR)和肥满度(Condition factor, CF), 并取肌肉。肝脏和肌肉样品用于常规营养成分分析。再随机取 2尾鱼, 迅速取出肝脏, 放在–80℃冰箱内, 用于肝脏内脂肪代谢相关酶活的测定。另取两尾鱼, 取其肝脏, 用于组织学形态观察。
1.5 生化成分的测定
饲料原料及鱼体肌肉、肝脏样品均采用AOAC法(1984)[13]进行生化测定。水分的测定采用105℃烘箱干燥恒重法。采用凯氏定氮法(K9860全自动凯氏定氮仪)测定样品的总氮含量, 将测定结果乘以6.25即得粗蛋白含量; 粗脂肪含量采用索氏抽提法, 提取有机试剂为乙醚; 灰分含量采用高温(550±2)℃马弗炉灰化法测定。饲料的氨基酸含量由湖北省农业科学院农业质量标准与检测技术研究所测定, 所用仪器为自动氨基酸分析仪(Hitachi 835-50, Tokyo, Japan)。
1.6 酶活力测定
每个水族缸中取两尾鱼, 解剖得肝脏, 进行葡萄糖-6-磷酸脱氢酶(G6PD)、6-磷酸葡萄糖脱氢酶(6PGD)、苹果酸酶(ME)、脂肪酸合成酶(FAS)等肝脏内脂肪代谢酶活力的分析。采用南京建成生物工程公司生产的试剂盒测定。
1.7 肝脏组织学HE切片制作与观察
取肝脏组织修切至1 mm3, 利用甲醛溶液固定。切片前, 换致 75%酒精溶液保存, 然后酒精梯度脱水, 二甲苯透明, 浸蜡, 石蜡包埋。石蜡切片机(LeicaRM2135)超薄切片机切片, 切片厚度为 5—7 µm, HE染色。染色过程为: 切片入二甲苯脱蜡→100%—50%酒精逐级复水→苏木精染色→流水冲洗返蓝→50%—95%酒精逐级脱水→伊红染色→二甲苯透明→中性树胶封片。Nikon显微镜下观察拍照。
1.8 计算公式
必需氨基酸指数利用Penaflorida评价饲料蛋白源时[14]所采用的公式计算 EAAI 值:
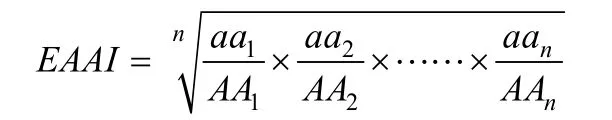
式中 aan为某种必需氨基酸在饲料原料中的必需氨基酸比率(A/E)(指某种必需氨基酸占必需氨基酸总量的百分数)。AAn为该种必需氨基酸在参比蛋白中的为A/E, n必需氨基数目。其中参比蛋白和面粉氨基酸数据来源于《中国食物成分表2002》[15]。
增重率(WGR, %)=100×(末体重–初体重)/初体重;
摄食率(FR, %体重/天)=100×饲料摄入量/[天数×(初体重+末体重)/2];
饲料系数(FCR)=饲料摄入量 /鱼体增重
肥满度(CF, %)=100×鱼体重/(体长)3
肝体比(HSI, %)=100×肝脏湿重/鱼体重;
脏体比(VSI, %)=100×内脏湿重/鱼体重
肠脂比(IPR, %)=100×肠脂重/鱼体重
1.9 数据处理
采用SPSS Statistics 17.0 软件对数据统计分析。先对数据进行单因素方差分析(One-Way ANOVA),若组间差异显著, 再用 Tukey’s法进行多重比较, 显著性水平为 P<0.05。实验数据以平均值±标准误(Mean ± SEM) 表示。利用二次线性回归分析鲫饲料中小球藻比例和增重率、饲料系数之间的相关关系。
2 结果
2.1 小球藻替代鱼粉对鲫生长性能、饲料利用及形态学指数的影响
由表 3可知, 替代组的平均末重、增重率均显著高于对照组(P<0.05), 而RM 21.8、RM 43.6、RM 65.5替代组间无显著性差异(P>0.05), 以RM 43.6替代组数值最高。RM 87.3替代组则显著低于其他替代组(P<0.05)。各替代组的摄食率显著高于对照组(P<0.05), 而替代组之间无显著性差异(P>0.05)。各组的饲料系数有随着小球藻含量的增加呈先降低后升高的趋势, RM 43.6替代组的饲料系数最低。

表3 小球藻替代鱼粉作为蛋白源对鲫生长性能、饲料利用及形态学指数的影响Tab. 3 Effects of substituting Chlorella sp. for regular fishmeal on growth, feed utilization and morphological index of crucian carp
RM 87.3替代组的肥满度低于其他各处理组(P<0.05), 而其他各处理组之间无显著性差异(P>0.05)。各处理组的肝体比有随着小球藻含量的增加而增大的趋势, 其中RM 65.5、RM 87.3替代组显著高于其他各组(P<0.05)。脏体比随着小球藻含量的增加依次增大, 替代组之间无显著性差异(P>0.05),但显著高于对照组(P<0.05)。各处理组的肠脂比无显著性差异(P>0.05)。
由表 4可知, 在肌肉的成分分析中, 各组之间水分和灰分含量无显著性差异(P>0.05)。肌肉中的粗脂肪含量随着替代比例升高有先降低后升高的趋势, RM 43.6和RM 87.3替代组的粗脂肪含量显著低于其他各组(P<0.05), 而其他各组无显著性差异(P> 0.05)。RM 43.6替代组肌肉的粗蛋白含量与对照组无显著性差异(P>0.05), 而显著高于其他各替代组(P<0.05)。
在肝脏的成分分析中, 肝脏粗脂肪含量随着小球藻替代比例的增大先增加后降低, RM 43.6和RM 65.5替代组显著高于其他各实验组(P<0.05), 其他各组之间无显著性差异(P>0.05)。肝脏的粗蛋白含量有随着小球藻含量的增加而降低的趋势, 各组之间差异显著(P<0.05)。
2.3 小球藻替代鱼粉对鲫肝脏内脂肪代谢相关酶的酶活的影响
由表5可知, 各实验组之间的6PGD的酶活力差异不显著(P>0.05)。G6PD、ME和FAS的酶活力变化趋势相似, 都是随着小球藻含量的增加先上升后下降。其中, RM 65.5替代组的脂肪代谢相关酶的酶活力相对较高。
2.4 小球藻替代鱼粉对鲫肝脏组织形态的影响
从图1可以看出, 对照组的肝细胞排列整齐, 细胞膜界限明显, 细胞核清晰可见, 未见组织病变。小球藻替代组的肝细胞的形状轮廓比较明显, 细胞膜完好, 但是也出现了一些不同程度的病变: 肝细胞体积有所变大; 部分肝细胞出现细胞核溶解或者核缺失, 在 87.3%替代组中, 细胞核缺失的肝细胞特别多; 在替代组中, 局部肝细胞坏死。

表4 小球藻替代鱼粉对鲫肌肉、肝脏成分组成的影响(占干物质的百分数)Tab. 4 Effects of substituting Chlorella sp. for regular fishmeal on muscle and liver compositions in crucian carp

表5 小球藻替代鱼粉对鲫肝脏内脂肪代谢相关酶活性的影响Tab. 5 Effects of substituting Chlorella sp. for regular fishmeal on enzyme activities of hepatic lipid metabolism in crucian carp

图1 小球藻替代鱼粉对鲫肝脏组织形态的影响Fig. 1 Effects of substituting Chlorella sp. for regular fishmeal on hepatic histology of crucian carp
2.5 小球藻替代鱼粉水平与鲫生长、饲料利用之间的关系
如图 2, 随着小球藻替代鱼粉比例的增加, 鲫的增重率呈现先升高后下降的趋势。利用SPSS 17.0软件对增重率和饲料系数的相关关系进行二次线性回归分析, 增重率的回归方程为: y =-0.0368x2+ 3.4696x+51.775; 饲料系数的回归方程为: y= 0.0004x2-0.0399x+2.6162。经计算, 小球藻对鱼粉的最适替代比例分别为47.14%和49.88%。

图2 小球藻替代鱼粉的比例与增重率和饲料系数之间的关系Fig. 2 The relationship between dietary Chlorella sp. substitution and WGR and FCR in crucian carp, respectively
3 讨论
3.1 小球藻替代鱼粉对鲫生长、饲料利用及形态学
2015年,北师大民俗学专业正式转入社会学一级学科下发展,随后,依托北师大交叉项目平台,本专业展开了“百村社会治理调查”项目,这为我们探讨实践民俗学的研究路径提供了重要契机。经过三年的思考,今天北师大民俗学专业在“乡村传统与社会治理”主题下所进行的研究,具有实践理论的特点,可以总结为以下几个方面:
指数的影响
在本实验中, 利用小球藻替代鱼粉作为蛋白源,促进了鲫的生长, 替代组的增重率显著高于对照组。这与 Badwy等[16]的研究结果相似, 利用小球藻粉替代鱼粉促进了尼罗罗非鱼的生长。在对其他藻类的研究中表明, 在一定的替代比例内, 利用藻类作为植物蛋白源, 促进了鱼类的生长, 提高了免疫力[17], 有利于提高饲料利用效率, 促进鱼类健康生长[18]。一般认为, 小球藻中含有独特的小球藻生长因子CGF(Chlorella growth factor), CGF主要存在于细胞核中, 其中含有核酸、多肽、多肽、蛋白、氨基酸、维生素、多糖等功能性成分, 而且还有解毒作用的谷胱甘肽[19],具有良好的抗氧化能力[20], 以及较多的多不饱和脂肪酸特别是二十碳五烯酸的含量[21]。在饲料中添加小球藻提高了增重率和饲料利用率[22]。
在本文中小球藻替代组表现出较好的生长效果,一方面可能是因为小球藻较全面的营养价值: 小球藻中含有鲫生长所需要的所有必需氨基酸, 氨基酸指数(EAAI)和鱼粉相差无几; 含有多种不饱和脂肪酸[23], n-3和n-6系列不饱和脂肪酸含量丰富, 特别是对鱼类生长有利的二十碳五烯酸超过了 40%[21];小球藻中还具有20多种维生素和矿物质[20], 这些都满足了鲫生长的要求。其次, 可能是因为CGF独特的抗氧化能力和增强免疫力的作用, 促进了鲫的健康生长。再次, 不同的实验组摄食率不同, 实验中替代组的摄食率显著高于对照组, 而且饲料系数低于对照组, 这可能是替代组的生长性能高于对照组最重要的原因之一。摄食率不同可能与鱼类的习性有关[24], 鲫为杂食性鱼类, 对植物蛋白和动物蛋白都有一定的适应性。藻类的添加可能使饲料适口性增加, 使摄食水平升高, 从而提高了生长性能[17]。
在本实验中, 当饲料中植物蛋白过高时, 会引起生长性能的降低, 这与以前的一些研究结果相似[24,25]。这可能是由于摄食率的降低引起的。有研究表明, 摄食率的降低对鱼的生长产生不利影响[26]。Hussein等[17]认为藻类高水平替代组中铁和铝含量的升高引起了鱼类生长下降, Hasan等[27]则认为这与植物蛋白中存在的毒性物质有关。藻类高水平替代对鲫生长的影响还有待进一步探究。
有研究表明: 随着植物蛋白替代鱼粉水平的增加, 鱼类的肥满度下降, 肝体比上升[28], 这与本实验的结果相似。饲料中高水平的植物蛋白引起了肝脏细胞的肿大和脂肪的蓄积, Hasan等[27]认为是植物蛋白中出现的毒性物质引起了脂肪代谢失调。而脏体比的变化可能与饲料中脂肪含量的大小有关[29],饲料中脂肪含量越高, 脏体比越大。
3.2 小球藻替代鱼粉对鲫肌肉、肝脏成分组成的影响
植物蛋白替代鱼粉对鱼体成分的影响存在差异。利用脱酚棉籽粉替代鱼粉, 对西伯利亚鲟的肌肉粗脂肪含量无显著影响[30], 而有些研究中则导致了肌肉脂肪含量的升高[24,31]。鱼体脂肪含量的变化, 可能与鱼体的脂肪代谢方式及饲料蛋白源不同有关[32]。在本实验中随着替代比例的增加, 饲料脂肪含量升高, 可能导致了高水平替代组肌肉脂肪水平升高。在低水平替代组内, 肌肉内蛋白水平较高, 这可能是由于替代组饲料中较好的氨基酸平衡性使鲫对饲料蛋白的利用水平提高。在高水平替代组内, 肌肉蛋白含量降低, 这与 Refstie等[33]的研究结果相似,这可能与高水平的小球藻中含有某些抗营养因子影响了蛋白的吸收利用有关, 具体的代谢机制还有待进一步研究。肌肉蛋白含量作为一个重要的鱼类品质指标, 含量的大小决定着鱼类的营养价值。在本实验中, 当小球藻替代鱼粉的比例超过 65.5%时,肌肉的蛋白含量降低, 所以在实际应用中, 小球藻的替代比例应控制在65.5%以内。
在本实验中, 肝脏的粗脂肪含量随着替代比例的增加先上升后下降, 这与 Robaina等[34]的研究结果一致, 但林仕梅等[35]用菜粕和棉粕联合替代豆粕,含量高达58%时不会影响奥尼罗非鱼的肝脂含量。不同的实验结果可能与饲料中脂肪含量以及不同鱼类的脂质代谢方式有关。G6PD、ME和 FAS是NADPH产生的关键酶, 主要参与脂肪酸的生物合成[36]。在本实验中, 不同的替代水平造成了肝脏内脂肪代谢相关酶活性的变化, G6PD、ME和FAS的酶活力都有随着小球藻含量的增加先上升后下降的趋势。研究者在利用豆粕替代鱼粉的实验中, 植物蛋白替代对脂肪酶活力无显著性影响[37]。在本实验中, 随着小球藻含量上升, 饲料中脂肪含量升高,鲫肝脏脂肪酶活力也在升高, 造成了脂肪在肝脏内的积累, 也从而增加了鲫脂肪肝病变的可能。
3.3 小球藻替代鱼粉对鲫对肝脏组织形态的影响
许多研究表明, 饲料中植物性原料大量使用,会降低肝的生理机能[34,38]; 肝脏发生病变时, 使脂蛋白合成减少, 肝细胞内的脂肪不能及时运出, 导致肝脏脂肪含量升高。一般来说, 饲料中脂肪含量过高, 会使鱼体能量供应过剩, 肝细胞中脂肪沉积作用加强, 从而使鱼类肝脏的脂肪含量升高, 产生脂肪肝[39]。在本实验中, 随着小球藻替代比例的增加, 饲料脂肪含量增加, 肝细胞出现了细胞核溶解、消失, 细胞变性坏死的症状, 这与脂肪肝的症状相似[40], 但是肝脏细胞中并未发现脂肪滴和空泡化等典型的脂肪肝症状。对于小球藻替代鱼粉对鲫肝脏生理功能的影响还有待进一步的研究。
本实验的研究结果显示, 饲料中小球藻替代鱼粉提高了饲料中氨基酸的平衡性, 促进了鲫的生长和饲料利用。根据增重率、饲料系数与替代比例的关系, 通过二次线性回归分析, 得出最适替代比例分别为47.14%和49.88%。因此, 在实际应用中, 建议鲫饲料中小球藻替代鱼粉的比例为47%—50%。
[1] Cai C, Li E, Ye Y, et al. Effect of dietary graded levels of cottonseed meal and gossypol on growth performance, body composition and health aspects of allogynogenetic silver crucian carp, Carassius auratus gibelio♀×Cyprinus carpio♂[J]. Aquaculture Nutrition, 2011, 17(4): 353—360
[2] Naylor R L, Goldburg R J, Primavera J H, et al. Effect of aquaculture on world fish supplies [J]. Nature, 2000, 405(6790): 1017—1024
[3] El-Sayed A. F. M. Alternative dietary protein sources for farmed tilapia Oreochromis spp. [J]. Aquaculture, 1999, 179(1): 149—168
[4] Song Z, Li H, Wang J, et al. Effects of fishmeal replacement with soy protein hydrolysates on growth performance, blood biochemistry, gastrointestinal digestion and muscle composition of juvenile starry flounder (Platichthys stellatus) [J]. Aquaculture, 2014, 426—427: 96—104
[5] Yamamoto T, Shima T, Furuita H, et al. Influence of feeding diets with and without fish meal by hand and by self-feeders on feed intake, growth and nutrient utilization of juvenile rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture, 2002, 214(1): 289—305
[6] Gui D, Liu W, Shao X, et al. Effects of different dietary levels of cottonseed meal protein hydrolysate on growth, digestibility, body composition and serum biochemical indices in crucian carp (Carassius auratus gibelio) [J]. Animal Feed Science and Technology, 2010, 156(3): 112—120
[7] Spolaore P, Joannis-Cassan C, Duran E, et al. Commercial applications of microalgae [J]. Journal of Bioscience and Bioengineering, 2006, 101(2): 87—96
[8] Hemaiswarya S, Raja R, Kumar R R, et al. Microalgae: a sustainable feed source for aquaculture [J]. World Journal of Microbiology and Biotechnology, 2011, 27(8): 1737—1746
[9] Yamaguchi K. Recent advances in microalgal bioscience in Japan, with special reference to utilization of biomass and metabolites: a review [J]. Journal of Applied Phycology, 1996, 8(6): 487—502
[10] Xu W, Gao Z, Qi Z, et al. Effect of dietary chlorella on thegrowth performance and physiological parameters of gibel carp, Carassius auratus gibelio [J]. Turkish Journal of Fisheries and Aquatic Sciences, 2014, 14(1): 53—57
[11] Wu Q Y, Xu H. High cell density cultivation of Chlorella protothecoides. Chinese patent CN2006100780032, May200
[12] Tartiel M B. Physiological studies on some green algae [D]. Ph. D. thesis, Faculty of Agriculture, Cairo University. Egypt. 2005
[13] AOAC. Official Methods of Analysis (14th edn) [M]. Washington DC: Association of Official Analytical Chemists. 1984, 152—163
[14] Penaflorida V D. An evaluation of indigenous protein sources as potential component in the diet formulation for tiger prawn, Penaeus monodon using essential amino acid index (EAAI) [J]. Aquaculture, 1989, 83(3): 319—330
[15] Yang Y X, Wang G Y, Pan X C. China Food Composition 2002 [M]. Beijing: Peking University Medical Press. 2002 [杨月欣, 王光亚, 潘兴昌. 中国食物成分表 2002. 北京:北京大学医学出版社, 2002]
[16] Badwy T M, Ibrahim E M, Zeinhom M M. Partial replacement of fish meal with dried microalga (Chlorella spp and Scenedesmus spp) in Nile tilapia (Oreochromis niloticus) diets [C]. International Symposium on Tilapia in Aquaculture. 2008
[17] Hussein E E S, Dabrowski K, ElSaidy D M S D,
‐et al. Enhancing the growth of Nile tilapia larvae/juveniles by replacing plant (gluten) protein with algae protein [J]. Aquaculture Research, 2013, 44(6): 937—949
[18] Vizcaíno A J, López G, Sáez M I, et al. Effects of the microalga Scenedesmus almeriensis as fishmeal alternative in diets for gilthead sea bream, Sparus aurata, juveniles [J]. Aquaculture, 2014, 431: 34—43
[19] Nick G L. Addressing human exposure to environmental toxins with Chlorella pyrenoidosa– Medicinal Properties in Whole Foods. Townend Letter for Doctors and Patients, 2003
[20] Bengwayan P T, Laygo J C, Pacio A E, et al. A comparative study on the antioxidant property of Chlorella (Chlorella sp.) tablet and glutathione Tablet [J]. E-International Scientific Research Journal, 2010, 2(1): 25—35
[21] Chen W, Wang X F, Bai Y A, et al. Effects of drying methods and storage condition on fatty acid profile in green alga Chlorella pyrenoidosa powder [J]. Fisheries Science, 2012, 31(2): 89—92 [陈炜, 王秀芬, 白永安, 等. 干燥方法及保存条件对小球藻粉脂肪酸含量和种类组成的影响. 水产科学, 2012, 31(2): 89—92]
[22] Kim K W, Bai S C, Koo J W, et al. Effects of dietary Chlorella ellipsoidea supplementation on growth, blood characteristics, and whole-body composition in juvenile Japanese flounder Paralichthys olivaceus [J]. Journal of the World Aquaculture Society, 2002, 33(4): 425—431
[23] Tokuşoglu Ö, Üunal M K. Biomass nutrient profiles of three microalgae: Spirulina platensis, Chlorella vulgaris, and Isochrisis galbana [J]. Journal of Food Science, 2003, 68(4): 1144—1148
[24] El-Saidy DMSD, Gaber M. Replacement of fish meal with a mixture of different plant protein sources in juvenile Nile tilapia, Oreochromis niloticus (L.) diets [J]. Aquaculture Research, 2003, 34(13): 1119—1127
[25] Liu X Q, Zhu X M, Han D, et al. Effects of dietary ratio of fish meal and rapeseed meal on the growth and feed utilization in gibel carp (Carassius auratus gibelio) [J]. Acta Hydrobiologica Sinica, 2014, 38(4): 657—663 [刘晓庆, 朱晓鸣, 韩冬, 等. 饲料鱼粉、菜粕比例对异育银鲫生长和饲料利用的影响. 水生生物学报, 2014, 38(4): 657—663]
[26] Cabral E M, Fernandes T J R, Campos S D, et al. Replacement of fish meal by plant protein sources up to 75% induces good growth performance without affecting flesh quality in ongrowing Senegalese sole [J]. Aquaculture, 2013, 380—383: 130—138
[27] Hasan M R, Macintosh D J, Jauncey K. Evaluation of some plant ingredients as dietary protein sources for common carp (Cyprinus carpio L.) fry [J]. Aquaculture, 1997, 151(1): 55—70
[28] Yue Y R, Zhou Q C. Effect of replacing soybean meal with cottonseed meal on growth, feed utilization, and hematological indexes for juvenile hybrid tilapia, Oreochromis niloticus × O. aureus [J]. Aquaculture, 2008, 284(1): 185—189
[29] Liu C. Study on the protein and lipid nutrition physiology of southern catfish (Silurus meridionalis Chen) and catfish (Silurus asotus Linnaeus) [D]. Ocean University of China. 2013 [刘匆. 南方鲶和鲶的蛋白质脂肪营养生理研究. 中国海洋大学. 2013]
[30] Wu X F, Xue M, Guo L Y, et al. Effects of substitution of solvent-extracted cottonseed meal for part fish meal on growth, body composition and serum biochemical indices of juvenile siberian sturgeon (Acipenser baerii Brandt) [J]. Chinese Journal of Animal Nutrition, 2010, 22(1): 117—124 [吴秀峰, 薛敏, 郭利亚, 等. 脱酚棉籽粉替代部分鱼粉对西伯利亚鲟幼鱼生长, 体成分及血清生化指标的影响. 动物营养学报, 2010, 22(1): 117—124]
[31] Kaushik S J, Coves D, Dutto G, et al. Almost total replacement of fish meal by plant protein sources in the diet of a marine teleost, the European seabass, Dicentrarchus labrax [J]. Aquaculture, 2004, 230(1): 391—404
[32] Vilhelmsson O T, Martin S A M, Médale F, et al. Dietary plant-protein substitution affects hepatic metabolism in rainbow trout (Oncorhynchus mykiss) [J]. British Journal of Nutrition, 2004, 92(1): 71—80
[33] Refstie S, Storebakken T, Baeverfjord G, et al. Long-term protein and lipid growth of Atlantic salmon (Salmo salar) fed diets with partial replacement of fish meal by soy protein products at medium or high lipid level [J]. Aquaculture, 2001, 193(1): 91—106
[34] Robaina L, Izquierdo M S, Moyano F J, et al. Soybean and lupin seed meals as protein sources in diets for gilthead seabream (Sparus aurata): nutritional and histological implications [J]. Aquaculture, 1995, 130(2): 219—233
[35] Lin S M, Mai K S, Tan B P. Effect of soybean meal replacement by rapeseed-cottonseed compound on growth, body composition and immunity of tilapia Oreochromis niloticus× O. aureus [J]. Oceanologia et Limnologia Sinica, 2007, 38(2): 168—173 [林仕梅, 麦康森, 谭北平. 菜粕、棉粕替代豆粕对奥尼罗非鱼(Oreochromis niloticus× O. aureus)生长、体组成和免疫力的影响. 海洋与湖沼, 2007, 38(2): 168—173]
[36] Carvalho C S, Fernandes M N. Effect of copper on liver key enzymes of anaerobic glucose metabolism from freshwater tropical fish Prochilodus lineatus [J]. Comparative Biochemistry and Physiology, 2008, 151(3)A: 437—442
[37] Wu L Y, Qin G X, Sun Z W, et al. Effect of dietary dehulled soybean meal replacing fish meal on the activity of digestive enzyme and the intestinal tissue of Clarias lazera [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2010, 39(4): 99—105 [吴莉芳, 秦贵信, 孙泽威, 等. 饲料中去皮豆粕替代鱼粉对埃及胡子鲇消化酶活力和肠道组织的影响. 中山大学学报(自然科学版), 2010, 39(4): 99—105]
[38] Ostaszewska T, Dabrowski K, Palacios M E, et al. Growth and morphological changes in the digestive tract of rainbow trout (Oncorhynchus mykiss) and pacu (Piaractus mesopotamicus) due to casein replacement with soybean proteins [J]. Aquaculture, 2005, 245(1): 273—286
[39] Verreth J, Coppoolse J, Segner H. The effect of low HUFA and high HUFA-enriched Artemia, fed at different feeding levels, on growth, survival, tissue fatty acids and liver histology of Clarias gariepinus larvae [J]. Aquaculture, 1994, 126(1): 137—150
[40] Feng J, Jia G. Studies on the fatty liver diseases resulted from different lipid levels in Sciaenops ocellatus diets [J]. Acta Hydrobiologica Sinica, 2005, 29(1): 61—64 [冯健, 贾刚.饵料中不同脂肪水平诱导红姑鱼脂肪肝病的研究. 水生生物学报, 2005, 29(1): 61—64]
EFFECT OF SUBSTITUTING CHLORELLA SP. FOR REGULAR FISHMEAL ON GROWTH, BODY COMPOSITION, HEPATIC LIPID METABOLISM AND HISTOLOGY IN CRUCIAN CARP CARASSIUS AURATUS
SHI Xi1, LUO Zhi1, HUANG Chao1, ZHU Xiao-Ming2and LIU Xu3
(1. College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China; 2. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 3. Panjin Guanghe Crab Ltd., Co., Panjin 124200, China)
The present study was designed to evaluate the effects of fishmeal (FM) substitution with Chlorella sp. on growth, body composition, hepatic lipid metabolism and histology in crucian carp Carassius auratus. Five isonitrogenous (CP, 38%) diets were formulated to substitue FM for Chlorella sp. with 0 (control), 21.8% (RM 21.8), 43.6% (RM 43.6), 65.5% (RM 65.5) and 87.3% (RM 87.3), respectively. Each experimental diet was randomly fed to triplicate groups with 20 crucian carp [initial body weight of (5.54±0.08) g] per tank for 8 weeks. Weight gain rate (WGR) increased with the substitution level from 0 to 43.6%, and then tended to decline with further increased replacement, but feed conversion ratio (FCR) showed the opposite trend with WGR. No significant differences were observed in IPR (intraperitoneal fat ratio) cross groups, while HSI (hepatosomatic index) and VSI (viscera somatic index) increased with the increased dietary Chlorella sp. The protein contents of muscle and liver decreased with the elevated dietary Chlorella sp. level, while the highest hepatic lipid contents were observed in RM 43.6 and RM 65.5 groups, which is associated with the increased expression of several lipogenic enzymes, such as G6PD (glucose-6-phosphate dehydrogenase), ME (malic enzyme), FAS (fatty acid synthase). Chlorella sp. had adverse effects on hepatic histology based on the cell size. Karyolysis, nucleus disappearance or necrosis occured in some hepatocytes of crucial carp fed Chlorella-added diets. Based on the quadratic regression analysis of WGR and FCR, the optimal dietary substitution levels were between 47% and 50% for best growth performance and feed utilization of crucian carp.
Crucian carp Carassius auratus; Chlorella sp.; Fishmeal; Growth performance; Lipid metabolism
S965.1
A
1000-3207(2015)03-0498-09
10.7541/2015.66
2014-06-11;
2014-11-27
农业部公益性行业(农业)科研专项(201303053)资助
石西(1990—), 男, 山东泰安人; 硕士; 研究方向为水产动物营养与饲料。E-mail: shixi901010@163.com
罗智(1976—), 男, 博士, 教授, 博导; 研究方向为鱼类营养生理、代谢调控及饲料配方。E-mail: luozhi99@mail.hzau. edu.cn; luozhi99@aliyun.com
