基于GABA A受体评估双氟沙星对异育银鲫的安全性
2015-02-27赵依妮孙鲲杨先乐阮记明周爱玲
赵依妮孙 琪,胡 鲲杨先乐阮记明周爱玲
(1. 上海海洋大学国家水生动物病原库, 上海 201306; 2. 上海黛龙生物科技工程有限公司, 上海 201306)
基于GABA A受体评估双氟沙星对异育银鲫的安全性
赵依妮1孙 琪1,2胡 鲲1杨先乐1阮记明1周爱玲1
(1. 上海海洋大学国家水生动物病原库, 上海 201306; 2. 上海黛龙生物科技工程有限公司, 上海 201306)
神经传递的兴奋和抑制的相互平衡是维持中枢神经系统正常功能的必要条件, 其中抑制性则是由最重要的神经递质γ-氨基丁酸 (GABA) 调节的, 而GABA则主要通过GABA A受体GABAAR起作用。A型受体是一种跨膜门控氯离子通道, 可介导阶段性的抑制突触传递, 也可强直性抑制外周突触传递, 因此在神经性疾病如焦虑和癫痫的病理生理学中起着至关重要的作用[1]。刺激GABA的分泌, 增加其与GABA A受体的结合将抑制中枢神经系统兴奋, 导致抑郁等消极情绪的产生; 相反, 抑制GABA的分泌, 减少其与GABA A受体的结合可刺激中枢神经兴奋, 导致癫痫等疾病的产生[2]。喹诺酮类药物是人工合成的含 4-喹诺酮基本结构的抗菌药物, 其抑菌机理主要是对细菌DNA回旋酶 (DNA gyrase) 具有选择性抑制作用[3]。喹诺酮类药物分为四代, 目前临床应用较多的为第三代喹诺酮类药物, 水产养殖业中常用的有双氟沙星、诺氟沙星、左氧氟沙星等。其中, 双氟沙星 (Difloxacin, DIF) 抗菌活性高, 对革兰氏阳性和阴性菌及多种厌氧菌都有较强的抗菌作用[4], 且双氟沙星质量稳定、口服吸收性好、体内浓度高、半衰期长且与其他抗菌药物无交叉耐药性, 因而在水产养殖细菌性疾病的防治中得到广泛使用[5]。而在水产养殖过程中, 对细菌、寄生虫等靶病原用药时, 药物给养殖动物带来副作用是不可避免的。随着DIF应用的越来越广泛, 导致水产动物不良反应的发生也越来越频繁[6]。目前在脊椎动物体内的研究表明,喹诺酮类药物产生的不良反应主要发生在消化系统, 而神经系统是即消化系统后第二大不良反应作用部位[7]。研究发现大部分含有亲脂性氟原子的氟喹诺酮类药物可透过血脑屏障进入脑组织, 通过抑制GABA与GABA A受体的结合, 从而使得中枢神经兴奋性增加[7]。大鼠 (Rattus norvegicus) 动脉灌注培氟沙星、诺氟沙星、环丙沙星、氟罗沙星和司帕沙星等氟喹诺酮类药物后, 在其大脑组织中可以检测到相应药物的存在[8]。最近, 阮记明等[9]的研究表明DIF可透过异育银鲫 (Carassais auratus gibebiol) 脑血屏障, 且 DIF在大脑内的消除缓慢, 对中枢神经系统造成的影响具有持久性。DIF等喹诺酮类药物所造成的不良反应主要包括头晕、焦虑、恐惧感等, 而鱼类、虾蟹等中枢神经系统的过度兴奋将导致鱼类急游、耗氧量增加, 死亡率也随之增加。目前, 有关GABA受体在水产动物领域的研究较少, 其研究仍主要集中在癫痫病治疗药物、抗抑郁等神经药物和农用杀虫剂的创新与研制等方面[10—13]。
国内有关药物分子毒理学的研究工作刚刚起步, 且以药物受体研究药物安全性具有针对性、特异性的优势,因此本研究以GABA A受体作为检测指标, 从分子水平反映 DIF对水产养殖动物的毒性, 从而评估其药物安全性, 促进GABA受体在药物安全性检测中的应用。GABA A受体由五个亚基组装而成, 目前已发现的亚基共有 19种 (α1-6、β1-3、γ1-3、δ、ε、π、θ、ρ1-3 ), 其中, γ2亚基是GABA A受体主要的功能性亚基之一[14], 且84%的GABA A受体包含γ2亚基[15,16]。同时免疫沉淀实验表明γ2亚基可以同α1、α2、α3、α5、α6、β2、β3、γ3和δ 等亚基共同组装; 此外, γ2亚基也为氯离子通道正常导电所必需[17]。因此, 我们选取异育银鲫GABA A受体的γ2亚基作为检测指标, 为GABA A受体作为药物安全性评估指标提供一种新思路。
1 材料与方法
1.1 实验动物与试剂
实验动物及DIF处理 健康的异育银鲫购买于江苏省南通某国营农场, 体重 (61±5.5) g。用2% NaCl浸泡10min, 然后放置于高锰酸钾消毒后的水族箱 ( 100 cm × 80 cm × 80 cm ) 内暂养2周, 饲喂普通颗粒饲料。试验期间使用自动控温系统控制水温为 (20±2)℃, 24h充气, 2d换一次水。以4尾未灌药的异育银鲫作为空白对照组, 其组织也用于GABA A 受体γ2 亚基mRNA 及蛋白组织特异性表达分析, 所取组织包括脑、肝、肾、心、肌肉、肠、皮、性腺。按20 mg/Kg 鱼体重标准口灌盐酸双氟沙星原料药溶解液, 分别于给药后 1h、3h、6h、12h、24h、48h、96h 各取异育银鲫4尾, 分别取脑、肝、肾、肌、性腺。组织样品用液氮迅速冷却, 储存在–70℃条件下, 用于转录水平和蛋白水平的检测。
主要试剂和仪器 Trizol试剂 (美国Invitrogen 公司), 反转录酶、Ex Taq DNA聚合酶 (日本TaKara 公司), iQTMSYBR GREEN Supermix (美国 Bio-Rad 公司), 引物、AXYGEN柱式凝胶回收试剂盒、AXYGEN小量质粒提取试剂盒 (上海生工生物有限公司), BCA蛋白浓度测定试剂盒、RIPA强裂解液、6×SDS-PAGE蛋白上样缓冲液、彩色预染蛋白质分子量、考马斯亮蓝染液、显影液和定影液购自碧云天生物科技有限公司; 兔抗GABAAR γ2多克隆抗体(一抗)(美国 Sigma-Aldrich公司); 兔抗β-actin多克隆抗体(内参一抗)(武汉博士德生物有限公司); ECL超敏化学发光试剂盒(上海威奥生物有限公司); PVDF膜(聚偏二氟乙烯膜)(美国 Bio-Rad 公司), 滤纸(北京索莱宝生物有限公司)。PCR仪为 eppendof Mastercycle Gradient, 核酸测定仪为 eppendof Biophotomter,实时定量PCR仪为BIO-RAD Mini Optica, 165—8001 小型垂直电泳仪 (美国 Bio-Rad 公司); 半干转膜仪(美国Bio-Rad 公司); 温控摇床、脱色摇床(美国 Thermo公司)。
1.2 实验方法
总RNA的提取与反转录 分离异育银鲫脑、肝、肾、心脏、前肠、表皮、肌肉和性腺, 按Trizol法提取总RNA。采用紫外分光光度计与1.0 %琼脂糖凝胶电泳检测RNA的浓度及完整性, –80 ℃保存备用。使用M-MLV反转录cDNA。反转录体系及反应条件按照试剂盒推荐体系进行。
引物设计、基因片段的克隆及测序 应用 Primer Premier 5.0软件, 根据 GeneBank发表的斑马鱼 (NM_ 001256250.1) GABA A受体的γ2亚基序列设计一对特异性引物 F1&R1(表 1), 引物由上海生工生物有限公司合成。PCR反应体系及反应条件按照试剂盒推荐体系进行。1.0% 的琼脂糖凝胶电泳检验扩增产物, 按琼脂糖凝胶DNA 回收试剂盒操作说明纯化回收特异性扩增产物, 并连接至pMD19-T vector 载体, 将链接好的质粒转化感受态DH5, 通过蓝白斑筛选和菌落PCR初步鉴定后, 阳性菌落于 37℃震荡培养过夜。提取质粒后将鉴定为阳性的克隆送上海生工生物科技有限公司进行测序。
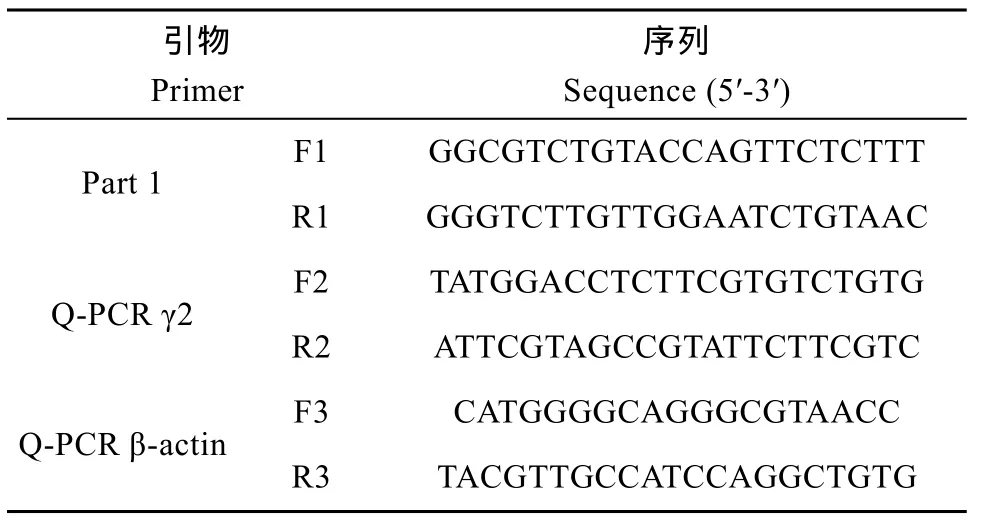
表1 本文所用引物Tab. 1 Sequences of primers used in the study
GABA A受体γ2 亚基mRNA表达分析 以获得的基因序列为模板, 利用 Primer Primer 5.0 软件设计一对γ2 亚基特异引物F2 & R2 (表 1), 对不同组织(脑、肝、肾、心、肌肉、肠、皮、性腺)及双氟沙星处理后脑、肝、肾、肌肉和性腺中 γ2 亚基 mRNA的表达进行检测, 并以β-actin 为内参基因, 所用特异性引物F3 & R3见表1。采用iQTMSYBR GREEN Supermix (Bio-Rad) 进行实时定量RCR, 反应体系及反应条件按照试剂盒推荐体系进行。用内参 β-actin对各样品的 Ct值进行均一化处理, 采用2–ΔΔCt确定不同样品mRNA的相对含量[18]。
GABA A受体γ2亚基蛋白表达分析 采用Western blot法对不同组织(脑、肝、肾、心、肌肉、肠、皮、性腺)及双氟沙星处理后脑、肝、肾、肌肉和性腺中 γ2 亚基蛋白的表达量进行检测, 并以β-actin 为内参基因。具体方法为: 按照每20 mg组织加入200 μL裂解液的比例加入裂解液。在匀浆机中研磨, 直至裂解液中组织块消失。放在4℃静置30min充分裂解, 并每隔10min强烈振荡一次。充分裂解后, 4℃、12000 r/min离心20min, 取上清。提取组织总蛋白后, 采用 Brandford法(考马斯亮蓝结合显色法)蛋白定量试剂盒定量蛋白浓度。将上样液于100℃的PCR仪中煮沸10min, 使蛋白变性, 并制备11% 分离胶和4% 积层胶, 加电泳缓冲液后上样电泳。电泳完毕后将蛋白转印于硝酸纤维素膜上。脱脂奶粉封闭膜后分别加入兔抗GABAAR γ2多克隆抗体 (1∶200)和兔抗 β-actin (1∶2000)孵育 2h,洗膜, 再加入用封闭液稀释的辣根过氧化物酶(HRP)标记的羊抗兔二抗(1∶2000), 37℃摇床上孵育 2h。洗膜后膜转入ECL 超敏化学发光试剂(试剂 A∶试剂 B=1∶1)显色液中反应2min, 取出膜, 甩去多余的液体, 用保鲜膜包好PVDF膜, 暗室中用X胶片感光、显影、定影。将Western blot的胶片置于凝胶成像仪中用化学发光法进行检测、照相, 显影结果用Quantity One V4.6.2软件(美国Bio-rad公司)对蛋白质条带灰度进行半定量分析处理, 结果用GABAAR γ2蛋白目的条带与 β-actin条带的灰度值比值表示GABAAR蛋白相对表达强度(GABAAR γ2/β-actin)。
1.3 统计方法
用Excel统计数据, SPSS 13.0统计软件进行单因素方差分析, 以 P<0.01 (差异极显著), 0.01<P<0.05 (差异显著), P>0.05 (差异不显著) 作为差异显著性判断标准, 差异显著时采用LSD法对各组平均样之间进行多重比较。结果用平均值±标准差 (Mean±SD)表示, 当P<0.05时, 差异显著。
2 结果
2.1 GABA A受体γ2亚基mRNA的组织表达分析
荧光定量PCR结果显示, 异育银鲫GABA A受体γ2亚基和内参的实时荧光定量PCR扩增曲线指数增长明显,溶解曲线均为单一峰, 扩增效率 E值均接近 1.0, 分别为97.3和 98.3, 表明此条件下目的基因与内参基因的扩增效率一致, 适合作为标准曲线。此外, 4个平行加样孔之间扩增结果偏差不显著, 说明此条件下扩增体系和反应条件良好。荧光定量检测γ2 亚基在异育银鲫各组织中的表达情况, 以β-actin 为内参基因, 结果显示, GABA A受体γ2 亚基在脑、肝、肾、心、肌肉、肠、皮、性腺中均有表达。其中尤以脑组织中含量最高, 性腺和肝脏次之,前肠中表达水平相对较低, 而在肾脏、肌肉、心脏、表皮中的表达量最低。统计学分析显示GABA A受体γ2 亚基mRNA在各组织间表达量差异显著 (P<0.05) (图 1)。
2.2 GABA A受体γ2亚基蛋白的组织表达分析
Western blot结果显示(图2), β-actin蛋白在各组织中的表达无明显差异; 以β-actin为内参分析GABA A受体γ2亚基蛋白的表达, 可见GABA A受体γ2亚基蛋白在各组织中均有表达, 其中尤以脑中的含量最多, 性腺次之,肝脏、肾脏、前肠、肌肉、心脏表达水平依次降低, 在皮中表达量最低。统计学分析显示GABA A受体γ2亚基蛋白在各组织间表达量差异显著 (P<0.05) (表2 )。
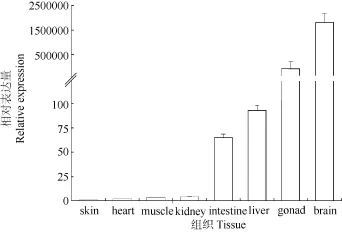
图1 异育银鲫GABA A受体γ2亚基基因在各组织中的表达情况Fig. 1 Expression of GABA A receptor γ2 subunit gene in different Carassais auratus gibebiol tissues
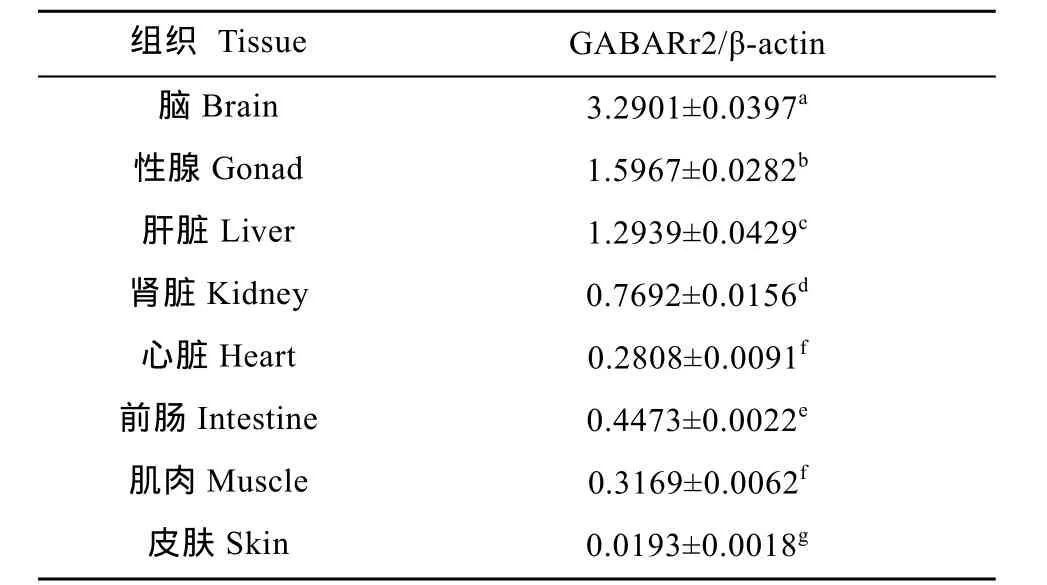
表2 各组织GABA A受体γ2亚基蛋白相对表达(光密度比值)Tab. 2 The relative protein expression of GABA A receptor γ2 subunit (n=4, x ± s)
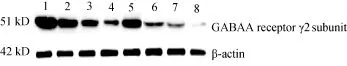
图2 异育银鲫各组织GABA A受体γ2亚基蛋白表达情况Fig. 2 The protein expression of GABA A receptor γ2 subunit in different tissues of Carassais auratus gibebiol
2.3 DIF对GABA A 受体γ2 亚基mRNA和蛋白表达的影响
实时荧光定量PCR结果 (图3) 和Western blot结果(图5) 显示, DIF可明显抑制异育银鲫GABA A受体γ2亚基 mRNA 和蛋白质的表达, 与各组织的空白对照组比较差异有统计学意义 (P<0.05)。相比于转录水平的迅速降低, 蛋白表达水平的降低具有一定的滞后性, 这主要是因为基因到蛋白表达需通过一系列复杂的反应才得以实现的缘故。
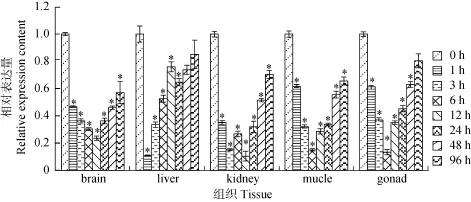
图3 异育银鲫GABA A受体γ2亚基在DIF作用下mRNA表达情况Fig. 3 The Expression of GABA A receptor γ2 subunit gene in Carassais auratus gibebiol after DIF challenge

图4 异育银鲫GABA A受体γ2亚基在DIF作用下脑组织内mRNA表达情况Fig. 4 The Expression of GABA A receptor γ2 subunit gene in brain of Carassais auratus gibebiol after DIF challenge
3 讨论
3.1 GABA A受体γ2亚基的组织表达特征
运用实时定量PCR和Western Blot检测GABA A受体γ2 亚基mRNA和蛋白在异育银鲫脑、肝、肾、心脏、肌肉、前肠、表皮和性腺 8个组织中的表达, 结果发现GABA A受体γ2 亚基在各组织中均有表达, 且在脑组织中其基因水平和蛋白水平的表达量显著高于其他组织(P<0.05), 这与GABA A受体是中枢神经系统主要的抑制性神经调节递质γ-氨基丁酸 (GABA) 的主要受体相符合[13,15]。Pirker等[19], Hörtnagl等[20]的研究发现GABA A受体γ2 亚基在老鼠和家鼠体内也主要分布于脑组织, 且主要集中于海马区、皮层和小脑等区域。此外, GABA A受体γ2 亚基的基因和蛋白在性腺中也具有一个较高表达水平, Praphaporn Stewart等[21]发现GABA A受体在耳鲍幼体发育过程中的含量明显增加, 因此, 我们推测GABA A受体除了神经调节功能外, 还将参与异育银鲫生殖及幼体发育过程。

图5 异育银鲫GABA A受体γ2亚基在DIF作用下蛋白表达情况Fig. 5 The protein expression of GABA A receptor γ2 subunit in Carassais auratus gibebiol after DIF challenge
3.2 DIF对异育银鲫GABA A受体表达量的影响
与各组织空白对照相比, DIF可明显抑制 GABA A受体 mRNA和蛋白的表达, 对异育银鲫各组织存在一定的神经毒性 (图3、图5)。另外, 在DIF用药组实验中, 我们选取了7个时间点, 分析药物代谢过程中GABA A受体在各组织中的变化情况, 结果表明药物在体内浓度越高GABA A 受体的含量越低, 随着 DIF被鱼体不断代谢, GABA A 受体的含量逐渐回升趋于正常值 (图3、图5),这说明GABA A受体表达量与DIF在鱼体内的含量成负相关, 可利用GABA A受体在组织中的表达量来推测DIF在鱼体不同组织中的含量。
肾脏中GABA A受体mRNA含量在第12h出现二次回落, 肝脏在第24h出现二次回落, 说明DIF在肾脏、肝脏中的含量出现再次回升, 可能是因为 DIF在异育银鲫体内存在肝肠循环所致。这与章海鑫等[5]、阮记明等[22]的研究结果DIF在异育银鲫体内的药时曲线均形成“多峰现象”相一致。
图3中脑组织受DIF影响后GABA A受体表达模式的变化同其他组织基本一致, 然由于 GABA A受体mRNA在脑组织中的初始表达量是肝脏、肾脏等外周组织的 2万 至 20万倍, 因此我们以脑组织空白对照组GABA A受体原始表达量为基准, 单独构建了脑组织用药后mRNA表达量变化图 (图4), 结果表明用DIF处理后, 脑组织中GABA A受体mRNA表达量降低程度相对更大, 因此DIF对脑组织中GABA A受体含量的抑制效果最显著, 说明 DIF对水产动物所造成的神经毒性作用在脑组织中最显著, 与前人研究结果相符[3,6,7]。同时, 相关研究显示, γ2亚基表达量的降低将导致生物体神经性死亡[23,24], 因此 DIF对水产动物所造成的神经毒性是不可忽视的。
本研究还发现, DIF对脑组织中GABA A受体含量的影响具有持久性, 恢复到原有水平需经过一段较长的代谢周期 (图3、图4), 阮记明等[9]的研究表明DIF可透过异育银鲫脑血屏障, 且正是由于血脑屏障的存在, 导致DIF在脑中的消除半衰期最长, 到试验第 960h, 大脑组织中DIF 含量较肝脏、肾脏和肌肉中最高。
4 展望
异育银鲫经DIF处理后, 所有检测组织中GABA A受体 mRNA和蛋白表达量的影响均有明显降低, 表明DIF对异育银鲫各组织器官均有一定的神经毒性作用,然尤以脑组织中含量变化最明显即神经毒性最显著。同时,进一步的实验表明, 随着DIF被鱼体不断代谢, GABA A受体的含量逐渐回升, 并趋于正常值, 即鱼体内DIF含量与GABA A 受体含量呈负相关关系。本实验说明GABA A受体作为双氟沙星神经毒性的评估指标是可行的, 并为后期GABA A受体在氟-喹诺酮类药物对水产动物神经毒性的评估提供理论及实验基础, 从而在分子水平上体现药物对水生动物神经系统的影响。
[1] Gangisetty O, Reddy D S. The optimization of TaqMan real-time RT-PCR assay for transcriptional profiling of GABA-A receptor subunit plasticity [J]. Journal of Neuroscience Methods, 2009, 181(1): 58—66
[2] Zhu W P. Analysis on adverse effects of quinolone drugs [J]. China Modern Medicine, 2010, 17(22): 82—83 [朱文平. 喹诺酮类药物不良反应的分析. 中国当代医药, 2010, 17(22): 82—83]
[3] Sun H P, Cai L L, Yan F Q, et al. Mechanism and adverse effect of quinolones [J]. Chinese Journal of Nosocomiology, 2008, 18(7): 1014—1016 [孙慧萍, 蔡力力, 阎赋琴, 等.喹诺酮类药物的作用机制及不良反应. 中华医院感染学杂志, 2008, 18(7): 1014—1016]
[4] Shen C, Shen J Z, Xiao X L, et al. Study on dominant lethal assay of difloxacin [J]. Chinese Journal of Veterinary Drug, 2000, (5): 16—18 [沈川, 沈建忠, 肖希龙, 等. 双氟沙星对小鼠的显性致死试验. 中国兽药杂志, 2000, (5): 16—18]
[5] Zhang H X, Ruan J M, Hu K, et al. Researches about pharmacokinetics of DIF in Carassais auratus gibebio [J]. Periodical of Ocean University of China, 2012, 42(11): 81—86 [章海鑫, 阮记明, 胡鲲, 等. 双氟沙星在异育银鲫体内药代动力学研究. 中国海洋大学学报(自然科学版), 2012, 42(11): 81—86]
[6] Yang P. Analysis of mechanism and adverse effect of Quinolones [J]. China Journal of Pharmaceutical Economics, 2013, (4): 43—44 [杨萍. 喹诺酮类药物的作用机制及不良反应分析. 中国药物经济学, 2013, (4): 43—44]
[7] PAN F C. Discuss the importance of reasonable application of Quinolones [J]. China Journal of Pharmaceutical Economics, 2013, (2): 72—73, 77 [潘凤潺. 浅谈喹诺酮类药物合理应用的重要性. 中国药物经济学, 2013, (2): 72—73, 77]
[8] De Lange E C M, Marchand S, van den Berg D, et al. In vitro and in vivo investigations on fluoroquinolones; effects of the P-glycoprotein efflux transporter on brain distribution of sparfloxacin [J]. European Journal of Pharmaceutical sciences, 2000, 12(2): 85—93
[9] Ruan J M, Hu K, Yang X L, et al. blood-brain barrier permeability of dif and its elimination comparative study between brain and peripheral tissues in carassius auratus gibelio [J]. Acta Hydrobiologica Sinica, 2014, 38(2): 272—278 [阮记明, 胡鲲, 杨先乐, 等. 双氟沙星对异育银鲫血脑屏障渗透性及消除规律. 水生生物学报, 2014, 38(2): 272—278]
[10] Whiting P J. GABA-A receptor subtypes in the brain:a paradigm for CNS drug discovery [J]? Drug Discovery Today,2003, 8(10): 445—450
[11] Whiting P J. The GABAA receptor gene family: new opportunities for drug development [J]. Current Opinion in Drug Discovery & Development, 2003, 6(5): 648—657
[12] Kinirons P, Cavalleri G L, Shahwan A, et al. Examining the role of common genetic variation in the γ2 subunit of the GABAA receptor in epilepsy using tagging SNPs [J]. Epilepsy Research, 2006, 70(2-3): 229—238
[13] Korpi E R, Sinkkonen S T. GABA (A) receptor subtypes as targets for neuropsychiatric drug development [J]. Pharmacology & Therapeutics, 2006, 109(1-2): 12—32
[14] Hancili S, Önal Z E, Ata P, et al. The GABAA Receptor γ2 Subunit (R43Q) Mutation in Febrile Seizures [J]. Pediatric Neurology, 2014, 50(4): 353—356
[15] Mascia M P, Biggio F, Mancuso L, et al. Changes in GABA(A) receptor gene expression induced by withdrawal of, but not by long-term exposure to, ganaxolone in cultured rat cerebellar granule cells [J]. Journal of Pharmacology and Experimental Therapeutics, 2002, 303(3): 1014—1020
[16] Brandon N J, Delmas P, Hill J, et al. Constitutive tyrosine phosphorylation of the GABAA receptor γ2 subunit in rat brain [J]. Neuropharmacology, 2001, 41(6): 745—752
[17] Schweizer C, Balsiger S, Bluethmann H, et al. The γ2 subunit of GABAA receptors is required for maintenance of receptors at mature synapses [J]. Molecular and Cellular Neuroscience, 2003, 24(2): 442—450
[18] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method [J]. Methods, 2001, 25(4): 402—408.
[19] Pirker S, Schwarzer C, Wieselthaler A, et al. GABAA receptors: immunocytochemical distribution of 13 subunits in the adult rat brain [J]. Neuroscience, 2000, 101(4): 815—850
[20] Hörtnagl H, Tasan R O, Wieselthaler A, et al. Patterns of mRNA and protein expression for 12 GABAA receptor subunits in the mouse brain [J]. Neuroscience, 2013, 236: 345—372
[21] Stewart P, Williams E A, Stewart M J, et al. Characterization of a GABAA receptor β subunit in the abalone Haliotis asinina that is upregulated during larval development [J]. Journal of Experimental Marine Biology and Ecology, 2011, 410: 53—60
[22] Ruan J M, Hu K, Zhang H X, et al. Pharmacokinetics comparisons of difloxacin in crucian carp (Carassais auratus gibebio) at two different water temperatures [J]. Journal of Shanghai Ocean University, 2011, 20(6): 858—865 [阮记明,胡鲲, 章海鑫, 等. 两种水温条件下异育银鲫体内双氟沙星药代动力学比较. 上海海洋大学学报, 2011, 20(6): 858—865]
[23] Jesper Karle, Michael Robin Witt, Mogens Nielsen. Diazepam protects against rat hippocampal neuronal cell death induced by antisense oligodeoxynucleotide to GABA receptor γ2 subunit [J]. Brain Research, 1997, 765(1): 21—29
[24] Karle J, Laudrup P, Sams-Dodd F, et al. Differential changes in induced seizures after hippocampal treatment of rats with an antisense oligodeoxynucleotide to the GABA A receptor γ2 subunit [J]. European Journal of Pharmacology, 1997, 340(2—3): 153—160
SAFETY EVALUATION OF DIFLOXACIN ON CARASSAIS AURATUS GIBEBIOL BASED ON GABA A RECEPTOR
ZHAO Yi-Ni1, SUN Qi1,2, HU Kun1, YANG Xian-Le1, RUAN Ji-Ming1and ZHOU Ai-Ling1
(1. State Collection Center of Aquatic Pathogen, Shanghai Ocean University, Shanghai 201306, China; 2. Shanghai Delon Biological Technology Engineering Co., LTD, Shanghai 201306, China)
异育银鲫; GABA A受体γ2亚基; 克隆; 组织分布; 双氟沙星; 安全性
Carassais auratus gibebiol; GABA A receptor γ2 subunit; Clone; Tissue distribution; Difloxacin; Safety
S948
A
1000-3207(2015)03-0598-06
10.7541/2015.78
2014-05-06;
2014-10-05
国家科学自然基金“鱼类GABA受体与渔药安全性评价的研究”(31172430); 公益性农业行业专项项目“渔药使用风险评估及其控制技术研究与示范”(201203085); 863项目“鱼虾用疫苗与药物研究开发”(2011AA10A216)资助
赵依妮(1992—), 女, 安徽合肥人; 在读硕士研究生; 主要研究方向为鱼类药物受体, 药物代谢动力学。E-mail: zhaoyini21@126.com
杨先乐, E-mail: xlyang@shou.edu.cn
