姜黄素衍生物的合成及其抗肿瘤活性
2015-02-27司桂福徐国永周双生
司桂福,刘 涛,徐国永,周双生 *
(1.安徽中医药大学药学院,安徽 合肥 230038; 2.安徽大学现代实验技术中心,安徽 合肥 230039)
姜黄素衍生物的合成及其抗肿瘤活性
司桂福1,刘涛1,徐国永2,周双生1 *
(1.安徽中医药大学药学院,安徽 合肥 230038; 2.安徽大学现代实验技术中心,安徽 合肥 230039)
[摘要]以姜黄素、2-氯甲基吡啶和2-氯-5-氯甲基吡啶等为原料,制备了三种新型含氮杂环类姜黄素衍生物A、B和C,经核磁,质谱确定了这些目标化学物的结构,并使用MTT法对其抗肿瘤活性进行了测试。结果表明三种目标化合物均具有比5-氟尿嘧啶(5-Fu)更强的抗肿瘤活性。
[关键词]姜黄素衍生物;氮杂环;表征;抗肿瘤活性
姜黄素[l,7-二(4-羟基-5-甲氧基)苯基-1,6-庚二烯-3,5-二酮]是从姜黄属中药姜黄、郁金、莪术等块茎中提取出来的一种天然产物,为二酮类化合物。在中国的传统医药学中, 姜黄素不仅能行气、驱虫、散风活血、通经止痛等,还具有抗氧化、降血脂、抗炎、抗病毒和抗癌等生物活性[1-4]。众多学者对姜黄素抗肿瘤作用及其机制做了大量研究,证实了姜黄素可以抑制多种肿瘤细胞系的生长[5,6]。研究还显示,姜黄素的抑瘤作用机制主要与诱导肿瘤细胞凋亡有关,它是通过调控抑癌基因、癌基因及其蛋白的表达、诱导细胞周期停滞及调控细胞凋亡信号等途径实现[2],除此之外,姜黄素还可能通过抗氧化、免疫调节、影响激素水平等机制达到抗肿瘤的目的[3]。因其低毒、低分子量、抗肿瘤作用广泛,曾被认为是理想的抗癌化学治疗药物之一。 然而姜黄素在体内的溶解性小、体内吸收少、代谢过快,生物利用度低,极大地限制了它的应用。有研究发现[4-6]碱性氮原子的存在使得化合物易于成盐,可明显改善化合物的水溶性,而且含杂原子的姜黄素衍生物的在药效上要强于姜黄素本身[7-8]。受此启发,我们选择了两种吡啶类化合物作为原料,合成了三种未见文献报道的含氮杂环姜黄素衍生物,并对它们的抗肿瘤活性进行了评价。目标化合物的合成路线如图1。

图1 目标化合物的合成路线
1实验部分
1.1试剂与主要仪器
姜黄素,2-氯甲基吡啶盐酸盐 和2-氯-5-氯甲基吡啶盐酸盐购自国药集团化学试剂有限公司,均为分析纯。人非小细胞肺癌细胞 A549、人结肠癌细胞 HCT-116、人胃癌细胞 MNK-45(安徽中医药大学药学院),DMEM 高糖培养液 (美国 Gibco 公司产品),MTT (美国 Sigma 公司产品),二甲基亚枫(DMSO) (美国 Sigma 公司产品),胰蛋白酶 (碧云天生物有限公司产品),PBS( 博士德生物有限公司),胎牛血清 (天津 TBD 科技有限责任公司)。
WRS-1数字熔点仪(上海精密科学仪器有限公司);Bruker 400MHz (超导核磁共振仪(德国);TSQ Quantum Access MAX三重四极杆液质联用仪(美国)。
1.2姜黄素衍生物的合成
1.2.12-氯甲基吡啶姜黄素衍生物A和B的合成
取2-氯甲基吡啶盐酸盐 0.68g,碳酸钾粉末0.57g和15ml的DMF放置于圆底烧瓶内,在室温下搅拌反应30min,同时取姜黄素0.37g,碳酸钾0.56g和15ml 的DMF放置于另一圆底烧瓶中,在50℃下反应30min。合并两个烧瓶,并加适量碘化钾,温度升至90℃,反应24h(用TLC检测反应完全,展开体系V(石油醚):V(乙酸乙酯)=1:2),冷却至室温后于反应液中加入适量水,并用乙酸乙酯进行萃取(3 × 15 mL),合并有机相,将有机相用1mol/L的NaOH溶液洗涤三次,再用饱和NaCl溶液洗涤三次,最后将有机相减压浓缩得到固体,此固体用硅胶柱分离,V(石油醚)∶V(乙酸乙酯)=1∶1为洗脱剂得到两个产物,其中目标物A量为0.18g,产率39.2%;B量为0.11g,产率20.1% 。
化合物A:m.p 151-152℃;1H-NMR (400 MHz, CDCl3) δ: 7.59 (d ,J= 15.7, 4.8 Hz, 2H, = CH), 7.26 - 7.09 (m, 3H, Py-H), 7.05 (d ,J= 22.7, 9.9 Hz, 2H, = CH), 6.97 - 6.56 (m, 6H, ArH), 5.64 (s, 2H, CH2), 5.23 (s, 1H, OH), 4.66 (s, 2H, CH2), 3.76 (s, 6H, CH3);ESI-MSm/z:460.14 [M +1]+.
化合物B: m.p 161-162℃;1H-NMR (400 MHz, CDCl3) δ: 7.56 (s, 2H,=CH) , 7.33-7.12 (m, 6H, Py-H), 7.10 (d ,J= 22.7, 9.9 Hz, 2H, = CH), 6.98- 6.54 (m, 6H, Ar-H), 5.67 (s, 2H, CH2), 4.68(s, 2H, CH2), 3.79(s, 3H, CH3); ESI-MSm/z:551.11 [M +1]+.
1.2.22-氯-5-甲基吡啶姜黄素衍生物C的合成
化合物C的合成方法和化合物A或B类似。只需用2-氯-5-氯甲基吡啶代替2-氯甲基吡啶盐酸盐。跟踪反应的薄层板展开体系V(石油醚):V(乙酸乙酯)=1:1,最后得到橙色油状物,用 “乙酸乙酯/石油醚”体系 重结晶得淡黄色粉末0.21g,产率33.9%。m.p:175-176℃;1H -NMR (400 MHz, CDCl3) δ: 7.61 (s, 2H, = CH) , 7.36-7.14 (m, 6H, Py-H), 7.11 (d ,J= 22.7, 9.9 Hz, 2H, = CH), 6.99- 6.59 (m, 6H, ArH), 5.76 (s, 2H, CH2), 4.75 (s, 2H, CH2), 3.85(s, 3H, CH3);ESI-MSm/z:619.53 [M +1]+.
1.3抗肿瘤活性
目标化合物对人非小细胞肺癌细胞 A549、肠癌细胞 HCT-116 和人胃癌细胞 MNK-45的抑制作用研究(四甲基偶氮唑盐MTT比色法)。将含10﹪胎牛血清、青霉素 105 IU/L、链霉素 100 mg/L 的 DMEM 培养基于 37 ℃,CO2体积分数为 5﹪的细胞培养箱内培养。 取对数生长期细胞,0.25 ﹪胰酶消化后用培养液制成单细胞悬液。以 1×104个/mL 细胞密度接种于 96 孔培养板中,每孔接种 100 μL。 培养 24 h后,加入用培养液稀释的不同浓度的药物 100 μL,终浓度分别为 10、20、40、60、120 μmol/L,每孔设 6 个复孔。待药物分别作用 24 h 后,每孔加入 5 mg/mL MTT 20 μL,37 ℃, 5%CO2培养 4 h。 然后吸弃上清液,加入 DMSO 150 μL/孔,微振荡器上振荡 10 min,将试剂对照调零,用自动酶标仪在 490 nm 波长处测出细胞对照组和各药物组的 OD 值,取各组均值,重复实验 3 次。 最后用下面的公式计算各组药物对细胞的抑制率(IR):
抑制率(IR)% = (1-药物组OD值/细胞对照组 OD值)×100%
2结果与讨论
2.1反应条件
对于化合物A和B的合成,我们开始依据的是过去的反应条件,即采用的是“丙酮-碳酸钾-碘化钾(催化剂)”体系,实验结果发现,反应48h后,点板发现原料点颜色很深,A和B的点依然很淡;后来改用DMF做溶剂,因为DMF沸点较高,所以相应的升高了反应温度,在反应24h后点板发现原料点几乎消失,产物点很明显。在目标化合物C 的合成中, 其反应条件和过程与目标物A(或B)几乎一样,唯一不同的是反应时间比前者稍长。同时考虑到C物的极性较前两个略小,其使用的展开体系极性调小一倍。
2.2姜黄素衍生物的结构确认
目标化合物的1H-NMR谱中,7.36-7.04 ppm区间上出现的多重峰属于吡啶环上的双键H的化学位移,6.93-6.32 ppm处的多重峰属于连接苯环上H的化学位移,7.60 与7.10 ppm附近分别为主链乙烯基上的H的化学位移。以化合物A为例:δ 7.26-7.09区域内的多重峰属于吡啶上的H的化学位移,6.97-6.56区域内的多重峰属于苯环双键H的化学位移,7.59 和7.05处的双重峰分别归于主链上乙烯基氢的化学位移,5.64处的单峰属于连在两个羰基间亚甲基H的化学位移,5.23处的单峰属于酚羟基上H的化学位移,4.66处的单峰属于吡啶与苯环醚键间的亚甲基H的化学位移,3.76处出现的强单峰归属于甲氧基H的化学位移。同时质谱数据显示,明显存在目标化合物的分子离子峰460.14,表明该物质结构较稳定。综上波谱数据,可以得出该化合物即为实验合成的目标化合物A。
2.3生物活性实验
以经典抗肿瘤药物5-Fu为阳性对照,采用经典的MTT法对三种目标化合物进行了体外抗肿瘤活性测试。细胞株选用的是人非小细胞肺癌细胞 A549、肠癌细胞 HCT-116 和人胃癌细胞 MNK-45。实验结果见图2和表1。
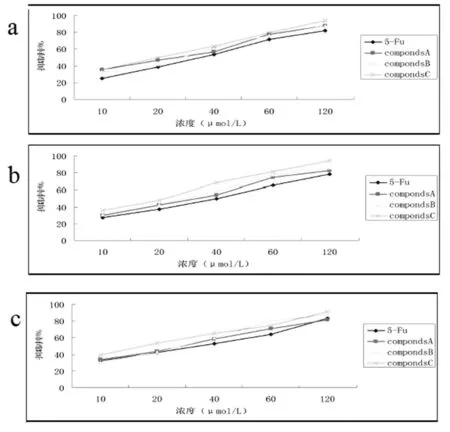
图2 不同浓度的姜黄素衍生物和5-Fu对肿瘤细胞A549(a)HCT-116 (b)和 MNK-45 (c)的抑制率(24h)

CompondsA549HCT-116MNK-45A21.6526.0724.23B22.5923.8623.40C19.3818.6717.375-Fu39.3140.8636.17
由图2和表1 中可知,化合物A、B和C均有良好的抗肿瘤活性,且都明显优于常用的临床抗肿瘤药物5-氟尿嘧啶(5-Fu);其次,化合物C的抗肿瘤活性是三个化合物中最强的,可能是因为其产物中含有卤素基团,由于卤素基团的存在,使得它与DNA产生额外的作用所致[6],其具体的抗肿瘤作用机制有待进一步的研究证明。同时,目标化合物C具有的良好的抗肿瘤活性也为我们将来进一步探索姜黄素类新型抗肿瘤药物提供很好的参考。
[参考文献]
[1]Kuttan R., Bhanumathy P., Nirmala K., et al. Potential anticancer activity of turmeric (Curcuma longa)[J]. Cancer Letters., 1985, 29 (2): 197-202.
[2]Park MJ,Kim EH,Park IC,etal.Curcumin inhibit,cell cycle progression of immortalized human umbilreal vein endothelial(ECV304) cell by up-regulation cyclin-dependent kinase inhibitor ,p21WAFI/CIPI,p27KIPI and p53[J].Int J.Oncol,2002,21(2):379-383
[3]许东晖,王胜,金晶等.姜黄素的药理作用研究进展[J].中草药,2005,11(36):1737-1740
[4]张欢,房磊,陈莉等.具有抗肿瘤活性的姜黄素衍生物研究进展[J].药学进展,2014,38(1):36-45
[5]Chan Mug Ahn,Woon-Seob Shin, Ho Bum Woo, et al. Synthesis of symmetrical bis-alkynyl or alkylp pyrdine and thiophene derivatives and their antiangiogenic activities. Bioorganic & Medicinal Chemistry Letters[J].2004,14:3893-3896
[6]罗金香,丁伟等.姜黄素异噁唑和吡唑衍生物的合成及杀螨活性[J] .农药学学报, 2013,15( 4) : 372-380.
[7]Huang SF( 黄淑芳) ,Ying HZ( 应华洲) ,Hu YZ( 胡永洲) .Synthesis and antitumor activity study of nitrogen containingcurcumin derivatives[J].Chin J Med Chem( 中国药物化学杂志) ,2011,21( 2) : 88-95.
[8]邬皓,周鹏,李家明等.姜黄素衍生物的生物活性研究进展[J].安徽中医学院学报,2012,31(2):77-80.
[9]张博,叶丽红.姜黄素抗癌机制研究进展[J].中医药学报,2013,41(1):121-123.
Synthesis and Anti-tumor Activity of Curcumin Derivatives
SI Guifu1, LIU Tao1, XU Guoyong2, ZHOU Shuangsheng1
(1.DepartmentofPharmacy,AnhuiUniversityofChineseMedicine,Hefei230038,China;
2.CenterofModernExperimentalTechnology,AnhuiUniversity,Hefei, 230039,China)
Abstract:Three kinds of novel curcumin derivaties containing azaheterocyclic were prepared using curcmin, 2-chloromethyl pyridine and 2-chloro-5-chloromethyl pyridine as starting material, the structure of the target compounds were confirmed by 1H-NMR, Mass Spectra. The anti-tumor activity of the target compounds were measured by the MTT assay, the results show that there compounds possess stronger anti-tumor activity against tested tumor cell lines than that of curcumin.
Key words:curcumin derivative; azaheterocyclic; characterizationl; antitumor activity
[中图分类号]O625;R9
[文献标识码]A
[文章编号]1674-2273(2015)06-0062-03
作者简介][第一 司桂福(1991-),男,安徽霍邱人,安徽中医药大学药学院研究生,研究方向:药物合成。
[基金项目]安徽省自然科学基金(1208085MH273) 和安徽省省级高校自然科学重点项目(KJ2013A214)资助、绿色高分子材料安徽省重点实验室开放课题基金(201401006)
[收稿日期]2015-08-10
