基因芯片技术在乙肝病毒分型和耐药突变检测中的应用
2015-02-24李延武李卓成
李延武, 李卓成
(广东省深圳市第二人民医院 检验科, 广东 深圳, 518035)
基因芯片技术在乙肝病毒分型和耐药突变检测中的应用
李延武, 李卓成
(广东省深圳市第二人民医院 检验科, 广东 深圳, 518035)
摘要:目的探讨基因芯片技术在乙肝病毒(HBV)分型和耐药突变检测中的应用。方法采用基因芯片法检测105例HBV病毒携带者血清标本,观察HBV基因分型特点及针对核苷酸类药物的耐药突变情况,并结合受试者荧光定量PCR病毒载量、血清HBV标志物及病理检测结果进行分析。结果105例HBV病毒携带者C型63例(60.0%), B型、C型混合型16例(15.2%), B型26例(24.8%), 各基因型构成差异有统计学意义(P<0.05)。C型HBV-DNA载量对数值、HBeAg阳性率与B型比较差异有统计学意义(P<0.05)。病理活检结果显示炎症分期G3~G4期、纤维化分级S3~S4级C型乙肝病毒携带者所占比重高于B型,差异有统计学意义(P<0.05)。共检出耐药突变28例(26.67%); 204I居多,占11.4%, 180M+204V+204I突变共7例,占6.67%。临床耐药种类表现为拉米夫定耐药26例,阿德福韦耐药2例。结论基因芯片技术对乙肝病毒分型及耐药突变检测具有重要的作用。
关键词:乙型肝炎病毒; 基因芯片; 基因分型; 耐药突变
乙型肝炎病毒(HBV)感染呈全球性流行,中国为乙型肝炎的重要疫区,HBV病毒携带者约占中国总人口的5%~20%, 每年因慢性乙型肝炎导致的肝硬化、肝癌而死亡的人数将近30万[1]。HBV病毒根据全基因序列同源性大于92%及S基因系列同源性大于96%分为8种基因型,各基因型的地理、种族分布及耐药特点均有不同,并直接影响到疾病的临床表现及治疗效果。作者应用基因芯片技术对105例HBV病毒携带者进行了检测,旨在研究本院乙肝病毒基因分型特点及针对核苷酸类药物耐药突变情况,为乙型肝炎的防治提供临床研究资料。
1资料与方法
1.1 研究对象
选取2012年1月—2014年1月本院传染科收治的HBV病毒携带者105例为研究对象,所有患者均签署知情同意书,其中男64例,女41例,年龄28~46岁。纳入标准: ① 所有研究对象乙肝表面抗原(HBsAg)与HBV-DNA检测均为阳性结果; ② 均进行肝组织病理活检。研究对象的选择注意排除除乙型肝炎病毒外其他型别肝炎病毒感染患者,并排除免疫性肝病,胆汁型肝硬化患者。
1.2 研究方法
对105例HBV病毒携带者清晨空腹取血4 mL于含促凝剂试管各3支,分别进行基因芯片法检测HBV基因分型(A-H)及耐药突变(184G、181V、236T、194T、180M、204V、204I、202G、250V);荧光定量PCR检测HBV病毒DNA载量;酶联免疫吸附法(ELISA)检测乙肝血清标志物;并对研究对象进行肝组织病理活检,研究HBV基因分型(A-H)与HBV病毒DNA载量、乙肝e抗原(HBeAg)阳性情况及肝组织病理活检肝组织炎性分级(G0~G4)、肝纤维化(S0~S4)之间关系,并观察105例乙肝病毒携带者HBV病毒耐药突变情况。
1.3 实验室检测
1.3.1基因芯片:HBV基因分型及耐药突变检测试剂采用珠海赛乐奇生物有限公司生产产品,全自动基因扩增仪为ABI7300,分子杂交仪为FYY-3型,严格按试剂说明操作,扩增循环条件95 ℃10 min→94 ℃30 s, 56 ℃ 30 s, 72 ℃ 30 s(50个循环)。
1.3.2荧光定量PCR: HBV病毒DNA载量检测采用荧光定量PCR方法,试剂由中山大学达安基因股份有限公司提供,全自动基因扩增仪为ABI7500, 扩增循环条件: 93 ℃ 2 min→93 ℃ 45 s, 55 ℃ 60 s(10个循环)→93 ℃ 30 s, 55 ℃ 45 s(30个循环),分析后扩增曲线调节Baseline的start值、end值以及threshod,根据标准曲线自动定量,对于CT值处于27-30的灰值区域标本,进行重新取血复查。
1.3.3HBV血清标志物:ELISA检测HBV血清标志物,试剂使用万泰生物有限公司产品,全自动免疫分析仪为深圳爱康医疗器械有限公司生产的URANUS120,严格按试剂说明书操作。
1.4 病理检查
由相关临床高资历医生超声引导行肝组织取材,送病理活检,肝组织炎症分级及纤维化分期参照《病毒性肝炎防治方案》[2]的相关诊断。
1.5 统计学处理
使用统计学软件SPSS 19.0进行数据分析,多组间均值比较采用方差分析,组间两两比较采用SNK法,构成比、构成率比较采用卡方检验,以P<0.05有统计学意义。
2结果
2.1 105例HBV病毒携带者基因分型情况
105例HBV病毒携带者基因芯片检测基因分型: C型63例(60.0%), B型、C型混合型16例(15.2%),B型26例(24.8%), 各不同基因型构成比较差异有统计学意义(χ2=52.54,P=0.000), 其中以C型为主要型别。
2.2 不同基因型别HBV病毒携带者HBV-DNA根据不同基因型分组比较各组HBV病比较
根据不同基因型分组比较各组HBV病毒携带者HBV-DNA载量对数值、HBeAg阳性率及病理活检,HBV-DNA载量对数值3组差异有统计学意义(P<0.05), SNK两两比较3组差异均有统计学意义(P<0.05), 其中以C型HBV-DNA载量对数值较高; HBeAg阳性率3组比较差异有统计学意义(P<0.05), 两两比较C型HBeAg阳性率与B型差异有统计学意义,其他各组比较无显著差异(P>0.05)。病理活检经卡方检验分析比较,炎症分期、纤维化分级均有统计学意义(P<0.05), 炎症分期G3~G4期,纤维化分级S3~S4级C型乙肝病毒携带者所占比重高于B型及B、C混合型。见表1。
2.3 105例HBV病毒携带者针对核苷酸类药物耐药突变检测情况
105例HBV病毒携带者针对核苷酸类药物耐药突变基因芯片检测情况见表2, 其中共检出耐药突变28例,占26.67%; 204I居多占11.4%, 180M+204V+204I突变居第2位,共7例,占6.67%; 临床耐药种类表现为拉米夫定耐药26例,阿德福韦耐药2例。

表1 不同基因型别HBV病毒携带者HBV-DNA载量对数值、
与C型比较,*P<0.05; 与B+C型比较,#P<0.05。
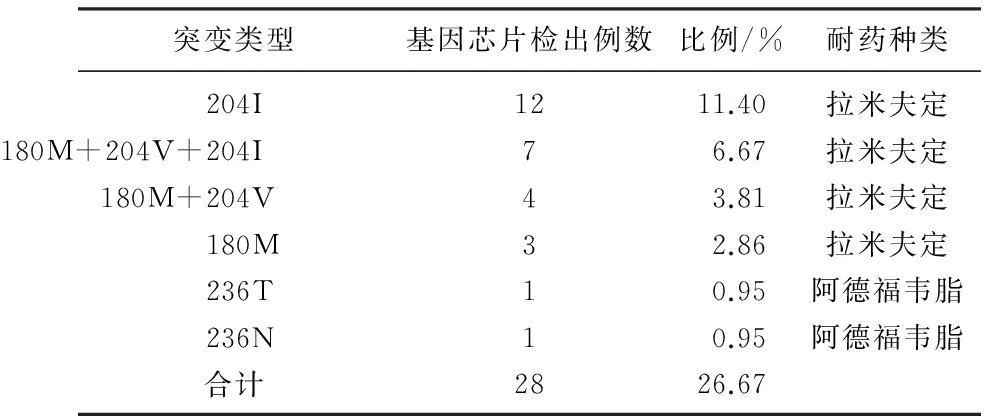
表2 105例HBV病毒携带者针对核苷酸类药物耐药
3讨论
HBV基因型别的多态性源于其逆转录过程中RNA聚合酶、逆转录酶校正功能的缺失,基因序列以点突变多见[3], 包括自然变异、抗病毒药物以及机体免疫应答导致的变异,变异长期累积形成HBV病毒基因序列的差异性,也是病毒变异进化的一种形式,目前根据基因序列差异性(全基因序列≥8%、S基因系列≥4%)分为常见的8种基因型(A-H), 各基因型又可分为不同亚型,中国以B、C、D这4种型别多见。各型别地域差异性较大, B型南方多见,而北方则以C型为主,本研究仅检测出B型、C型两种型别,其中以C型为主占60.0%, B、C混合感染占15.2%, 符合上述观点,混合型感染比率升高在其他研究中也有报导[4], 其因素考虑与人口流动性有关。
病毒基因控制相关抗原的表达,基因不同的毒株有不同的抗原表达特点,病毒变异的结果也导致宿主免疫应答以及患者临床表现的多样性,病情趋向于复杂化,也给临床的治疗提供了难度。相关研究[5]显示, C型HBV病毒引起的肝损重于B型病毒,作者对研究中不同型别乙肝病毒携带者HBV-DNA病毒载量对数值以及HBeAg阳性率进行了比较,研究显示C型HBV-DNA病毒载量对数值以及HBeAg阳性率均高于B型,差异均有统计学意义。病例活检结果显示,C型肝组织炎症分期以G3~G4居多,与B型分布差异有统计学意义,纤维化分级以S3~S4居多,与其他2组均有显著差异。数据说明在重型肝炎及肝纤维化程度较高患者中,C型占较大比重。有学者[6]认为C型HBV病毒较难清除,易形成持续的病毒血症,预后较差。
乙肝的治疗目前采用核苷类药物及干扰素治疗较为多见,常见核苷类药物包括拉米夫定及阿德福韦脂,核苷类药物对延缓肝炎病情进展及改善组织学病变有良好的治疗效果,但长期治疗过程中易产生耐药现象为其共同的局限性[7-9]。本研究中耐药突变率为26.67%, 突变类型以204I、180M+204V+204I、180M+204V多见,临床表现为拉米夫定耐药,204I、204V均位于聚合酶C区,这一区域为拉米夫定的作用靶点,HBV野生型为蛋氨酸(M),突变株被异亮氨酸(I)及缬氨酸(V), 其点突变分别为739位碱基鸟嘌呤(G)取代腺嘌呤(A)及741位碱基胸腺嘧啶(T)取代鸟嘌呤(G), 异亮氨酸及缬氨酸取代蛋氨酸诱发拉米夫定耐药。资料[10-11]显示,拉米夫定为耐药率较高的核苷类药物,且用药时间越长,耐药率越高,用药4年的耐药率可达66%; 另阿德福韦脂临床报导耐药率较低,对于e抗原阳性患者三年的耐药仅为3.1%[12], 但本研究中发现2例,值得引起临床的关注。
基因芯片为采用光导原位合成及显微印刷将大量特定序列探针固密集有序的固定与载体上,通过多元杂交进行定性及定量的方法,微型化、集成化、高通量,平行化及敏感性强为其主要特点[13-14], 可同时检测多个基因改变。基因芯片对乙肝病毒分型及耐药突变检测在乙肝防治上有重要的临床意义,值得推广应用。
参考文献
[1]刘文有. 乙型肝炎流行病学研究概况[J]. 内科, 2012, 7(3): 299.
[2]中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010 年版)[J]. 中华肝脏病杂志, 2011, 19(1): 13.
[3]Devesa M, Loureiro C L, Rivas Y, et al. Subgenotype diversity of hepatitis B virus American genotype F in Amerindians from Venezuela and the general population of Colombia[J]. J Med Virol, 2008, 80(1): 20.
[4]金晖, 王杰, 闫玲, 等. 乙型肝炎病毒A-D基因型及B1、B2、C1和C2基因亚型巢式聚合酶链反应分型法的建立[J]. 中华流行病学杂志, 2008, 29(12): 235.
[5]孙珍, 赵志军, 师志云, 等. 宁夏地区乙肝病毒感染者HBV基因分型与临床意义[J]. 宁夏医科大学学报, 2014, 1(1): 34.
[6]钟大妮, 李国坚, 吴继周, 等. 广西地区乙肝病毒基因分型与临床表现及机体免疫功能关系的研究[J].中国医学创新, 2013, 10(2): 1.
[7]Lok A S, Zoulim F, Locarnini S, et al. Antiviral drug-resistant HBV: standardization of nomenclature and assays and recommendations for management[J]. Hepatology, 2007, 46(1): 254.
[8]郭建琼, 程玲, 刘洪利, 等. 163例慢性重型乙型病毒性肝炎合并自发性细菌性腹膜炎的临床分析[J]. 第三军医大学学报, 2011, 33(21): 2240.
[9]金生. 慢性乙型肝炎抗病毒治疗—2012年欧洲肝病研究学会指南简介[J]. 中国实用内科杂志, 2013, 33(3): 193.
[10]宋晓西. 护理干预对乙肝患者抗病毒治疗依从性的影响[J]. 中华全科医学, 2011, 9(9): 1479.
[11]李文鹏, 李彤, 庄辉. 乙型肝炎病毒对拉米夫定耐药的研究进展[J].传染病信息, 2007, 20(1): 32.
[12]Seyed H, Monavari H, Keyvani H, et al. Detection of rtN236T mutation associated with adefovir dipivoxil resistance in Hepatitis B infected patients with YMDD mutations in Tehran[J]. Iranian journal of microbiology, 2013, 5(1): 76.
[13]李金明, 谢南, 熊德琴.基因芯片法检测乙肝病毒多位点变异的临床应用[J]. 实验与检验医学, 2009, 27(6): 615.
[14]李延武. 利用基因芯片技术研究乙肝病毒耐药机制[J]. 现代中西医结合杂志, 2012, 21(12): 1303.
Application of gene chip technology in hepatitis B
virus genotyping and detection of resistance mutations
LI Yanwu, LI Zhuocheng
(DepartmentofLaboratory,ShenzhenSecondPeople′sHospital,Shenzhen,Guangdong, 518035)
ABSTRACT:ObjectiveTo explore the application of gene chip technology in hepatitis B virus (HBV) genotyping and detection of resistance mutations. MethodsA total of 105 serum samples of patients with HBV were detected by gene chip method. Feature of HBV genotyping and drug resistance to the nucleotide drugs were observed and analyzed in the condition of considering with the subjects quantitative PCR viral load, serum HBV markers and pathological test results. ResultsOf 105 patients with HBV virus, 63 cases were type C (60.0%), 16 cases were mixed type of B and C (15.2%), 26 cases were type B (24.8%), and there were significant differences among all the genotypes (P<0.05). There were significant differences in HBV-DNA load logarithm and positive rate of HBeAg between type B and type C (P<0.05). Biopsy result revealed that ratio of type C patients with staging G3~G4and fiber S3~S4class of HBV was significantly higher than that of type B patients (P<0.05). Resistance mutations were detected in 28 cases (26.67%). 204I mutation was the most, accounted for 11.4%. 180M +204 V +204 I mutation was observed in 7 cases (6.67%). Clinical manifestations of resistance to drug were lamivudine-resistant species in 26 cases and adefovir resistance in 2 cases. ConclusionGene chip technology shows an important role in the HBV genotyping and detection of resistance mutations.
KEYWORDS:hepatitis B virus; gene chip; genotyping; resistance mutations
基金项目:广东省深圳市科技计划项目(201003037)
收稿日期:2014-12-09
中图分类号:R 512.6
文献标志码:A
文章编号:1672-2353(2015)09-049-03
DOI:10.7619/jcmp.201509014
