脐带间充质干细胞移植治疗大鼠胶原诱导关节炎模型的疗效观察
2015-02-24刘布骏
赵 成, 张 璐, 王 红, 刘布骏
(南京大学医学院附属鼓楼医院 风湿免疫科, 江苏 南京, 210008)
脐带间充质干细胞移植治疗大鼠胶原诱导关节炎模型的疗效观察
赵成, 张璐, 王红, 刘布骏
(南京大学医学院附属鼓楼医院 风湿免疫科, 江苏 南京, 210008)
摘要:目的探讨脐带间充质干细胞(UCMSCs)移植治疗大鼠胶原诱导关节炎(CIA)模型的疗效。方法40只造模成功的Wistar大鼠随机分为MSCs移植治疗组(MSC组,n=20)、细胞对照组(FLS组,n=10)、疾病对照组(CIA组,n=10),10只正常的Wistar大鼠作为正常对照组。采用AI评分来评价CIA大鼠关节肿胀程度。第17天予MSC组CIA大鼠尾静脉注射1×106UCMSCs,FLSs组CIA大鼠尾静脉注射等量成纤维样滑膜细胞。第42天处死所有大鼠,外周血分离血清,踝关节HE染色。ELISA法检测血清中TNF-α、TGF-β、IL-1β、IL-6水平。踝关节病理评价关节间隙狭窄程度。结果MSC组大鼠关节AI低于FLS组和CIA组(P<0.05); HE染色示CIA大鼠造模后踝关节出现炎性细胞浸润及关节腔狭窄,但MSC治疗组关节间隙明显好于CIA组和FLS组; CIA组和FLS组TNF-α、IL-1β、IL-6水平均高于正常对照组,MSC治疗组TNF-α、IL-1β、IL-6水平较CIA组和FLS组均有显著下降(P<0.05); TGF-β在对照组与CIA组间差异无统计学意义,但输注MSC后TGF-β得到上调(P<0.01)。结论UCMSCs移植能通过抑制炎性细胞因子TNF-α、IL-1β、IL-6, 上调抑炎细胞因子TGF-β来减轻CIA大鼠关节炎症和软骨破坏。
关键词:类风湿关节炎; 脐带间充质干细胞; 胶原诱导关节炎
类风湿关节炎(RA)是以慢性滑膜增殖和进行性关节破坏为特征的全身性自身免疫病,中国RA患病率为0.34%,患病人数达500万,严重危害人们的身体健康。脐带间充质干细胞(UCMSCs)是来源于中胚层的具有高度自我更新能力和多向分化潜能的多能干细胞。UCMSCs体外容易扩增,安全性较好,低免疫原性,且具有强大的免疫抑制功能,因此成为自身免疫病细胞治疗的首选细胞。有研究者[1-2]证实MSCs能抑制成纤维样滑膜细胞(FLSs)活化和增殖,从而改善关节炎症。本科对少数难治性RA患者试用了异体骨髓间充质干细胞移植治疗,取得了一定的疗效[3]。本研究探讨UCMSCs对于胶原诱导关节炎(CIA)模型的治疗作用,为临床进一步推广应用异基因UCMSCs移植治疗RA提供理论依据。
1资料与方法
1.1 实验材料
50只Wistar大鼠购自北京维通利华实验动物技术有限公司, 6~8周龄,在无菌层流环境中饲养和实验。饲料、饮水和垫料均经高压灭菌处理。脐带标本取自南京大学医学院附属鼓楼医院产科,2名顺产妇分娩后无菌剪取脐带组织。滑膜标本取自南京大学医学院附属鼓楼医院关节外科骨关节炎行膝关节置换术患者,共5例,其中男2例,女3例,年龄47~65岁,平均(56.80±7.16)岁,病程4~13年,平均(8.00±3.39)年。
1.2 主要试剂和仪器
DMEM/F12培养液、胎牛血清、0.25%胰酶购于美国Invitrogen公司,弗氏完全佐剂、弗氏不完全佐剂、牛Ⅱ型胶原、Ⅰ型胶原酶购自美国Sigma Alorich公司。大鼠TNF-α、IL-1β、IL-6、TGF-β ELISA试剂盒,鼠抗人异硫氰酸荧光素(FITC)-CD14、CD29、CD34、CD44、CD45、CD73、CD90、HLA-G单克隆抗体购自美国eBioscience公司。酶标仪购于美国BioTek公司。
1.3 实验方法
1.3.1UCMSCs的分离培养及鉴定:无菌条件下取脐带组织标本,剔除血管,撕取华通胶组织,剪至1 mm×1 mm×1 mm大小,加入少量10% FBS DMEM/F12培养液,每7 d更换一半培养液,第20天待培养瓶底爬出细胞,胰蛋白酶/EDTA 溶液消化细胞,按1∶3传代,当细胞培养至第3代,经消化重悬制成1×105/mL的单细胞悬液,流式细胞仪检测CD14、CD29、CD34、CD44、CD45、CD73、CD90、HLA-G等表面标记。
1.3.2FLSs分离培养:无菌条件下将滑膜组织标本锐性剪碎至约1 mm×1 mm×1 mm大小,加入2~3倍体积比1 mg/mL Ⅰ型胶原酶,避光于37 ℃摇动中消化4 h。经200目细胞滤网过滤组织块后, 1 000 r/min离心5 min, 去上清,加入适量10% FBS DMEM/F12培养液 ,吹打混匀后,于5% CO237 ℃培养箱中静置培养,每3~4 d更换培养液。当细胞生长至覆盖底面>80%时,弃培养液,加入胰蛋白酶/EDTA 溶液覆盖底面。显微镜下观察至大部分细胞变圆后终止消化, 1 000 r/min离心5 min, 弃上清,加入适量培养液吹打混匀后,按1∶3传代。当细胞培养至第3代,经消化重悬制成1×105/mL的单细胞悬液。
1.3.3CIA大鼠模型建立:无菌条件下,用0.05 mol/L冰醋酸充分溶解牛Ⅱ型胶原(CⅡ), 质量浓度为4 mg/mL。置4 ℃冰箱过夜后,与弗氏佐剂(CFA)等体积混合,振荡乳化,取乳化液滴入水中不扩散表示乳化充分,制成CⅡ乳剂(CⅡ终浓度为2 mg/mL)。乳化全程冰浴中操作。于雌性Wistar大鼠尾根部、背部两点皮内注射,总量100 μL。2周后同法100 μL加强注射。
1.3.4关节炎指数(AI)评分:采用AI评分法进行大鼠关节足肿胀评价。评分标准:0分,无关节肿胀; 1分,小趾关节稍红肿; 2分,趾关节和足趾肿胀; 3分,踝关节以下的足爪肿胀,严重红肿; 4分,包括踝关节在内全部足爪严重红肿,关节活动障碍。四肢的病变程度累积积分为AI,每只大鼠的最高分为16分。每3 d评价1次。
1.3.5大鼠分组处理:第0天予以皮内注射CII乳剂和弗氏完全佐剂混合液,第14天皮内注射CII乳剂和弗氏不完全佐剂混合液,第17天给予20只CIA大鼠尾静脉注射1×106UCMSCs(MSC组), 10只CIA大鼠尾静脉注射等量FLSs作为细胞对照组(FLS组), 10只CIA大鼠为疾病对照组(CIA组), 10只正常Wistar大鼠为正常对照组。第42天处死所有大鼠,外周血分离血清,踝关节HE染色。
1.3.6ELISA检测大鼠血清中细胞因子:大鼠处死前内眦静脉取外周血2 mL, 1 000 r/min离心10 min, 吸取上清,按ELISA试剂盒指示检测血清中TNF-α、TGF-β、IL-1β、IL-6水平。
1.4 统计学处理
数据以均数±标准差表示,采用SPSS 11.5软件进行统计学处理,采用GraphPad Prism5软件作图,多个样本均数间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2结果
2.1 UCMSCs鉴定
通过流式细胞仪对第3代UCMSCs表面标记物检测,结果示CD29、CD44、CD73和CD90阳性,HLA-G、CD14、CD34和CD45阴性,符合MSCs特征(图1)。
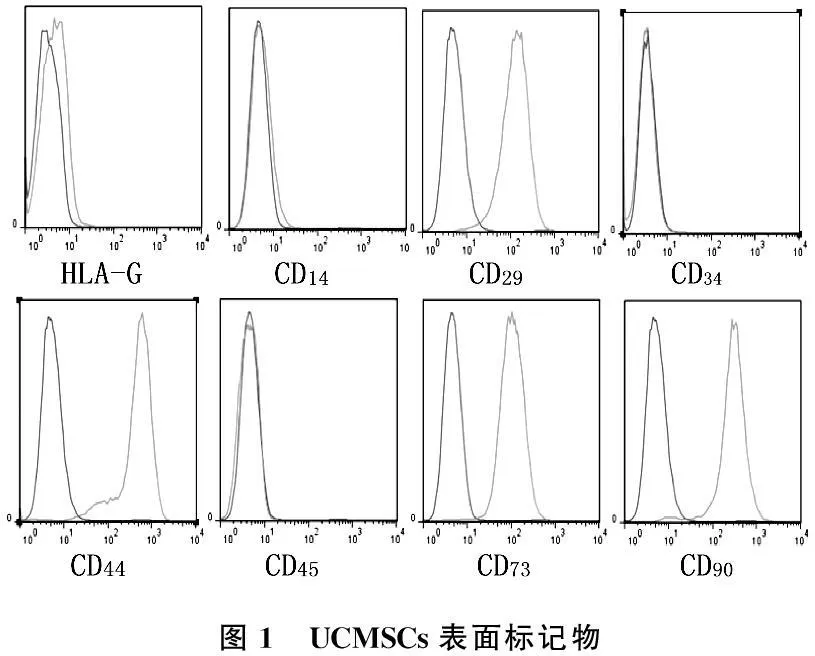
图1 UCMSCs表面标记物
2.2 各组CIA大鼠病情比较
CIA组关节肿胀明显,MSC治疗组关节肿胀程度低于CIA组和FLS组(图2);MSC组大鼠关节AI低于FLS组和CIA组(P<0.05)(图3); HE染色示CIA大鼠造模后踝关节出现炎性细胞浸润及关节腔狭窄,但MSC治疗组关节间隙明显好于CIA组和FLS组(图4)。
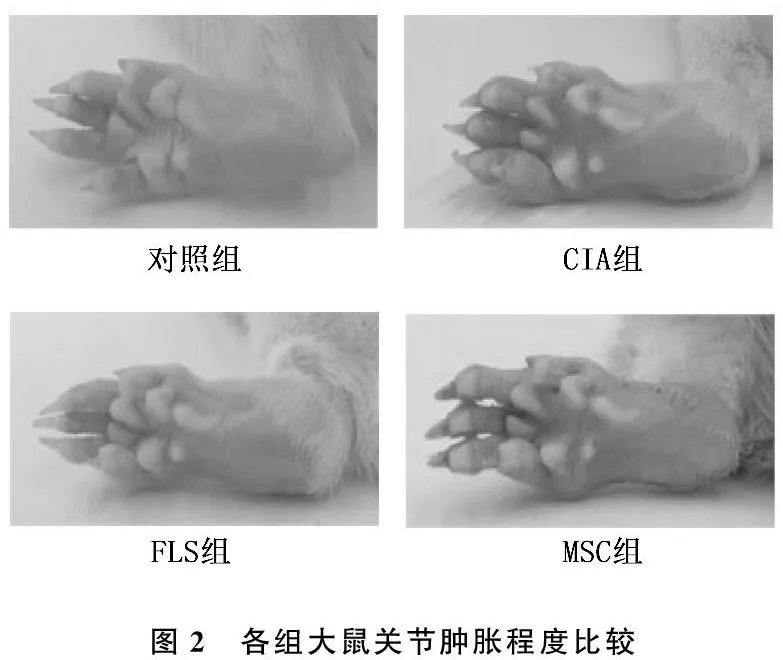
图2 各组大鼠关节肿胀程度比较

图3 各组大鼠关节AI比较
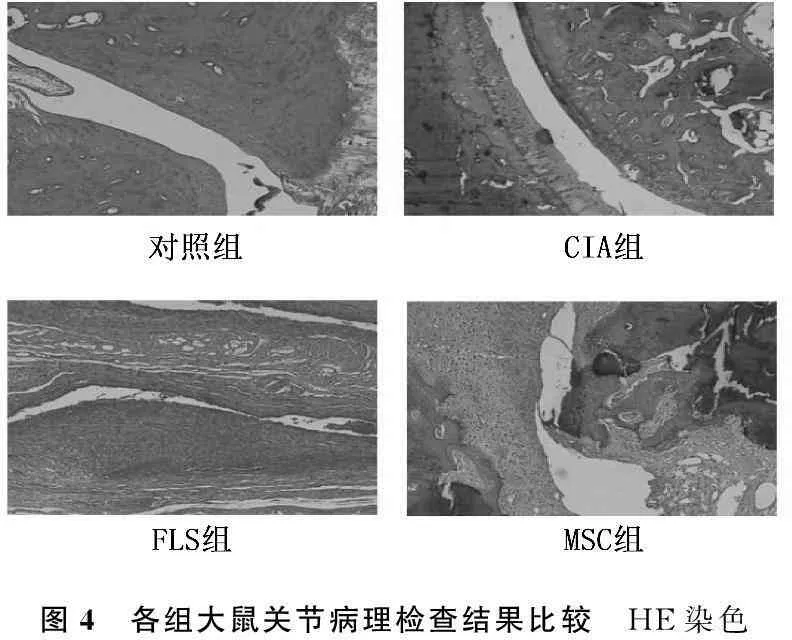
图4 各组大鼠关节病理检查结果比较 HE染色
2.3 大鼠外周血细胞因子水平
大鼠各组血清细胞因子TNF-α、IL-1β、IL-6、TGF-β平均值见表1。CIA组和FLS组TNF-α、IL-1β、IL-6水平均高于正常对照组,UCMSC治疗组TNF-α、IL-1β、IL-6水平较CIA组和FLS组均有显著下降(P<0.05)。MSC治疗组炎性细胞因子水平有显著下调,而FLSs则不能发挥下调作用。尽管抑炎性细胞因子TGF-β在正常与疾病鼠间无显著差异,但输注MSC后TGF-β得到上调(P<0.01)。
3讨论
RA的主要病变在关节,在关节内可以看到滑膜组织异常增生、大量炎症细胞浸润以及软骨和骨进行性破坏。目前RA治疗多采用甲氨蝶呤、来氟米特等慢作用药物,近年来生物制剂如TNF-α拮抗剂的应用提高了临床缓解率,使更多的患者受益。尽管诸多药物的应用和推广,临床上仍有部分患者病情难以控制,因此寻找新的治疗方法至关重要。MSCs可从骨髓、外周血、脐血、脐带、牙髓、脂肪组织等多种组织中分离。MSCs不表达HLA-DR和协同刺激分子CD80、CD86, 低表达MHC-I类分子,免疫原性低,移植治疗不会导致排斥反应,具有较好的安全性[4-5]。相比于其他来源的MSCs, UCMSCs表达多种胚胎干细胞的特有分子标志,具有分化潜力大、增殖能力强、取材方便等特征。体内和体外研究证实, UCMSCs具有免疫抑制能力,且该能力主要通过分泌可溶性细胞因子或细胞间直接接触来实现[6-7]。因此成为具有临床应用前景的多能干细胞[8]。既往研究[9-10]发现, UCMSCs能通过调节患者体内失衡的淋巴细胞亚群,从而有效改善系统性红斑狼疮、克罗恩病等多种自身免疫病。

表1 各组大鼠细胞因子TNF-α、IL-1β、IL-6、TGF-β水平比较 pg/mL
TNF-α是RA发病机制中居中心地位的促炎症性细胞因子,参与RA的发生发展过程。TNF-α通过活化转录因子NF-κB和MAPK途径上调多种致炎细胞因子、趋化因子、黏附分子和生长因子表达;促进血管翳的形成,并抑制调节性T细胞功能[11]; TNF-α还可促使滑膜成纤维细胞、巨噬细胞和软骨细胞产生IL-1、IL-8及TNF-α本身而加重组织损伤[12]; TNF-α还可直接诱导关节疼痛[13]。目前抗TNF-α治疗已广泛应用于RA临床治疗,取得了显著疗效。IL-1主要由单核巨噬细胞产生,它能促进滑膜细胞和淋巴细胞增殖和分化,促进滑膜细胞合成并释放前列腺素E2(PGE2)和胶原酶。PGE2和胶原酶引发滑膜炎症反应、软骨基质的崩解,而局部免疫复合物、游离的胶原等分解产物又可刺激IL-1的合成[14]。另外,IL-1能刺激滑膜细胞合成过量基质金属蛋白酶,包括胶原酶和基质溶素,后者能溶解破坏软骨基质[15]。因此, IL-1是破坏关节软骨的最重要的细胞因子之一。IL-1和TNF-α都能诱导IL-6的合成和分泌,与IL-1和TNF-α一样, IL-6也是RA关节炎症中主要的炎症介质。在RA中, IL-6的致病作用主要是增强IL-1和TNF-α的效应,促进白细胞活化和自身抗体产生,并与急性时相反应和贫血、脂质代谢紊乱等全身表现相关[16]。目前IL-6单克隆抗体已应用于难治性RA临床治疗,取得不错的临床疗效[17]。TGF-β是一种抑制炎症反应的调节因子,由多种细胞产生,主要进入关节滑膜,与基质成分结合在一起,发挥免疫抑制作用。TGF-β还可与细胞毒性T细胞相关抗原-4(CTLA-4)共同作用抑制免疫反应。TGF-β对T、B、巨噬细胞及其他细胞有多重抑制作用[18-19]。
本研究证实, CIA大鼠造模后踝关节出现炎性细胞浸润及关节腔狭窄,炎性细胞因子TNF-α、IL-1β、IL-6表达增高;经UCMSCs治疗后,CIA大鼠关节炎性肿胀减轻,关节间隙未见狭窄;炎性细胞因子TNF-α、IL-1β、IL-6表达下调,抑炎细胞因子TGF-β表达上调;以上结果提示UCMSCs能通过抑制炎性细胞因子,上调抑炎因子从而缓解关节炎症,减轻关节破坏。
参考文献
[1]Neumann E, Lefèvre S, Zimmermann B,et al. Rheumatoid arthritis progression mediated by activated synovial Fibroblasts[J]. Trends in molecular medicine, 2010, 16(10): 458.
[2]Liu Y, Mu R, Wang S,et al. Therapeutic potential of human umbilical cord mesenchymal stem cells in the treatment of rheumatoid arthritis[J]. Arthritis research & therapy, 2010, 12(6): R210.
[3]赵成, 孙凌云. 异基因骨髓间质干细胞移植治疗难治性类风湿关节炎1例[J]. 中华风湿病学杂志, 2010, 14(6): 75.
[4]Kikuchi-Taura A, Taguchi A, Kanda T, et al. Human umbilical cord provides a significant source of unexpanded mesenchymal stromal cells[J]. Cytotherapy, 2012,14 (4): 441.
[5]Prasanna S J, Gopalakrishnan D, Shankar S R, et al. Pro-inflammatory cytokines, IFNgamma and TNFalpha, influence immune properties of human bone marrow and Wharton jelly mesenchymal stem cells differentially[J]. PLoS One, 2010, 5(2): e9016.
[6]Girdlestone J, Limbani V A, Cutler A J, et al. Efficient expansion of mesenchymal stromal cells from umbilical cord under low serum conditions[J]. Cytotherapy, 2009, 11(6): 738.
[7]Weiss M L, Anderson C, Medicetty S, et al. Immune properties of human umbilical cord Wharton′s jelly-derived cells[J]. Stem Cells, 2008, 26(11): 2865.
[8]Scheers I, Lombard C, Paganelli M, et al. Human umbilical cord matrix stem cells maintain multilineage differentiation abilities and do not transform during long-term culture[J]. PLoS One, 2013, 8(8): e71374.
[9]Wang D, Zhang H, Liang J,et al. Allogeneic mesenchymal stem cell transplantation in severe and refractory systemic lupus erythematosus: 4 years of experience[J]. Cell transplantation, 2013, 22(12): 2267.
[10]Dalal J, Gandy K, Domen J. Role of mesenchymal stem cell therapy in Crohn′s disease[J]. Pediatric research, 2012, 71(4):445.
[11]Park H, Park S G, Kim J, et al. Signaling pathways for TNF production induced by human aminoacyl-tRNA synthetase-associating factor, p43[J]. Cytokine, 2002, 20(4): 148.
[12]Dayer J M. Interleukin 1 or tumor necrosis factor-alpha: which is the real target in rheumatoid arthritis[J]. The Journal of rheumatology, Supplement, 2002, 65: 10.
[13]Hess A, Axmann R, Rech J, et al. Blockade of TNF-α rapidly inhibits pain responses in the central nervous system[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(9): 3731.
[14]Kay J, Calabrese L. The role of interleukin 1 in the pathogenesis of rheumatoid arthritis[J]. Rheumatology(Oxford), 2004, 43(Suppl 3): 2.
[15]Dayer J M. The pivotal role of interleukin-1 in the clinical manifestations of rheumatoid arthritis[J]. Rheumatology(Oxford), 2003, 42(Suppl2): 3.
[16]McInnes I B, Schett G. The pathogenesis of rheumatoid arthritis[J]. The New England journal of medicine, 2011, 365(23): 2205.
[17]Nishimoto N, Yoshizaki K, Miyasaka N,et al.Treatment of rheumatoid arthritis with humanized anti-interleukin-6 receptor antibody: a multicenter, double-blind, placebo-controlled trial[J]. Arthritis and rheumatism, 2004, 50(6): 1761.
[18]Prud′homme G J, Piccirillo C A. The inhibitory effects of transforming growth factor-beta-1 (TGF-beta1) in autoimmune diseases[J]. Journal of autoimmunity, 2000, 14(1): 23.
[19]Chen W, Jin W, Wahl S M. Engagement of cytotoxic T lymphocyte-associated antigen 4 (CTLA-4) induces transforming growth factor beta (TGF-beta) production by murine CD4+T cells[J]. The Journal of experimental medicine, 1998, 188(10): 1849.
Effect observation of umbilical cord-derived
mesenchymal stem cells transplantation on
treatment of collagen-induced arthritis rats
ZHAOCheng,ZHANGLu,WANGHong,LIUBujun
(DepartmentofRheumatology,GulouHospitalAffiliatedtoMedicalSchoolofNanjing
University,Nanjing,Jiangsu, 210008)
ABSTRACT:ObjectiveTo investigate the effect of umbilical cord-derived mesenchymal stem cells (UCMSCs) transplantation on treatment of collagen-induced arthritis (CIA) rats. MethodsForty CIA model of Wistar rats were randomly divided into MSCs transplantation group (MSC group,n=20), cells control group (FLS group,n=10) and disease control group (CIA group,n=10), and 10 normal Wistar rats were selected as normal control group. AI score was used to evaluate the degree of joint swelling in CIA rats. 1×106UCMSCs or FLSs was given through intravenous injection from tail veil on the 17th day in the MSC group and the FLS group. On the 42nd day, rats were sacrificed and sera were got for detecting TNF-α, TGF-β, IL-1β and IL-6. Ankle joint was got for pathological evaluation of the narrowing degree. ResultsArthritis scores of the MSC group were significantly lower than those of the CIA group and the FLS group (P<0.05). HE staining showed that inflammatory cells infiltration and arthrostenosis were amiliorated by MSC. High serum levels of TNF-α, IL-1β and IL-6 were down-regulated through UCMSCs transplantation (P<0.05). There was no significant difference of TGF-β between the control group and the CIA group, but up-regulated after the infusion of UCMSCs (P<0.01). ConclusionUCMSCs transplantation can alleviate arthritis and cartilage damage in CIA rats by down regulating inflammatory cytokines of TNF-α, IL-1β, IL-6 and up regulating TGF-β.
KEYWORDS:rheumatoid arthritis; umbilical cord-derived mesenchymal stem cells; collagen-induced arthritis
基金项目:国家自然科学基金青年基金(81102258)
收稿日期:2014-12-21
中图分类号:R 684.3
文献标志码:A
文章编号:1672-2353(2015)09-001-04
DOI:10.7619/jcmp.201509001
论著
