转化生长因子-β1对新生大鼠星形胶质细胞结缔组织生长因子表达的影响
2015-02-24李合华宋志秀
李合华, 李 彤, 宋志秀
(新乡医学院第一附属医院 神经内科, 河南 卫辉, 453100)
转化生长因子-β1对新生大鼠星形胶质细胞结缔组织生长因子表达的影响
李合华, 李彤, 宋志秀
(新乡医学院第一附属医院 神经内科, 河南 卫辉, 453100)
摘要:目的观察转化生长因子(TGF-β1)对新生大鼠星形胶质细胞(Ast)结缔组织生长因子(CTGF)表达的影响。方法采用新生SD大鼠大脑皮层Ast,以FITC细胞免疫荧光鉴定后,用含0、1、2、4 ng/mL的TGF-β1分别干预培养24 h,分别用逆转录-聚合酶链反应(RT-PCR)和蛋白免疫印迹法(Wb)检测细胞中CTGF mRNA和蛋白的表达。结果TGF-β1能显著增加Ast中CTGF mRNA及蛋白表达;随着TGF-β1浓度的增加,CTGF mRNA和蛋白的表达量均有升高的趋势,差异有统计学意义(P<0.05)。结论TGF-β1能上调Ast中CTGF的表达,而该影响随TGF-β1浓度增加而显著,提示TGF-β1可以在一定程度上通过调节新生SD大鼠Ast CTGF表达导致神经胶质化。
关键词:星形胶质细胞; 神经胶质化; 转化生长因子-β1; 结缔组织生长因子
神经胶质细胞增生及胶质瘢痕形成是中枢神经系统(CNS)许多疾病损伤后病理修复的共同转归,其机制不明[1]。反应性胶质化是CNS损伤后组织开始修复的普遍病理现象,是Ast对损伤的应激反应[2]。转化生长因子-β1(TGF-β1)是脑损伤后反应性胶质细胞增生的重要因子,在周围组织纤维化疾病中起着关键作用[3],但其信号转导通路机制不明,在Ast中TGF-β1对结缔组织生长因子(CTGF)表达的诱导作用研究甚少。本研究采用RT-PCR和Wb方法观察了TGF-β1对新生SD大鼠Ast中CTGF mRNA和蛋白表达的影响,现报告如下。
1材料与方法
1.1 材料
新生SD大鼠由新乡医学院实验动物中心提供; RecombinantHumanTGF-β1、One-StepRT-PCR kit购自北京全式金生物技术有限责任公司; Rabbit anti-rat CTGF(兔抗大鼠CTGF)、HRP标记羊抗兔IgG均由美国santacruz公司生产,购自郑州宝科生物科技有限公司;其他化学试剂均为市售分析纯。
1.2 方法
1.2.1细胞培养:以McCarthy经典培养方法为基础,并加以适当改进。将新生1~3 d内的SD大鼠脱颈处死后浸泡于酒精中,无菌条件下取出大脑,仔细剔除脑膜及血管组织,去除海马,将大脑移入小玻璃瓶中,充分剪碎为1 mm3, 吸入离心管内, 1 500 r/min离心5 min, 弃上清液取沉淀,加入含20%胎牛血清制成DMEM悬液,吹打均匀。细胞计数后以1×105/mL的密度接种于一次性无菌培养瓶中,将培养瓶置于37 ℃、CO2体积分数为5%、湿度为95%的培养箱中培养。40 min后换培养瓶以去除成纤维细胞, 3 d后换液。培养9~14 d, 细胞融合后传代。传代4~8代后给予含不同浓度的TGF-β1(0、1、2、4 ng/mL)孵育。
1.2.2RT-PCR: 用RT-PCR法检测细胞中CTGF mRNA的表达。所有引物均由Primer Premier 5.0软件设计,上海生物工程公司合成。CTGF引物:上游: 5′-CCCGTTAGCCTCGCCTTGGT-3′, 下游: 5′-GGCAGTTGGCTCGCATCATAG-3′; GAPDH引物:上游: 5′-GTTCAACGGCACAGTCAA-3′,下游: 5′-GGCTAAGCAGTTGGTGGT-3′。以Trizol提取细胞总RNA,逆转录后,进行PCR扩增。PCR反应条件为: 94 ℃ 5 min→94 ℃ 30 s→55 ℃ 30 min→循环35→72 ℃ 10 min。琼脂糖电泳检测Smad2的扩增片段为110 bp, CTGF的扩增片段为571 bp, GAPDH的扩增片段310 bp。PCR扩增产物置于10 g/L琼脂糖凝胶电泳后,用ChemilnagerTM550型凝胶成像分析仪进行分析,用GeneTools软件进行电泳图像分析。以CTGF和GAPDH电泳条带OD值的比值来表示CTGF mRNA的相对表达量。
1.2.3Wb: 用Wb法检测细胞中CTGF蛋白的表达。用单去污剂裂解缓冲液溶解Ast, 缓冲液包括100 mg/L苯甲基磺酰氟(PMSF)、1 mg/L Aprotinin、10 g/L TritonX-100。溶解产物4 ℃、10 000 r/min离心10 min。蛋白定量用Bradford法测定。相同量的上清液以100 g/L SDS-聚丙烯酰胺凝胶电泳,分离的蛋白质转到PVDF膜,用含1 g/L Tween20和50 g/L小牛血清白蛋白(BSA)的TTBS(100 mmol/L pH 7.5 Tris-HCl和137 mmol/L NaCl)室温封闭2 h, 兔抗大鼠CTGF抗体(1∶400)4 ℃孵育过夜,辣根过氧化物酶结合的二抗(1∶4000)室温孵育2 h。ECL检测目的蛋白,暗室进行X光胶片曝光、显影、和定影。用图像分析仪(WEALTEC)扫描, Quantity One软件检测分析。计算各蛋白样品的蛋白质与GAPDH显色积分光密度比值ODFN/ODGAPDH。
2结果
2.1 TGF-β1对Ast中CTGF mRNA表达的影响
RT-PCR结果显示,与TGF-β1共同孵育后,体外培养的Ast细胞CTGF mRNA的表达水平显著升高,且随着TGF-β1浓度的增加, CTGF mRNA的表达量呈上升趋势,差异有统计学意义(P<0.01), 见图1、表1。
2.2 TGF-β1对Ast表达TGF蛋白的影响
与TGF-β1共同孵育后,体外培养的Ast细胞CTGF蛋白的表达水平显著升高,且随着TGF-β1浓度的增加,CTGF蛋白的表达量呈升高的趋势,差异有统计学意义(P<0.01), 见图2、表2。

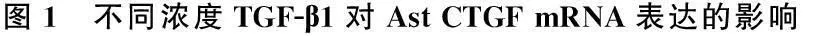
注: M. Marker; 1. 0 ng/mL; 2. 1 ng/mL;
3. 2 ng/mL; 4. 4 ng/mL
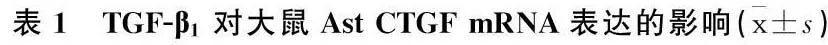
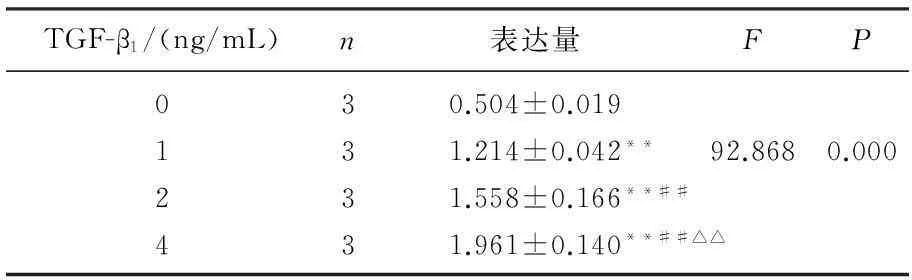
TGF-β1/(ng/mL)n表达量FP030.504±0.019131.214±0.042**92.8680.000231.558±0.166**##431.961±0.140**##△△
与加入0 ng/mL TGF-β1相比,**P<0.01;
与加入1 ng/mL TGF-β1相比, ##P<0.01;
与加入2 ng/mL TGF-β1相比, △△P<0.01。
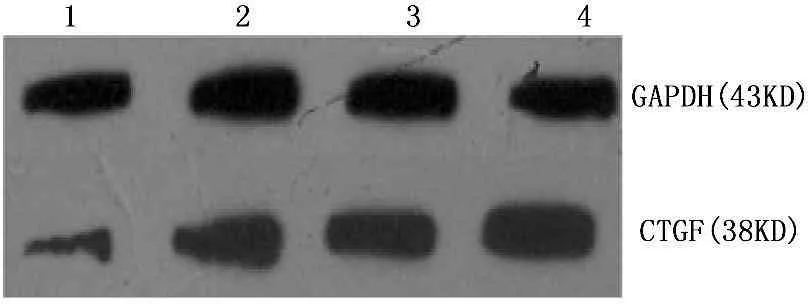
图2不同浓度TGF-β1对Ast CTGF蛋白表达的影响
注: 1. 0 ng/mL; 2. 1 ng/mL;
3. 2 ng/mL; 4. 4 ng/mL

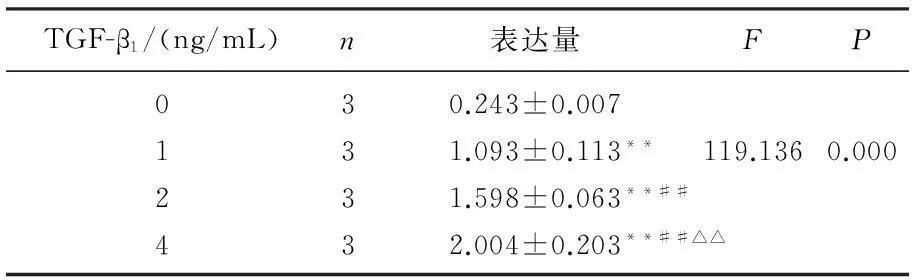
TGF-β1/(ng/mL)n表达量FP030.243±0.007131.093±0.113**119.1360.000231.598±0.063**##432.004±0.203**##△△
与加入0 ng/mL TGF-β1相比,**P<0.01;
与加入1 ng/mL TGF-β1相比,##P<0.01;
与加入2 ng/mL TGF-β1相比, △△P<0.01。
3讨论
TGF-β1是目前已知公认与外周纤维化关系最密切、最具代表性的生长因子[4], TGF-β1在CNS损伤后的过度表达引起人们的关注,但其作用机制尚未完全明确。反应性胶质化与皮肤胶质瘢痕形成及其他周围组织纤维化同属机体组织损伤后修复过程,且神经组织与皮肤同源于外胚层[5],其损伤后修复的病理生理学分子机制可能存在共性。考虑TGF-β1在CNS损伤后胶质化修复中起作用。
CTGF能够刺激成纤维细胞增殖、细胞外基质产生、肉芽组织形成和纤维化[6]。在人成纤维细胞中,重组CTGF诱导纤维连接蛋白mRNA的表达和蛋白质的合成,并呈剂量依赖性关系。CTGF中和性抗体可以显著降低但不能完全抑制这种作用。CTGF在增加ECM、促进血管形成等方面起到关键性的作用[7]。这些都与纤维化密切相关,说明CTGF是纤维化形成过程中的重要介质。CTGF能被数种因子转录激活,TGF-β1是其中最重要激活因子,主要通过Smad2/3途径、蛋白激酶C(PKC)和Ras/MEK/ERK信号转导途径,在基因水平上参与CTGF的转录和表达[8-9]。抗CTGF的抗体和反义CTGF可分别从蛋白水平和核酸水平特异性的阻断TGF-β对成纤维细胞的诱导作用[10]。本实验发现TGF-β1能够刺激Ast中CTGF的表达与合成,而且TGF-β1以剂量依赖性的方式提高CTGF mRNA和蛋白含量。因此,在CNS损伤后神经胶质疤痕形成机制中,TGF-β1是关键因子之一,CTGF是介导TGF-β1促纤维化作用的一个重要下游因子。
最近有研究报道[11],抗TGF-β治疗可以阻止纤维化的发生和发展,但由于TGF-β作用的靶细胞种类多,效应复杂,完全阻断其表达或活性的后果是难以预料的。CTGF表现出与TGF-β不同的生物学活性,作用比较单一,主要介导TGF-β的促纤维化作用,并且它只在间质细胞中表达,其作用也只局限于结缔组织[12]。因此,靶向CTGF治疗神经胶质细胞增生及胶质瘢痕形成不影响TGF-β其他功能,是一个较阻断TGF-β更有效和特异的靶点。
RNA干扰是最近发现和发展起来的新兴的基因阻断技术,它能高效、特异地阻抑细胞内源或外源性靶基因的表达[13-14]。研究[15]证实多种siRNA能诱导基因沉默,这提供了一种经济、快捷和高效的基因表达抑制技术手段,进一步研究拟采用RNA干扰技术调控神经胶质化,减少并发症及后遗症的发生,减轻其危害。
参考文献
[1]尹义国, 孙兆良, 冯东福. 小胶质细胞在颅脑外伤后胶质瘢痕形成过程中的作用[J]. 中华临床医师杂志(电子版), 2013, 7(12): 111.
[2]徐昊, 王占祥, 张绍林, 等. 反应性胶质细胞增生、神经炎症与脑积水关系的实验研究[J]. 中华小儿外科杂志, 2013, 34(12): 927.
[3]Shi J H, Guan H, Shi S, et al. Protection against TGF-β1-induced fibrosis effects of IL-10 on dermal fibroblasts and its potential therapeutics for the reduction of skin scarring[J]. Arch Dermatol Res, 2013, 305(4): 341.
[4]Rahmutula D, Marcus G M, Wilson E E, et al. Molecular basis of selective atrial fibrosis due to overexpression of transforming growth factor-β1[J]. Cardiovasc Res, 2013, 99(4): 769.
[5]Schwab J M, Beschorner R, Nguyen T D, et al. Differential cellular accumulation of connective tissue growth factor defines a subset of reactive astrocytes, invading fibroblasts, and endothelial cells following central nervous system injury in rats and humans[J]. J Neurotrauma, 2001, 18(4): 377.
[6]刘华, 杨华莲, 周淑芳, 等. 丹参酮ⅡA磺酸钠对瘢痕成纤维细胞增殖及转化生长因子β1和α平滑肌肌动蛋白mRNA及蛋白表达的影响[J]. 中华烧伤杂志, 2013, 29(3): 294.
[7]Cai Y, Yu S, Chen T, et al. EGCG inhibits CTGF expression via blocking NF-κB activation in cardiac fibroblast[J]. Phytomedicine, 2013, 20(2): 106.
[8]Romo L F, Sousa Vde O, Neto V M, et al. Glutamate activates GFAP gene promoter from cultured astrocytes through TGF-beta1 pathways[J]. J Neurochem, 2008, 106(2): 746.
[9]王文文, 程锦国. 纤维化疾病中的TGF-β/CTGF协同轴[J]. 山西中医学院学报, 2013, 14(1): 76.
[10]Hao C, Xie Y, Peng M, et al. Inhibition of connective tissue growth factor suppresses hepatic stellate cell activation in vitro and prevents liver fibrosis in vivo[J]. Clin Exp Med, 2014, 14(2): 141.
[11]陈蓉, 谢梅林. TGF-β/Smads信号通路在心肌纤维化发生和治疗中应用前景的研究进展[J]. 中国药理学通报, 2012, 28(9): 1189.
[12]车丽双, 黄荣桂. TGF-β1与CTGF在肾间质纤维化中的作用[J]. 医学综述, 2013, 19(4): 624.
[13]Lieberman J, Sharp P A. Harnessing RNA Interference for Therapy: The Silent Treatment[J]. JAMA, 2015, 313(12): 1207.
[14]Castel S E, Martienssen R A. RNA interference in the nucleus: roles for small RNAs in transcription, epigenetics and beyond[J]. Nature Reviews Genetics, 2013, 14(2): 100.
[15]李凤燕, 欧瑜, 李谦. siRNA作为小分子药物的研究进展[J]. 药物生物技术, 2014, 21(4): 381.

Influence of transforming growth factor-β1on
expression of connective tissue growth factor
in astrocytes in neonatal rat
LI Hehua, LI Tong, SONG Zhixiu
(DepartmentofNeurology,TheFirstAffiliatedHospitalofXinxiangMedicalUniversity,
Weihui,Henan, 453100)
ABSTRACT:ObjectiveTo observe the infhuence of transforming growth factor (TGF-β1) on connective tissue growth factor (CTGF) in astrocytes (Ast cells) of neonatal rat. MethodsAst cells were separated from neonatal SD cerebral cortex of rat and identified by FITC immunofluorescence. Ast cells were incubated in TGF-β1 for 24 hours. Concentrations of TGF-β1used in the test were 0, 1, 2 and 4 ng/mL. After that reverse transcription-polymerase chain reaction and western blot were performed to defct the mRNA and protein expressions of CTGF. ResultsTGF-β1increased the mRNA and protein expressions of CTGF and the expressions up regulated along with the elevated concentrations of TGF-β1showed a significant difference (P<0.05). ConclusionTGF-β1increased the expression of CTGF in Ast cells in a concentration-dependent manner, indicating that TGF-β1can increase the expression of CTGF in Ast cells within a certain range that induces reactive astrogliosis in neonatal SD rats.
KEYWORDS:astrocytes; reactive astrogliosis; transforming growth factor -β1; connective tissue growth factor
通信作者:李彤, E-mail: litong0833@163.com
基金项目:河南省科技厅资助项目(082102310015, 112101310400)
收稿日期:2014-12-22
中图分类号:R 338.2
文献标志码:A
文章编号:1672-2353(2015)09-005-04
DOI:10.7619/jcmp.201509002
