乳腺腺肌上皮病临床病理分析
2015-02-24苏才丽四川省自贡市第四人民医院病理科643000
苏才丽 王 勇 四川省自贡市第四人民医院病理科 643000
乳腺腺肌上皮病临床病理分析
苏才丽王勇四川省自贡市第四人民医院病理科643000
摘要目的:探讨乳腺腺肌上皮病(Adenomyoepithelial adenosis,AMEA)的临床病理特点、诊断及治疗预后。方法:应用光镜观察及免疫组化染色对乳腺腺肌上皮病进行分析,并复习相关文献。结果:乳腺腺肌上皮病的临床及影像学无特征性改变,组织学形态为增生的腺上皮及肌上皮构成管腔,增生的肌上皮可弥漫假浸润于间质中,腺上皮免疫组化表达P-CK、EMA、ER、PR,肌上皮则表达P63、SMA、desmin、 Calponin、S-100、maspin。结论:AMEA是一种罕见病变,为良性病变,也有局部复发和恶变的可能。
关键词乳腺腺肌上皮病病理
乳腺腺肌上皮病(Adenomyoepithelial adenosis,AMEA)是一种罕见的特殊类型的乳腺腺病,该病存在腺上皮及肌上皮明显增生,由于临床病例少、临床表现不典型,容易与乳腺其他肿瘤相混淆。2003年WHO分类中也将其定义为一种极少见的腺病类型,与乳腺腺肌上皮瘤有关,AMEA多数情况为良性,但也有局部切除后复发的可能,极少数情况下可发生恶变、转移。因其特殊的病理性特点及生物学行为,需进一步深入认识。现报道乳腺AMEA,结合文献就其临床病理特征、鉴别诊断及预后进行探讨。
1资料与方法
1.1临床资料例1,女性,30岁,以右乳胀痛为主要表现,不伴乳头溢血、溢液等。查体:右乳质地欠均匀,未扪及明显肿块。B超示右乳见大小0.2cm囊性占位并周围回声不均。临床诊断:右乳腺病。术中冰冻报告:乳腺AMEA。
例2,女性,35岁,以右乳头溢血3+月,偶伴疼痛。查体:右乳头偏大,质硬,表面轻度肿大,挤压右乳头中央见3根导管溢出少量鲜红色液体,右乳未扪及确切包块。B超示右乳头导管扩张0.8cm,乳腺实质回声不均。临床诊断:右乳腺导管内乳头状瘤?术中冰冻报告:乳腺AMEA伴导管内乳头状瘤。
1.2方法2例标本均由4%中性甲醛固定,常规脱水、透明、浸蜡、包埋、切片、HE染色,免疫组化染色使用EnVision 两步法。使用一抗包括:P63、SMA、desmin、 Calponin、P-CK、 EMA、 ER、 PR均购自福州迈新公司。
2结果
2.1巨检例1灰白灰黄组织一块3cm×2.5cm×2cm,切面灰白灰黄,边界不清,见直径0.2cm囊肿。例2 线栓组织一块4cm×3cm×1.5cm,线栓处呈细颗粒状,灰白,质中,边界不清。
2.2镜检2例标本中均见乳腺小叶内腺管明显增生,部分腺管扩张、部分腺管因挤压而狭窄(图1)。腺管内有增生的腺上皮及肌上皮,以肌上皮增生显著。增生的肌上皮呈条索状假浸润于纤维组织中(图2)。例1标本中伴有囊性增生;例2标本中伴有腺上皮呈乳头状增生(图3)。腺上皮呈柱状,胞浆嗜酸性,核圆形,未见明显病理性核分裂。肌上皮呈多边形或梭形,胞浆透明,核小而圆,未见明显异型性。
2.3免疫组化2例腺上皮P-CK(图4)及EMA均(+),ER及PR均(+), P63、SMA、actin、 Calponin均(-)。肌上皮P63(图5)及SMA(图6)均(+),P-CK、 EMA、 ER、 PR、desmin(-),例1肌上皮 Calponin (+),例2 Calponin(-)。
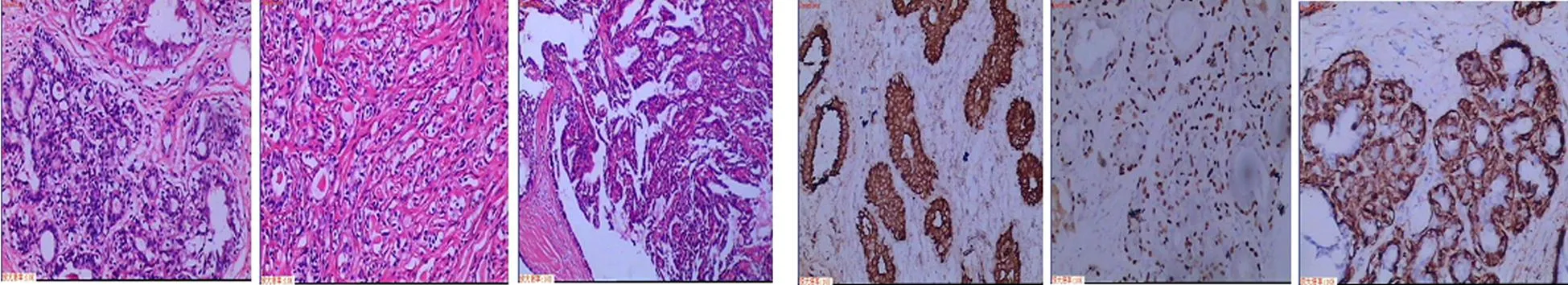
图1乳腺腺管增生图2乳腺腺管肌上图3腺上皮乳头 图4腺上皮细胞图5肌上皮细胞图6肌上皮
及扩张皮增生状增生P-CK(+)P63(+)SMA(+)
3讨论
3.1背景和临床特点乳腺腺肌上皮腺病于1984年Kiaer等做了首例报道,且将它命名为乳腺腺病的一个独特的形式,它与乳腺腺病有众多类似处但也有一个显著的区别:乳腺腺肌上皮腺病有明显的肌上皮细胞增生,而乳腺腺病则无。迄今为止,国内外仅见13例报道。AMEA主要发生于40岁以下中青年女性,尚未见男性发病报道,病变范围1.5~5cm[1],病程发展缓慢,有学者报道AMEA容易发展为乳腺癌[2]。AMEA临床表现无特异,可无症状或仅表现为乳腺腺病的特点,当与腺肌上皮腺瘤同时存在时,则可触及无痛性肿块。本文中一例表现为腺病,另一例因伴有导管内乳头状瘤而表现为乳头溢血。
3.2影像学特点由于AMEA发病率低,其影像学特征很少,B超可表现为不规则低回声团块伴多个小囊肿[3]、或为不规则团块伴后方声影[2,4],后者提示AMEA与乳腺癌相关。以上B超表现同样可以见于乳腺腺病及纤维囊性病、纤维腺瘤。由于缺乏特征的影像学表现及细针穿刺的局限性使AMEA术前诊断非常困难。
3.3病理学特点巨检:病变通常呈切面灰白、灰黄色,可见散在的小囊及不规则白色点片状区域,边界不清,似恶性病变[5]。当存在恶性变时,部分组织灰白,质硬,似蟹足样浸润可伴有坏死、出血。镜检:病变无包膜或有薄的纤维性假包膜,增生的腺管由腺上皮及肌上皮堆积于管腔中,其中以肌上皮增生最为明显。肌上皮呈片状、巢状、小梁或条索状分布,内含多少不等的腺体,与周围组织界限不清,似“浸润”在胶原纤维之间,呈假浸润图像,病变周围可见纤维囊性病表现。AMEA常与腺肌上皮瘤混合存在[5]。AMEA的腺上皮和肌上皮的细胞形态、排列方式与乳腺腺肌上皮瘤相同,腺上皮由低柱状或立方状细胞组成,位于腺腔内侧或细胞巢中部,胞质嗜酸性,构成管状和乳头状结构的腺腔,腺腔内可见分泌物,PAS染色阳性。肌上皮细胞呈多边形或梭形,胞质淡染,核圆形至细长形、无异型,核仁小,胞质透明,富于糖原。肌上皮细胞在分叶状结构中表现为不同,可呈透明、嗜酸性和含玻璃样小体(浆细胞样),通常构成管状结构的外层或实性区域[6]。本组病例中,腺肌上皮腺病与乳腺纤维囊性病混合存在,包括伴导管内乳头状瘤1例及囊性增生1例,而与之前报道不同[2]。在共存疾病方面的差异的原因可能是本例患者就诊时处于疾病之初尚未形成腺肌上皮瘤。
免疫组织化学检测有助于AMEA的诊断,在AMEA中腺上皮细胞表达P-CK、EMA、ER、PR,而肌上皮细胞则不表达。肌上皮细胞表达P63、SMA、desmin、 Calponin、S-100、maspin等肌上皮标记物。
3.4鉴别诊断AMEA同时存在腺上皮及肌上皮的明显增生,应与以下疾病相鉴别:(1)腺肌上皮腺瘤:该肿瘤为AMEA过度增生形成的肿瘤,同样具有腺上皮及肌上皮的明显增生,但该肿瘤形成确切包块,而AMEA无明显肿块。(2)纤维囊性病:病变多样,可呈现腺病、囊肿、大汗腺化生等,却以腺上皮增生为主也可以伴有肌上皮的局部增生;AMEA虽可伴有小囊肿及腺上皮乳头状增生但仍以肌上皮增生为主。(3)乳腺富含透明细胞的肿瘤:诸如乳腺肌上皮癌、分泌性肿瘤、富于糖原及脂质的肿瘤等,这些肿瘤可以通过PAS等特殊染色及免疫组化与AMEA相鉴别。
3.5治疗与预后AMEA经局部完整切除后多数能治愈;但它也有局部复发和恶变的可能,因此,治疗方式不同于乳腺腺病和乳腺纤维腺瘤,部分学者认为应该手术扩大切除及术中冰冻确定切缘无病变。如果切除不彻底可在数年至数十年后转变为良性或恶性腺肌上皮腺瘤[2]。也有复发后仍AMEA的报道[6]。所以,术后应定期随访。若AMEA伴有乳腺癌则应行乳腺根治术,必要时行淋巴结清扫。本组患者均行局部切除,随访至今未见复发。
参考文献
[1]Li PF, Xu JG, Yu F,etal.Ultrasonographic features of adenomyoepithelial adenosis: a case report and literature review〔J〕. Int J Clin Exp Med,2014,7(4):1166-1168.
[2]Tsuda H,Mukai K,Fukutomi T,etal.Malignant progression of adenomyoepithelial adenosis of the breast〔J〕. Pathol Int,1994,44(6):475-479.
[3]Maeda H,Yokoi S,Nakazawa M,etal.Adenomyoepithelial adenosis associated with breast cancer: a case report and review of the literature〔J〕.Springerplus,2013,2(1):50.
[4]Erel S,Tuncbilek I,Kismet K,etal.Adenomyoepithelial Adenosis of the Breast: Clinical,Radiological, and Pathological Findings for Differential Diagnosis〔J〕.Breast Care (Basel),2008,3(6):427-430.
[5]付丽,郭晓静,陈凌,等. 乳腺腺肌上皮腺病及腺肌上皮瘤〔J〕. 临床与实验病理学杂志,2006,(1):6-8.
[6]高晓磊,耿建祥,徐文华,等. 乳腺腺肌上皮瘤的临床病理学观察〔J〕. 临床与实验病理学杂志,2008,24(2):162-165.
(本文通讯作者:苏才丽)
(编辑羽飞)
收稿日期2014-08-26
中图分类号:R737.9
文献标识码:B
文章编号:1001-7585(2015)06-0805-03
