天然油脂和表面活性剂对发酵性丝孢酵母产油脂及脂肪酶的影响
2015-02-23张毅,孙晓璐,侯英敏,孙玉梅
张 毅,孙 晓 璐,侯 英 敏,孙 玉 梅
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
脂肪酶(EC 3.1.1.3)是一类能在油水界面上催化长链甘油酯水解和合成的羧酸酯酶[1]。在微生物合成油脂过程中,脂肪酶的可逆作用即脂质合成对生长、繁殖、积累养分有重要作用[2]。目前对于发酵过程中细胞内脂肪酶活力变化与油脂积累关系的报道很少,有研究表明酵母细胞内脂肪酶活力增加有利于细胞油脂积累[3]。
天然油脂中含有大量合成脂肪酸的中间物质,对微生物产油有促进作用[4]。大多数微生物只有在油类或者与油类相关物质存在时才能产生脂肪酶[5]。许多研究表明发酵培养基中添加一定量的油脂如花生油、豆油、橄榄油等可以不同程度地促进菌体产油和产酶[6-8]。表面活性剂可解除油脂存在使发酵系统供氧不足而抑制微生物生长和代谢,增加微生物和酶与油脂的接触机会[9],使微生物充分利用油脂进行发酵。阳离子型表面活性剂CTAB、非离子表面活性剂Tween 80 和阴离子表面活性剂SDS,可促进微生物生产油脂[10]。此外,表面活性剂对菌体产脂肪酶也有比较明显的影响,一般来说,非离子表面活性剂有促进作用,阴离子表面活性剂主要起抑制作用[11]。
因此,研究油脂和表面活性剂对微生物产油脂的影响,对微生物合成油脂的代谢调节具有重要的意义。本文考察了天然油脂和表面活性剂对发酵性丝孢酵母产油脂及脂肪酶的影响,并初步探讨酵母细胞内脂肪酶活力与油脂产量的关系。
1 材料与方法
1.1 菌 种
发酵性丝孢酵母(Trichosporonfermentans):CICC1256,购自中国食品发酵工业研究院。
1.2 主要仪器、试剂
仪 器:JB-4A 磁力搅拌器、RZ-UVA2000-CC07组织捣碎机、LDZX-40数显恒温水浴锅等。
试剂:大豆油,食用级;猪油,食用级;香河溢达油脂有限公司生产;Tween 80,分析纯,石家庄海森化工有限公司生产;洗洁精,广州奥奇丽有限公司生产;其余试剂均为分析纯或生物试剂。
1.3 培养基
固体斜面培养基(g/L):葡萄糖20.0,酵母粉10.0,蛋白胨10.0,琼脂20%,pH 自然,于1.0×105Pa灭菌15min。
液体种子培养基(g/L):葡萄糖100.0,蛋白胨5.3,酵母膏2.0,MgSO40.5,pH 自然,于0.8×105Pa 灭菌20 min,尿素2.0,于0.5×105Pa灭菌15min。
发酵培养基(g/L):葡萄糖100.0,蛋白胨1.8,酵母膏0.5,KH2PO42.0,pH 自然,于0.8×105Pa灭菌20min。
1.4 实验方法
1.4.1 培养方法
将4 ℃保存的酵母菌种接种于固体斜面上,在30 ℃下活化培养3d后转接至液体种子培养基中,于30 ℃、160r/min摇床中培养,待种子长好后,接入发酵培养基,于30 ℃、160r/min摇床中进行发酵。
1.4.2 天然油脂对发酵的影响
在发酵培养基灭菌前加入不同浓度大豆油和体积分数为1.0%的猪油,发酵过程中定期取样检测细胞油脂含量和胞内脂肪酶活力。
1.4.3 表面活性剂对发酵的影响
在发酵培养基中灭菌前加入1.0%大豆油,并分别添加0.5%、1.0% Tween 80,0.5%、1.0%洗洁精,发酵过程中定期取样检测细胞油脂质量分数和胞内脂肪酶活力。
1.4.4 生物量测定
采用细胞干重法[12]。
1.4.5 细胞油脂质量分数测定
采用酸热法[13]。
1.4.5.2 细胞油脂提取
采用乙醚-石油醚法[14]。用定量无水乙醇将破碎的细胞移入100mL具塞量筒中,加入15mL乙醚,充分混匀,静置分层,用移液管吸取醚液层放入烧杯,在水浴上蒸出醚,得到油脂,于80℃干燥2h,冷却后称重。
w(油脂)=油脂质量/干菌体质量×100%
1.4.6 粗酶液制备
在发酵过程中,定时取发酵液,于6 000r/min离心10min,收集菌体,称取2g菌体与50mL磷酸缓冲溶液混合,在冰水浴中超声破碎(破碎功率1 200 W,破碎时间30min,间隔时间10s),收集细胞破碎液,离心取上清液,即为粗酶液。
1.4.7 酶活力测定
臀肌挛缩症在我国发病率比较高,但是其发病机制还不十分明确。常见原因是由于臀部注射了含有苯甲醇作为溶剂的青霉素形成臀部肌肉表面的挛缩带所致[4]。患者往往不能并腿下蹲、不能跷二郎腿,并且髋部常出现弹响。臀肌挛缩症给广大患者造成了很大的身心压力。既往多采用切开松解挛缩带的方法治疗臀肌挛缩症。但是手术的切口大,不美观。近年由于关节镜微创手术的逐步普及,我国刘玉杰教授等率先开始采用关节镜进行关节外应用[5]。关节镜微创手术治疗臀肌挛缩症就是关节镜关节外应用的一大创举[5~8]。
采用酸碱滴定法定量测定[14]。
脂肪酶活力定义:在测定条件下,每分钟释放1μmol脂肪酸所需的酶量为一个酶活力单位(U)。
2 结果与讨论
2.1 天然油脂对发酵性丝孢酵母发酵产油脂及脂肪酶活力的影响
2.1.1 天然油脂对细胞油脂质量分数的影响
由图1可知,在添加不同天然油脂的条件下,细胞油脂质量分数随发酵时间延长而逐渐增大,发酵72h达到最大。发酵过程中以培养基中加入体积分数为1.0%大豆油时细胞油脂质量分数最大,最大值为30.7%;加入猪油时,细胞油脂质量分数最大值仅为21.6%。
2.1.2 天然油脂对胞内脂肪酶活力的影响
由图2可知,各条件下的细胞内脂肪酶活力变化无明显规律;整个发酵过程中几乎均以加入体积分数为1.0%大豆油时脂肪酶活力最高,发酵60h达到峰值347.5U/mL;加入体积分数为1.0%猪油发酵72h 脂肪酶活力才有最大值247.5U/mL,比添加大豆油时脂肪酶活力低,达到最大脂肪酶活力所需时间长。
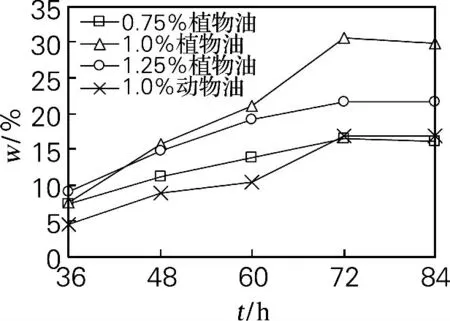
图1 天然油脂对细胞油脂质量分数的影响Fig.1 Effects of natural oils on lipid content in cells
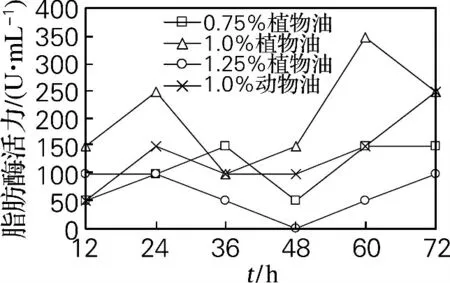
图2 天然油脂对菌体脂肪酶活力的影响Fig.2 Effects of natural oils on intracellular lipase activity
实验表明,添加适量大豆油更有利于细胞产油和产酶。这是因为大豆油中含有大量C12~C18等不同链长的脂肪酸[15],其中部分脂肪酸组成与菌体油脂中脂肪酸组成有一定的相似性[16],可被菌体吸收作为合成油脂的中间物,有利于细胞积累油脂[17],但过多加入会影响溶解氧以至于影响菌体产脂和产酶[18]。猪油对细胞产油脂及产酶的提高效果不如大豆油。
2.2 表面活性剂对发酵性丝孢酵母产油脂及脂肪酶活力的影响
2.2.1 表面活性剂对细胞油脂质量分数的影响
由图3可知,在添加不同表面活性剂的条件下,细胞油脂质量分数随发酵时间延长呈上升趋势,发酵72h达到最大。Tween 80 对细胞产油提升效果强于洗洁精。添加低浓度Tween 80对细胞产油有利,最适添加量为0.5%(体积分数),细胞最大油脂产量为30%;加入洗洁精时细胞最大油脂产量仅为14.3%。

图3 表面活性剂对细胞油脂质量分数量的影响Fig.3 Effect of surfactant on lipid content in cells
2.2.2 表面活性剂对胞内脂肪酶活力的影响
由图4可知,发酵培养基中加入Tween 80对细胞产酶促进效果比洗洁精好。加入低浓度表面活性剂可在较短时间内达最大产酶活力。Tween 80最适添加量为0.5%(体积分数),发酵24h脂肪酶活力即达最大值297U/mL。加入洗洁精后最高脂肪酶活力仅为148.5U/mL。
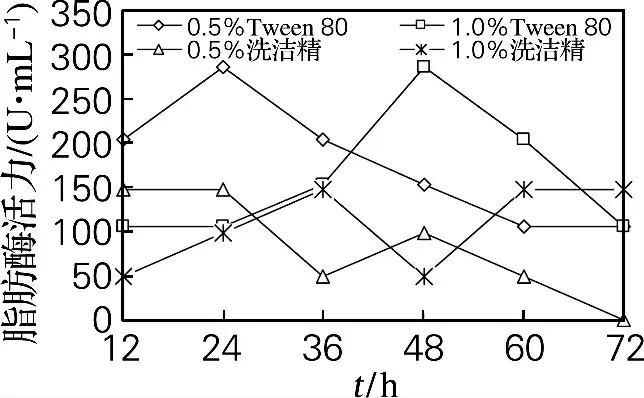
图4 表面活性剂对菌体脂肪酶活力的影响Fig.4 Effect of surfactant on intracellular lipase activity
以上结果表明,培养基中应加入体积分数为0.5%的Tween 80 可促进细胞油脂积累和产胞内脂肪酶。这是由于Tween 80可使大豆油与发酵液能更均匀混合,可增强脂肪酶活力以及菌体发酵产油脂的正效应[9];同时能增加细胞膜的通透性,有助于菌体对大豆油的吸收,使油脂积累效果更明显[8,16]。低浓度表面活性剂有利于细胞较快积累油脂和产酶,可能高浓度表面活性剂对微生物代谢有一定的抑制作用。
2.3 酵母细胞脂肪酶活力与油脂产量关系的研究
通过对比图1和图2,加入体积分数为1.0%大豆油的培养基,细胞油脂产量与胞内脂肪酶活力均为最大;在发酵48~72h期间,脂肪酶活力提高最快,细胞油脂积累也最大,说明胞内脂肪酶活力增加对细胞积累油脂有促进作用。由图3和图4可得,培养基中加入Tween 80 时细胞中最大油脂产量和最高产酶活力均比加入洗洁精时高,表明细胞油脂含量与胞内脂肪酶活力呈现出一定正相关性。
3 结 论
(1)发酵培养基加入体积分数为1.0%的大豆油或0.5%的Tween80 对发酵性丝孢酵母产油和产酶有促进作用,最大油脂质量分数分别为30.7%,30%,最大脂肪酶活力分别为347.5,297U/mL。
(2)低浓度表面活性剂对菌体产油和脂肪酶更有利。
(3)发酵性丝孢酵母细胞中脂肪酶活力增加对细胞油脂积累有促进作用。
[1]王迪,曹方,栾静,等.超声波破碎法提取发酵性丝孢酵母胞内脂肪酶的条件优化[J].大连工业大学学报,2012,31(6):405-408.(WANG Di,CAO Fang,LUAN Jing,et al.Optimization of ultrasonic disruption for lipase extraction fromTrichosporonfementans[J].Journal of Dalian Polytechnic University,2012,31(6):405-408.)
[2]忻耀年.酶生物技术在油脂工业中的应用(1)[J].陕西粮油科技,1995,20(4):899-902.
[3]孙晓璐,孙玉梅,陈莉,等.不同酵母菌发酵产油脂及脂肪酶的研究[J].粮油加工,2007(8):80-82.
[4]KATARINA J,MATIC L.The influence of metal ions on malic enzyme activity and lipid synthesis inAspergillusniger[J].Microbiology Letters,2002,217(2):185-190.
[5]刘洪伟,许喜林,李晓凤.Tween 80 诱导下米曲霉3.5232产胞内脂肪酶的研究[J].现代食品科技,2012,28(8):911-914.
[6]相光明,刘建军,赵祥颖,等.微生物油脂研究进展[J].粮油加工,2008(9):56-60.
[7]孙舒扬,王栋,徐岩.固液态发酵中橄榄油对Rhizopuschinensis全细胞脂肪酶的影响[J].微生物学通报,2006,33(4):10-14.
[8]关雯洁,鲍时翔,姚汝华,等.添加植物油对发酵生产γ-亚油酸的影响[J].中国油脂,1998,23(1):39-41.
[9]秦 华 明,尹 华,梁 世 中,等.Tween-80 和 H2O2对Burkholderiacepacia降解油脂的影响[J].环境工程学报,2007,1(4):18-19.
[10]郑毅,施巧琴,吴松刚.碱性脂肪酶与表面活性剂相互作用的研究[J].工业微生物,2000,30(2):4-7.
[11]孙国龙,陈丽,黄金,等.表面活性剂对酶活性的影响研究进展[J].西部皮革,2013(10):24-29.
[12]李建武,余端元,袁明秀.生物化学实验原理和方法[M].北京:北京大学出版社,1994:19.
[13]孙晓璐,孙玉梅,曹方,等.对产油脂酵母的细胞破碎方法及油脂提取效果的比较[J].河南工业大学学报,2007,28(4):67-69.
[14]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23535—2009 脂肪酶制剂[S].北京:中国标准出版社,2009.
[15]施安辉,周波.粘红酵母GLR513 生产油脂最佳小型工艺发酵条件的探讨[J].食品科学,2003,24(1):48-51.
[16]林炜铁,朱敏.植物油对被孢霉菌发酵生产花生四烯酸的影响[J].现代食品科技,2007,23(11):16-18.
[17]咸漠,甄明,康亦兼,等.深黄被孢霉生物转化十六醇合成油脂的研究[J].高等化学学报,2000,21(7):1108-1109.
