野野村放线菌Nonomuraeasp.ATCC 39727脂肪酸的GC-MS分析
2015-02-23张广昊,董天飞,陈明,高子晴,张春枝
张 广 昊,董 天 飞,陈 明,高 子 晴,张 春 枝
(1.大连工业大学 生物工程学院,辽宁 大连 116034;2.赤峰工业职业技术学院,内蒙古 赤峰 024005)
0 引 言
A40926 是由野野村放线菌(Nonomuraeasp.)ATCC 39727产生的新型天然脂糖肽类抗生素,生物活性显著,能够有效抑制革兰氏阳性耐药菌[1]。以A40926为前体制备的新型半合成脂糖肽抗生素Dalbavancin目前正处于Ⅲ期临床研究阶段[2]。A40926为一组结构相近的因子组成的复合物,其中各因子均含有交联七肽架构、2个氯原子、一个甘露糖和一个疏水脂酰侧链,区别在于疏水脂酰侧链不同[1,3-4]。研究表明,疏水脂酰侧链的引入显著增强了脂糖肽类抗生素的抗菌活性,延长了药物在生物体内的滞留时间[5-6]。
Nonomuraeasp.ATCC 39727体内A40926疏水脂酰侧链来源的研究引起人们很大的兴趣,然而对参与A40926 合成的基因簇(命名为dbv基因)功能分析,发现其中并不包含疏水脂酰长链的合成基因[7]。Beltramatti[8]和Jovetic[9]等研究发现,生成A40926各因子的比例和Nonomuraeasp.ATCC 39727细胞脂肪酸组成在量上存在相关性,推测可能是细胞长链脂肪酸经β-氧化缩短后生成了A40926因子的脂酰侧链。
为进一步探究Nonomuraeasp.ATCC 39727细胞脂肪酸和A40926因子的脂酰侧链之间的内在关联,首先需要对Nonomuraeasp.细胞脂肪酸组成进行分析。野野村放线菌Nonomuraeasp.ATCC 39727 作为一个微生物新种,对其菌种特性的研究报道目前尚不多见[10-11]。本研究利用气质联用色谱(GC-MS)对Nonomuraeasp.ATCC 39727 脂肪酸组成进行分析,建立了Nonomuraeasp.ATCC 39727 脂肪酸的分析方法,为进一步阐明Nonomuraeasp.ATCC 39727细胞脂肪酸和A40926脂酰侧链之间的内在关联奠定研究基础。
1 材料与方法
1.1 菌 种
A40926 产生菌Nonomuraeasp.ATCC 39727,由上海医药工业研究院陈少欣研究员馈赠,本实验室保藏。
1.2 培养基
ISP2斜面及平板培养基(g/L):葡萄糖4.0,酵母提取物4.0,麦芽提取物10.0,琼脂20.0,pH 7.0。
液体培养基(g/L):葡萄糖4.0,酵母提取物4.0,麦芽提取物10.0,pH 7.0。
1.3 菌体培养
将菌种Nonomuraeasp.ATCC 39727稀释涂布至ISP2平板培养基,置培养箱中于28 ℃培养7~8d,挑取单菌落至装有玻璃珠和2 mL 无菌水的试管中,振荡破碎菌体,将菌悬液接入装有25mL液体培养基的250mL三角瓶中,置28 ℃振荡培养48h,摇床转速为180r/min。
1.4 细胞脂肪酸的甲酯化
将培养后的菌体培养液于4 000r/min离心5min,弃上清,将菌体沉淀用5 mL 1 mol/L NaOH-MeOH 溶液分两次转移至25mL 具塞试管中,置70 ℃水浴下皂化30 min,加入5 mL 14%BF3-MeOH 溶液,70 ℃水浴下甲酯化反应30min。反应结束后加入5 mL 饱和NaCl溶液及2mL正己烷,手动振荡混匀,静置,取上层有机相于4 000r/min离心5min,吸取上层有机相用于GC-MS分析。
1.5 GC-MS分析
气质联用仪为Agilent Technologies 7890型气相色谱-5975 型质谱联用仪。气相色谱条件为:HP-5MS弹性石英毛细管色谱柱(5%苯甲基硅氧烷,30m×0.25mm×0.25μm);进样口温度,250 ℃;载气,高纯度氦气;体积流量,1mL/min,进样量;1μL;分流比,1∶10;柱温采取程序升温:初始温度100℃,维持4min,以4℃/min升温至250 ℃,维持5min。质谱条件:离子源为电子轰击源(EI);电子能量为70 eV;离子源温度230 ℃;接口温度280 ℃;质量扫描范围为m/z35~450,Scan全扫描方式。
2 结果与讨论
2.1 总离子流色谱图
Nonomuraeasp.ATCC 39727 经液体培养增殖后,收集菌体细胞,对细胞中脂肪酸进行甲酯化处理,衍生后所得的脂肪酸甲酯(FAME)进行GC-MS分析,图1 为Nonomuraeasp.ATCC 39727细胞脂肪酸的总离子色谱图。对总离子色谱图的各色谱峰选择美国国家标准研究所(NIST)标准质谱库数据系统进行检索分析,结果表明脂肪酸甲酯对应的色谱峰保留时间为24~33min,共检出12种脂肪酸,各脂肪酸甲酯色谱峰的保留时间如图1所示。

图1 Nonomuraeasp.ATCC 39727细胞脂肪酸的总离子色谱图Fig.1 Total ions chromatograph profile of Nonomuraea sp.ATCC 39727fatty acids
2.2 主要脂肪酸
由图1 可知,A40926 产生菌Nonomuraeasp.ATCC 39727细胞脂肪酸中含量较高的脂肪酸有4种,其甲酯化衍生物对应的保留时间分别为26.740、27.130、27.655和31.741 min。将4种脂肪酸甲酯的质谱图在NIST 标准质谱库中进行检索,根据检索结果可以确定分别为iso-C16:0、n-C16:1△7、n-C16:0、n-C18:1△9脂肪酸的甲酯化衍生物,鉴定结果见图2。
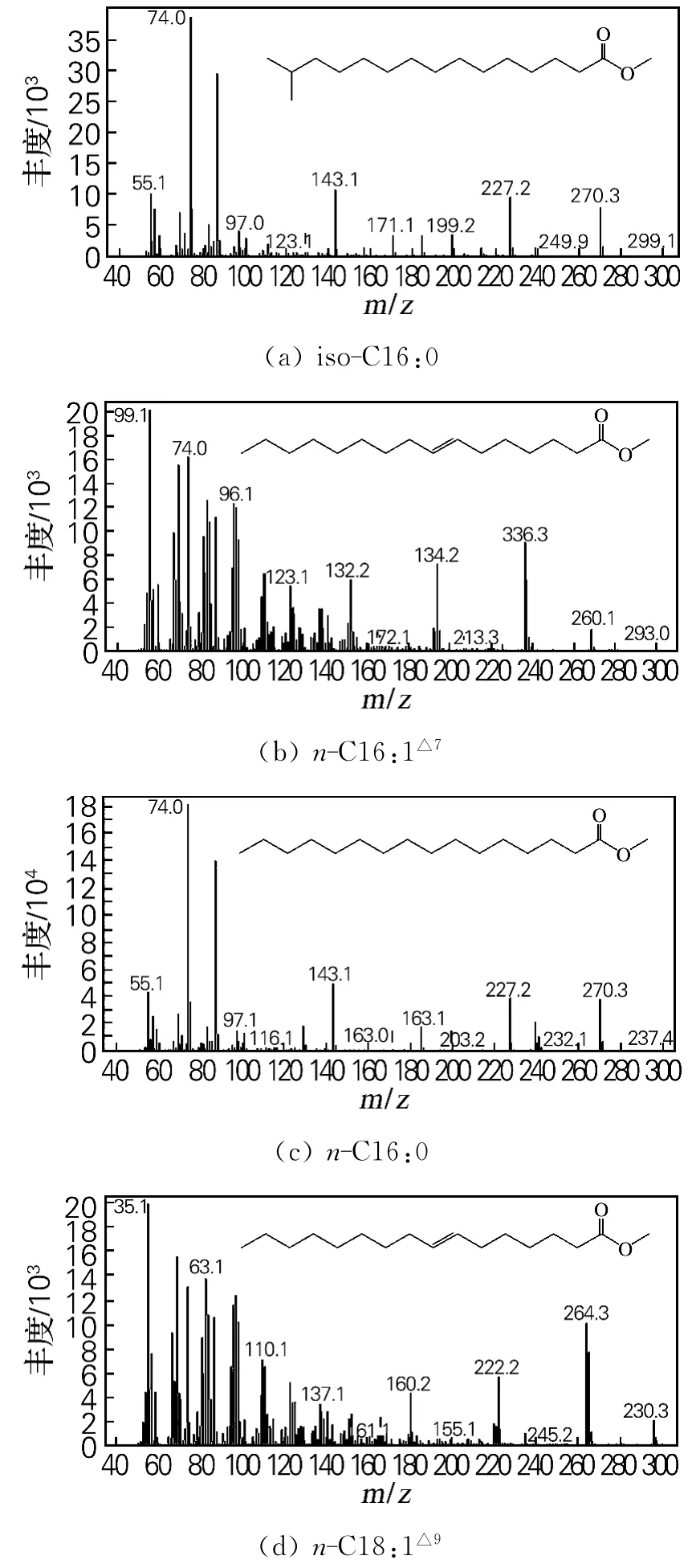
图2 Nonomuraeasp.ATCC 39727细胞中4种主要脂肪酸的甲酯化衍生物质谱图Fig.2 Methyl esterified derivatives of four main fatty acids of Nonomuraea sp.ATCC 39727
2.3 其他脂肪酸
除4种主要脂肪酸外,本研究从A40926 产生菌Nonomuraeasp.ATCC 39727细胞脂肪酸中还鉴定出其他8 种脂肪酸,分别为iso-C15:0(Rt 24.189 min)、n-C15:0(Rt 25.143 min)、n-C17:0 10-Met(Rt 28.705 min)、anteiso-C17:0(Rt 29.384 min)、n-C17:1△7(Rt 29.481 min)、iso-C17:0(Rt 30.039 min)、n-C18:0 14-Met(Rt 30.998min)、n-C18:0(Rt 32.335min)脂肪酸。
2.4 脂肪酸组分含量的测定
根据图1并采用峰面积归一法处理得到各组分的分析结果如表1 所示。Nonomuraeasp.ATCC 39727 细胞中以偶数碳的直链脂肪酸为主,以n-C16:0脂肪酸含量最高,达到39.563%,而n-C16:1△7、n-C16:0、n-C18:1△9、n-C18:0等4种偶数碳直链脂肪酸含量高达细胞脂肪酸含量的70.919%;偶数碳支链脂肪酸在Nonomuraeasp.ATCC 39727细胞中也占有较高的比例,iso-C16:0脂肪酸含量达到9.286%;Nonomuraeasp.ATCC 39727细胞中奇数碳脂肪酸包括iso-C15:0、n-C15:0、n-C17:0 10-Met、anteiso-C17:0、n-C17:1△7、iso-C17:0等6种脂肪酸,但其含量相对较低,奇数碳脂肪酸含量占细胞脂肪酸含量的17.826%。
Wallace等[12]利用同位素标记的脂肪酸合成起始物研究了放线菌体内的脂肪酸生物合成,结果表明,丁酰CoA 和丙酰CoA 为细胞直链脂肪酸的合成起始物,分别导致生成偶数碳n-脂肪酸、奇数碳n-脂肪酸,而异丁酰CoA、3-甲基丁酰CoA 和2-甲基丁酰CoA 为细胞支链脂肪酸的合成起始物,分别导致生成偶数碳iso-脂肪酸、奇数碳iso-脂肪酸、奇数碳anteiso-脂肪酸。Nonomuraeasp.ATCC 39727细胞中以偶数碳的直链脂肪酸为主,而奇数碳脂肪酸含量较低,可以推测Nonomuraeasp.ATCC 39727 在本研究培养条件下细胞内丁酰CoA 的含量相对较高,而且丁酰CoA 与细胞内脂肪酸合成酶系的亲和力较强。

表1 Nonomuraeasp.ATCC 39727细胞脂肪酸组成Tab.1 Composition of Nonomuraeasp.ATCC 39727 fatty acids analyzed as FAMEs by GC-MS
3 结 论
利用GC-MS对脂糖肽类抗生素A40926产生菌Nonomuraeasp.ATCC 39727的细胞脂肪酸进行分析,共检出12种脂肪酸,其中主要脂肪酸 包 括iso-C16:0、n-C16:1△7、n-C16:0、n-C18:1△9脂肪酸,以n-C16:0脂肪酸含量最高,达到39.563%。Nonomuraeasp.ATCC 39727细胞中以偶数碳的直链脂肪酸为主,而奇数碳脂肪酸(C15、C17)含量较低,细胞脂肪酸的组成反映了一定培养条件下细胞内脂肪酸合成起始物的丰度以及合成起始物与脂肪酸合成酶系的亲和程度。
[1]GOLDSTEIN B P,SELVA E,GASTALDO L,et al.A40926,a new glycopeptide antibiotic with anti-Neisseriaactivity[J].Antimicrobial Agents and Chemotherapy,1987,31(12):1961-1966.
[2]沈晓放,陈少欣.半合成糖肽类抗生素达巴万星前体A40926的生物合成[J].中国医药工业杂志,2010,41(2):141-147.
[3]ZERILLI L F,EDWARDS D M,BORGHI A,et al.Determination of the acyl moieties of the antibiotic complex A40926and their relation with the membrane lipids of the producer strain[J].Rapid Communications in Mass Spectrometry,1992,6(2):109-114.
[4]陈明,张春枝,祖国仁.天然脂糖肽类抗生素A40926的研究进展[J].中国抗生素杂志,2013,38(4):308-313.
[5]KAHNE D,LEIMKUHLER C,LU W,et al.Glycopeptide and lipogylcopeptide antibiotics[J].Chemical Reviews,2005,105(2):425-448.
[6]ZOU Yaozhong,BRUNZELLE J S,NAIR S K.Crystal structures of lipoglycopeptide antibiotic deacetylases:implications for the biosynthesis of A40926and Teicoplanin[J].Chemistry and Biology,2008,15(6):533-545.
[7]SOSIO M,STINCHI S,BELTRAMETTI F,et al.The gene cluster for the biosynthesis of the glycopeptide antibiotic A40926byNonomuraeaspecies[J].Chemistry and Biology,2003,10(6):541-549.
[8]BELTRAMETTI F,JOVETIC S,FEROGGIO M,et al.Valine influences production and complex composition of glycopeptide antibiotic A40926in fermentations of Nonomuraea sp.ATCC 39727[J].The Journal of Antibiotics,2004,57(1):37-44.
[9]JOVETIC S,FEROGGIO M,MARINELLI F,et al.Factors influencing cell fatty acid composition and A40926antibiotic complex production inNonomuraeasp.ATCC 39727[J].Journal of Industrial Microbiology and Biotechnology,2008,35(10):1131-1138.
[10]黄灵丽,沈晓放,陈少欣.糖肽类抗生素A40926B产生菌的培养基优化和菌种选育[J].中国医药工业杂志,2012,43(4):256-259.
[11]龙燕,黄运昌,朱春燕,等.糖肽类抗生素A40926高产菌株的选育[J].中国医药工业杂志,2013,44(2):143-145.
[12]WALLACE K K,ZHAO B,MCARTHUR H A,et al.In vivo analysis of straight-chain and branched-chain fatty acid biosynthesis in three actionmycetes[J].FEMS Microbiology Letters,1995,131(2):227-234.
