酵母菌及其破碎液对红曲色素及菌丝生长的影响
2015-02-23周学勤,王婵,王红英
周 学 勤,王 婵,王 红 英
(1.大连工业大学 生物工程学院,辽宁 大连 116034;2.大连工业大学 食品学院,辽宁 大连 116034)
0 引 言
红曲霉(Monascuspurpureus)的应用在中国已有1 000多年的历史,它是生产药材、食品着色剂、红曲米、红曲酒的主要菌种[1]。红曲色素作为天然色素,提取液中无黄曲霉素,安全无毒,可用于糖果、糕点、药片、肉罐头的染色[2-4]。中国食品发酵工业研究用红曲红色素代替传统的亚硝酸盐对发酵香肠染色,用1.6 mg/g的红曲色素形成的颜色接近于使用0.15 mg/g NaNO2产生的效果[5]。生产红曲色素的传统工艺是将红曲霉固态发酵,此种方式耗粮多、周期长、劳动强度大、产率低且工艺烦琐[6-8]。近年发展起来的液态发酵具有节约粮食、工艺简单、生产周期短等优点,但产量和色调偏低,工业化大规模生产受到了制约。因此,提高红曲色素产量及色调具有重要的意义[9-11]。
复合菌株发酵具有良好的发酵性能和稳定性,可通过代谢产物等提高目标产物的得率[12-14]。朱振元等[15]将酵母发酵液及酵母细胞破碎液分别加入到红曲霉液态发酵培养瓶中,提高了亲水性色素和疏水性色素的产量;王伟平[16]将红曲霉与啤酒酵母或米曲霉混合培养发酵,使得红曲色素色价得到明显提升。本实验将酵母菌或酵母细胞破碎液加入红曲霉液体培养瓶中,研究酵母及其细胞破碎液加入量、培养时间对红曲色素产量、色调及红曲霉菌丝体生长的影响。
1 材料与方法
1.1 材 料
1.1.1 菌 种
红曲霉(M.purpureus)、啤酒酵母(Saccharomycescerevisiae),实验室保藏菌种,由大连工业大学生物学院提供。
1.1.2 培养基
麦芽汁固体培养基:用麦芽制成Bx 10°的麦芽汁,加入2%的琼脂,pH 自然。
种子培养基:可溶性淀粉3%,硝酸钠0.3%,酵母膏0.5%,磷酸二氢钾0.1%,七水硫酸镁0.05%,去离子水溶解,pH 自然。
基本培养基:葡萄糖2%,硫酸铵0.5%,磷酸二氢钾0.1%,七水硫酸镁0.05%,去离子水溶解,pH 6.0。
YEPD培养基:葡萄糖2%,蛋白胨2%,酵母膏1%,去离子水溶解,pH 6.0,121℃灭菌20min。
发酵培养基:葡萄糖3%,硝酸钠0.2%,磷酸氢二钾0.1%,七水硫酸镁0.05%,硫酸亚铁0.001%,氯化钾0.05%,去离子水溶解,pH 6.6。
1.2 方 法
1.2.1 红曲霉的活化
将实验室保藏的红曲霉孢子粉用麦芽糖固体培养基二次活化培养后,得到纯化的红曲霉。
1.2.2 酵母菌及酵母细胞破碎液的制备
1.2.2.1 酵母菌的液体培养
将酵母菌接种于基本培养基(用于酵母菌对红曲霉产红色素的影响实验)和YEPD 培养基(用于酵母破碎液对红曲霉生产红色素影响的实验),35 ℃、170r/min的摇床中培养3d,计数。
1.2.2.2 酵母破碎液的制备
取上述酵母发酵液于7 000r/min条件下离心10min,收集菌体,称湿重,用无菌水在无菌条件下冲洗几次,加入适量的生理盐水,用超声波细胞破碎机(2s,2s,300 W,400 W)进行破碎。将破碎液在10 000r/min,4 ℃离心10min,取上清液,加入生理盐水稀释到500mL,备用。
1.2.3 红曲霉的液态发酵
刮取活化后的红曲霉的孢子粉于种子培养基中32 ℃、170r/min培养3d后,形成菌球大小均匀,直径约2mm 的菌球,挑取10个红曲霉菌球加入到发酵培养基中,于32℃、170r/min的摇床中培养24h。
1.2.4 红曲霉与酵母菌及细胞破碎液的共同培养
向100mL红曲霉发酵液中分别加入不同量的酵母菌及细胞破碎液,编号见表1。于30 ℃、170r/min培养6d,每隔1d测定一次,分别做3组平行实验。
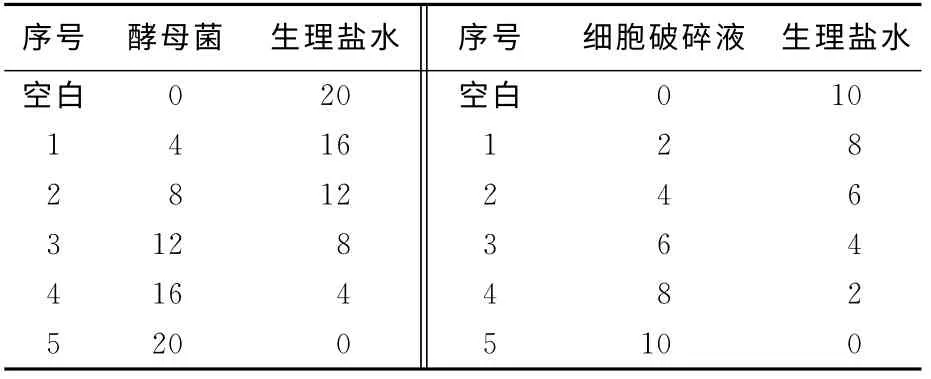
表1 酵母菌及破碎液的添加量Tab.1 Addictive amount of Saccharomyces cerevisiae and its lysate mL
1.2.5 红曲霉产红色素色价的测定
1.2.5.1 胞外色价
将发酵液在4 000r/min条件下离心10min,取上清液1mL加入9mL 的75%酒精,摇匀,以75%酒精作对照,测定510和410nm 的OD 值。胞外色素色价(U/mL)=OD 值×稀释倍数[17]。
1.2.5.2 胞内色价
发酵液过滤后的菌丝体经60℃烘干至恒重,将菌体于研钵中充分研磨,以75%乙醇定容至10mL,60 ℃浸提30min,每隔10min摇匀1次。取1mL该浸提液,加入9mL的75%酒精摇匀,以75%乙醇作空白对照,测定510 和410nm的OD 值。胞内红色素色价(U/mL)=OD 值×稀释倍数/菌体重[18]。
1.2.6 菌丝体干重
将发酵液离心、过滤,于90℃烘干5h,称重。
2 结果与分析
2.1 酵母菌对红曲霉产色素及菌体生长的影响
在相同条件下对加入了不同酵母菌量(105个/mL)的红曲霉进行摇床培养,每隔24h在510及410nm 波长处对胞外及胞内色素色价进行测量,并称量菌体干重。
2.1.1 酵母菌对红曲霉产胞外色素的影响
从图1可以看出,与照组相比,添加酵母菌与红曲霉共同培养没有改变红曲霉色素生产曲线的基本模式,随发酵时间的延长色素产量增加。胞外色素在红曲霉与酵母混合后5d,第3组效果最好,红色素(510nm)产量为2.58 U/mL,比空白组提高了41.75%。如图2 所示,胞外黄色素(420nm)产量也是第3组达到最大,为2.37U/mL,比空白组提高了78.19%。

图1 酵母菌对红曲霉产胞外红色素的影响Fig.1 Effects of Saccharomyces cerevisiae on production of extracellular red pigment from Monascus purpureus

图2 酵母菌对红曲霉产胞外黄色素的影响Fig.2 Effects of Saccharomyces cerevisiae on extracellular yellow pigment of Monascus purpureus
2.1.2 酵母菌对红曲霉产胞内色素的影响
从图3、4可以看出,随发酵时间的延长,色素产量逐渐增加。胞内色素在红曲霉与酵母混合后5d达到最大值,第3组效果最好,红色素产量为1 185.42U/g,比空白组提高了21.24%;黄色素产量为1 296.32U/g,比空白组提高了34.57%。
根据实验结果推测,酵母菌与红曲霉共同培养时,酵母菌产生的几丁质酶作用于真菌的细胞壁多糖的主要成分几丁质,成为红曲霉细胞提高色素产量的刺激因子,增加细胞壁的通透性,从而提高色素产量;其次,可能是红曲霉的细胞壁受到水解酶类水解时,菌体会与红曲霉产生竞争作用,使红曲霉生长受到自我保护,会大量产生疏水类物质(如色素)抑制生长。当发酵培养接近尾声时,培养基内营养物质消耗殆尽,菌株会以红色素为营养物质,消耗色素。

图3 酵母菌对红曲霉产胞红内色素的影响Fig.3 Effects of Saccharomyces cerevisiae on intracellular red pigment of Monascus purpureus

图4 酵母菌对红曲霉产胞内黄色素的影响Fig.4 Effects of Saccharomyces cerevisiae on intracellular yellow pigment of Monascus purpureus
2.1.3 酵母菌对红曲霉生长的影响
从图5可以看出,添加酵母菌没有改变红曲霉生长曲线的基本模式,菌体质量在红曲霉与酵母混合后4d达到最大值,也是第3组菌体质量达到最大值,为0.26g,比空白组提高了100%。
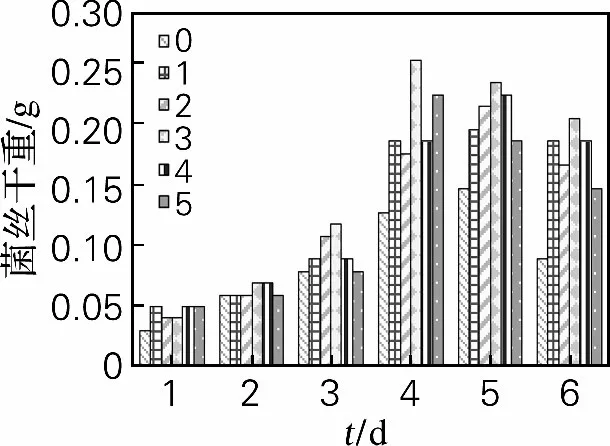
图5 酵母菌对红曲霉菌丝生长的影响Fig.5 Effects of Saccharomyces cerevisiae on mycelial growth of Monascus purpureus
2.2 酵母破碎液对红曲霉产色素及菌体生长的影响
2.2.1 酵母破碎液对红曲霉产胞外色素的影响
从图6、7可以看出,添加酵母破碎液没有改变红曲霉色素生产曲线的基本模式,色素随发酵时间的延长产量有所增加。胞外色素在红曲霉与酵母破碎液混合后5d达到最大值,第2组效果最好,胞外红色素产量为4.43 U/mL,比空白组提高了55.99%;胞外黄色素产量为4.03U/mL,比空白组提高了48.71%。
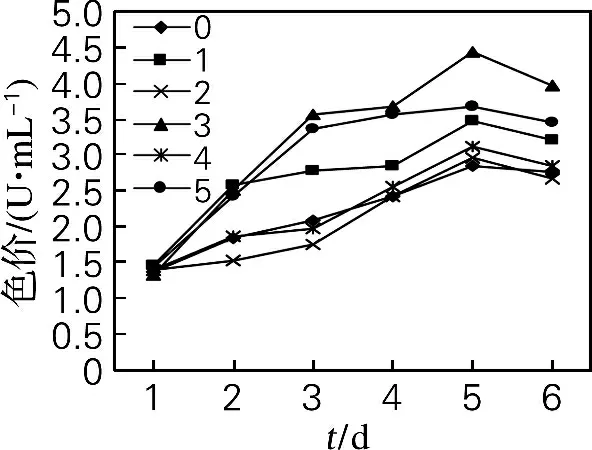
图6 酵母破碎液对红曲霉产胞外红色素的影响Fig.6 Effects of Saccharomyces cerevisiae lysate on extracellular red pigment of Monascus purpureus
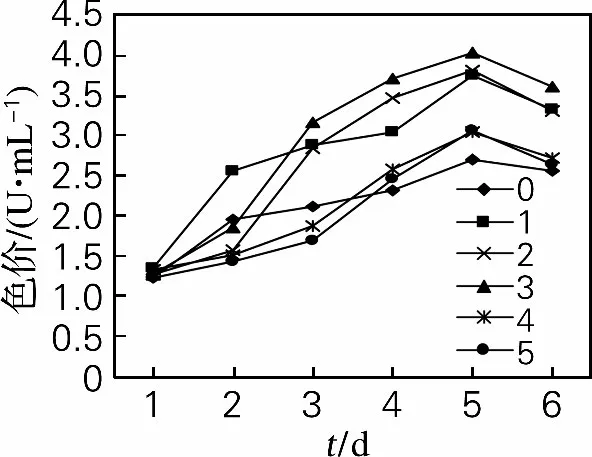
图7 酵母破碎液对红曲霉产胞外黄色素的影响Fig.7 Effects of Saccharomyces cerevisiae lysate on extracellular yellow pigment of Monascus purpureus
2.2.2 酵母破碎液对红曲霉产胞内色素的影响
从图8、9可以看出,胞内色素在红曲霉与酵母破碎液混合后5d达到最大值,第2组效果最好,胞内红色素产量为1 043.25 U/g,比空白组提高20.87%;胞内黄色素产量为1 003.68U/g,比空白组提高了23.88%。
酵母细胞破碎液促进了红曲霉红色素产量的增加,可能是破碎液中的几丁质酶对红曲霉的刺激作用,也可能是酵母细胞破碎液中含有红曲色素合成途径中红色素的前体反应的酶的催进物,具体是哪种成分催进了次级代谢产物红色素的合成有待进一步研究。

图8 酵母破碎液对红曲霉产胞内红色素的影响Fig.8 Effects of Saccharomyces cerevisiae lysate on intracellular red pigment of Monascus purpureus
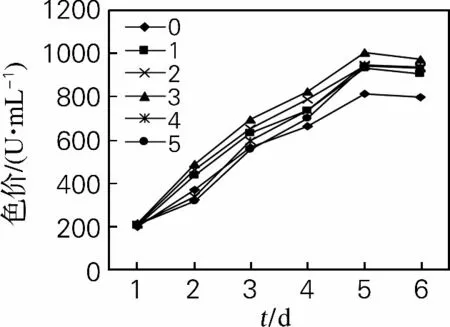
图9 酵母破碎液对红曲霉产胞内黄色素的影响Fig.9 Effects of Saccharomyces cerevisiae lysate on intracellular yellow pigment of Monascus purpureus
2.2.3 酵母细胞破碎液对红曲霉生长的影响
如图10所示,菌体质量在红曲霉与酵母混合后5d达到最大值。添加的酵母破碎液量为培养液体积的4%时效果最好,菌体质量为0.41g,比空白组提高了19.35%。

图10 酵母破碎液对红曲霉菌丝生长的影响Fig.10 Effects of Saccharomyces cerevisiae lysate on mycelial growth of Monascus purpureus
2.3 酵母菌及其细胞破碎液对红曲红色素色调的影响
红曲红色素一般为多种色素的混合物,主要含红色素和黄色素,两者比值即为色调,色调也是评价红色素质量的指标之一。若红多于黄,即色调大于1,则颜色感官为深红;反之,黄多于红,即色调小于1,则颜色呈橙红或橙黄色[18]。
取5d时每组的红色素色调进行比较,如表2所示,胞内外红曲色素色调均随着酵母菌加入量的增大而减小,分析可能是因为酵母菌与红曲霉竞争营养物质,给红曲霉造成了生产黄色素比红色素更适宜的营养环境,从而使红色素色调降低。而酵母细胞破碎液对红色素色调的影响并不显著,色调几乎保持在1.00,表示红色素色调的影响与酵母菌产生的代谢产物无关。
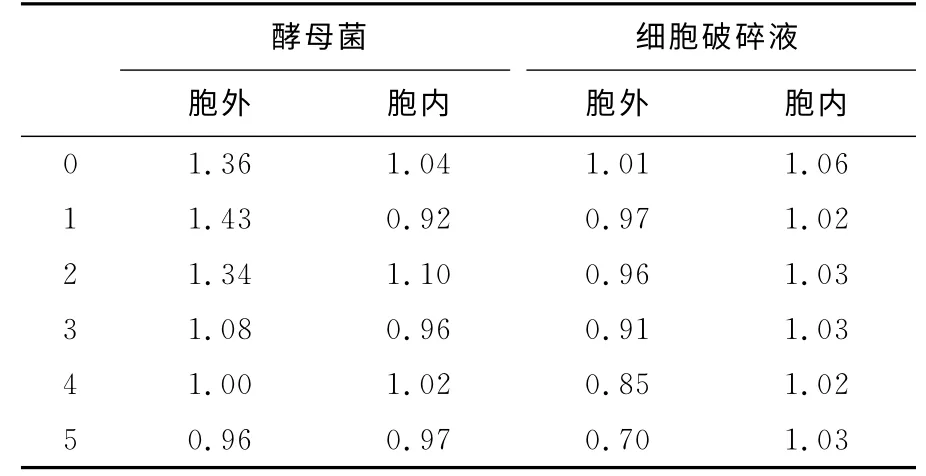
表2 酵母菌及其细胞破碎液对红曲色素色调的影响Tab.2 Effects of Saccharomyces cerevisiae and its lysate on hue of red pigment
3 结 论
混菌之间可互利共栖,产生协同作用,提高产率[19]。酵母菌与红曲霉混合培养可使红曲霉产色素量增加,在混菌培养5d、菌液加入量为12mL(培养液体积的4%)时,色素产量达到最大值,比红曲霉单独培养胞外红色素和胞内红色素分别提高了41.75%和21.24%,菌体干重提高了100%。酵母细胞破碎液也可使红曲霉产色素量增加,在共同培养5d,加入量为4mL(培养液体积的4%)时达到最大值,比红曲霉单独培养胞外红色素和胞内红色素分别提高了55.99%和20.87%,菌体干重提高了19.35%。此外,实验还研究了酵母菌及其破碎液对红色素色调的影响,表明色调变化与酵母菌代谢产物无关。
酵母菌及其破碎液能增加红曲色素产量,若能在规模化生产中应用,将能产生可观的效益。
[1]FENG Yanli,SHAO Yanchun,CHEN Fusheng.Monascuspigments[J].Applied Microbiology and Biotechnology,2012,96(6):1421-1440.
[2]周立平.红曲研究生产现状与进展[J].酿酒科技,2003(4):34-35.
[3]丘振宇,王亚琴,许喜林.红曲霉的特点及应用研究[J].食品工业科技,2006(12):186-188.
[4]朱效刚,许赣荣.红曲的保健功能及产品开发趋势[J].食品研究与开发,2005,26(3):128-130.
[5]郭红珍,杨潞芳.红曲霉的研究进展[J].中国食品添加剂,2003(3):22-24.
[6]衣珊珊,沈昌,韩永斌,等.红曲色素形成机理及提高色价的途径[J].食品科学,2005,26(7):256-260.
[7]夏书华,刘颖.有关红曲色素的提取及提高色价的研究[J].北京农学院学报,1999,14(1):44-48.
[8]邢淑婕,刘开华.培养条件对红曲霉产红曲红色素及桔霉素影响的研究[J].中国食品添加剂,2010(1):112-115.
[9]方元超,杨柳.红曲霉研究进展综述[J].四川食品与发酵,1999(1):5-10.
[10]郭红珍,王秋芬,马立芝.不同培养条件对红曲霉产红曲色素的研究[J].食品科学,2008,29(1):215-218.
[11]吴大康.液态发酵法生产红曲色素的研究[J].中国调味品,1991(12):12-18.
[12]牛丽亚,黄占旺,肖招燕.双菌混合发酵产物稳定性的研究[J].中国饲料,2009(5):14-16.
[13]唐洁,王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012,39(7):921-930.
[14]覃莉,王志,陈雄,等.酵母菌醋酸菌混菌发酵高产醋酸工艺研究[J].中国酿造,2012,31(1):144-147.
[15]朱振元,满金浩,刘安军.酵母细胞影响红曲霉次生代谢产物的研究[J].现代食品科技,2009,25(2):136-140.
[16]王伟平.啤酒酵母或米曲霉与紫红曲霉混合发酵对红色素的影响[J].中国酿造,2006(7):28-29.
[17]夏书华,刘颖.有关红曲色素的提取及提高色阶的研究[J].北京农学院学报,1999,14(1):44-48.
[18]梁志洲,徐民俊,胡海燕,等.酵母破碎液对红曲霉红色素生产能力的影响[J].食品与发酵工业,2011,37(3):37-40.
[19]徐颖宣,徐尔尼,冯乃宪,等.微生物混菌发酵应用研究进展[J].中国酿造,2008(9):1-4.
