双重PCR 快速检测海水贝类中副溶血性弧菌
2015-02-23强世龙,张公亮,孙黎明,侯红漫
强 世 龙,张 公 亮,孙 黎 明,侯 红 漫
(大连工业大学 食品学院,辽宁 大连 116034)
0 引 言
副溶血性弧菌(Vibrioparahaemolyticus)是一种食源性致病菌,主要来源于虾、鱼和贝类等海产品[1]。据报道,近年来,我国微生物性食物中毒的病原分布发生了显著变化,特别是沿海地区,副溶血性弧菌引起的食物中毒已经高居微生物性食物中毒首位[2]。副溶血性弧菌是亚于霍乱弧菌的常见肠道致病菌,在春夏季大连沿海地区以贝类如红螺(RapanabezonaLinnaeus)、方形马珂蛤(Mactraveneriformis)、菲律宾蛤仔(Ruditapesphilippinarum)为主可以生吃的海鲜贝类产品集中上市,而生吃海鲜极易引发食物中毒,会引起人类腹泻等肠道疾病及食物中毒,出现腹泻、腹部痉挛、呕吐、恶心、和头痛等症状[3-5]。目前对食源性致病菌的检测仍主要依靠传统的生化鉴定、细菌培养、血清学等方法,检测周期长(4~7d),操作烦琐复杂,已不能适应卫生应急检测的需要。因此对副溶血性弧菌快速检测的研究,将有助于预防这种食源性疾病。
近年来,分子生物学技术的发展使得PCR 技术被引入该方面的检测,如多重PCR 技术和荧光定量PCR技术等[6-9],但以海水贝类为对象检测副溶血性弧菌的PCR 方法并不多见。本实验根据属特异tl基因[10]和特异性毒力基因tdh[11]作为水产品中副溶血性弧菌检测的靶基因,应用双重PCR 快速检测海水贝类中副溶血性弧菌。
1 实 验
1.1 材 料
1.1.1 菌 种
副溶血性弧菌(Vibrioparahaemolyticus)、沙门氏菌(Salmonellasp.)、金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichia coil)、产气杆菌(Aerobacteraerogenes),实验室保存。
1.1.2 试 剂
弧菌显色培养基、副溶血性弧菌成套生化鉴定管,青岛高科园海博生物有限公司;细菌基因组DNA 提取试剂盒、DNA Marker、溶菌酶、蛋白酶K、RNaseA 以及PCR 相关试剂,北京天根生化有限公司。
1.1.3 引物序列
以副溶血性弧菌tdh基因和弧菌属的tl基因作为靶基因分别合成两对特异性引物(表1),由北京六合华大基因科技股份有限公司合成。
1.1.4 样品处理
2013年春夏两季随机挑选大连海鲜集市新鲜红螺、方形马珂蛤及菲律宾蛤仔。分为8个批次取样,红螺、菲律宾蛤仔、方形马珂蛤共201份样品,按采样时间顺序标号,每份样品包装于无菌塑封袋中,4 ℃冰盒取样2h内送到实验室检验。
在无菌条件下去壳,称取25g软组织和体液,置于灭菌研钵中,用灭菌剪刀充分剪碎后研磨。

表1 目的基因及引物序列Tab.1 Target genes and corresponding primer sequences
1.1.5 仪 器
5418R 小型台式冷冻离心机,德国艾本德股份公司;JM-250电泳仪,大连捷迈科贸有限公司;VersaDoc凝胶成像仪,美国伯乐;PCR 扩增仪,美国伯乐。
1.2 方 法
1.2.1 细菌的活化培养
取-80 ℃、25%甘油冻存的菌种,解冻后分别划线于细菌培养基上,置于37 ℃恒温培养箱24h,连续活化2次,将单菌落接种于普通肉汤培养基中,37℃恒温培养,150r/min增菌培养18h。
1.2.2 细菌基因组DNA 的制备
取1mL菌液按照细菌基因组DNA 提取试剂盒说明书步骤进行DNA 提取,并溶于30μL双蒸水中,于-20 ℃下保存。
1.2.3 双重PCR 的体系建立及优化
双重PCR 扩增体系:反应总体积为20μL,DNA 模 板1 μL,10×Buffer(Mg2+)2 μL、2.5mmol/L dNTP(4种脱氧核糖核苷三磷酸的混合物)4μL、两对2.5mmol/L的上下游引物各0.2μL、Taq酶(2.5U/μL)0.2μL,用灭菌双蒸水补充至20μL。
PCR 循环参数:采用热启动,预变性94 ℃4min,变性94 ℃1min,退火56 ℃1min,延伸72 ℃2min,30个循环,终延伸72 ℃7min。用含有0.5μg/mL 溴化乙啶(EB)的1%琼脂糖凝胶电泳检测扩增产物,在凝胶成像系统下拍照记录结果。
以“1.2.2”中提取的副溶血性弧菌标准株菌液DNA 为模板,基于双重PCR 检测的初始反应体系及条件,分别从引物浓度、模板量、退火温度等反应体系条件进行优化。
1.2.4 双重PCR 特异性及灵敏度检测
特异性检测:分别提取海水贝类常携带的金黄色葡萄球菌、大肠杆菌、产气杆菌及沙门氏菌模板DNA,作为对照菌株,在最佳双重PCR 体系及条件下扩增,验证本方法用于副溶血性弧菌检测的特异性。
灵敏度检测:将过夜培养的副溶血性弧菌菌液用无菌的生理盐水进行10倍梯度稀释,使目标菌浓度由依次为:2.5×107、2.5×106……2.5×102、27、3cfu/mL。分别提取不同浓度菌液的模板DNA,在最佳双重PCR 体系及条件下扩增,确定双重PCR 的检测灵敏度。
1.2.5 人工污染红螺样品的制备及检出限检测
无菌操作取经检测无副溶血性弧菌的红螺样品25g,经生理盐水冲洗后,加入营养肉汤中,充分摇匀制成均质液,用无菌生理盐水对初始浓度为2.5×107cfu/mL的副溶血性弧菌菌液作10倍梯度稀释,取1mL不同稀释梯度菌悬液人工接种225mL均质液中,37 ℃恒温培养,150r/min增菌培养8h,提取模板DNA,进行双重PCR 检测,确定人工污染红螺样品的最低检出限。
1.2.6 海水贝类的实际检测
以“1.1.4”研磨后样品分装500 mL 灭菌三角瓶(已加入225mL营养肉汤),37℃恒温培养,150r/min增菌培养8h,取增菌液1 mL 提取DNA,进行副溶血性弧菌双重PCR 检测。
1.2.7 生理生化验证
根据GB 4789.7—2013 食品安全国家标准进行验证分析。
1.2.7.1 初步验证
氧化酶实验:挑选纯培养的单个菌落进行氧化酶实验,副溶血性弧菌为氧化酶阳性。涂片镜检:将可疑菌落涂片,进行革兰氏染色,镜检观察形态。副溶血性弧菌为革兰氏阴性,呈棒状、弧状、卵圆状等多形态,无芽孢,有鞭毛;挑取纯培养的单个可疑菌落,转至3%氯化钠三糖铁琼脂斜面并穿刺底层,37 ℃培养24h观察结果。副溶血性弧菌在3%氯化钠三糖铁琼脂中的反应为底层变黄不变黑,无气泡,斜面颜色不变或红色加深,有动力。嗜盐性实验:挑取纯培养的单个可疑菌落,分别接种6%、8%和10%不同质量分数的氯化钠胰胨水(以不加氯化钠为空白对照),37 ℃培养24h,观察液体混浊情况。副溶血性弧菌在无氯化钠和10%氯化钠的胰胨水中不生长或微弱生长,在含6%和8%氯化钠的胰胨水中生长旺盛。
1.2.7.2 确定验证
取纯培养物分别接种含3%氯化钠的甘露醇实验培养基、赖氨酸脱羧酶实验培养基、MR-VP培养基,37 ℃培养36h后观察结果;利用3%氯化钠三糖铁琼脂隔夜培养物进行ONPG 实验。
2 结果与分析
2.1 退火温度优化
利用梯度方式对双重PCR 的退火温度进行优化,结果表明,在退火温度为55、56 ℃时,两特异条带同时扩增清晰且无引物二聚体,考虑到降低退火温度可以提高扩增效率,最终选取55℃为最佳退火温度。
2.2 模板量优化
双重PCR 模板量优化后表明,只有当模板量为1μL时,两条带同时扩增较为清晰,选择1μL为双重PCR 检测的最佳模板量。
2.3 引物浓度优化
双重PCR 两对引物体积配比优化结果表明,当引物1与引物2的体积比为1∶1时,两特异条带亮度一致,扩增清晰。
2.4 特异性及灵敏度检测结果
如图1所示,分别以副溶血性弧菌标准株、沙门氏菌、大肠杆菌、金黄色葡萄球菌及产气杆菌为模板DNA,按最佳反应体系及条件进行双重PCR 扩增,结果显示,只有副溶血性弧菌标准株可扩增出二条特异条带,大小为450和269bp,与理论值相符,而其他4株致病菌除引物二聚体外均未出现任何扩增条带,说明该双重PCR 特异性良好。

图1 双重PCR 特异性检测结果Fig.1 Specificity of the duplex PCR primers
菌悬液浓度梯度稀释后,经菌落平板计数、对提取不同梯度稀释模板DNA 进行相应的双重PCR。如图2所示,菌液浓度为2.5×102cfu/mL时,仍可检出两条特异条带,即双重PCR 检测纯菌液的灵敏度约为2.5×102cfu/mL,该灵敏度可满足样品选择性增菌后的检测要求。

图2 双重PCR 灵敏度检测结果Fig.2 Test for the sensitivity of the duplex PCR
2.5 人工污染红螺样品的检出限
检测结果如图3 所示,浓度为2.5×102cfu/mL的菌液污染红螺样品仍可检出,经计算,此双重PCR 检测模拟污染红螺样品检出限为10cfu/g。
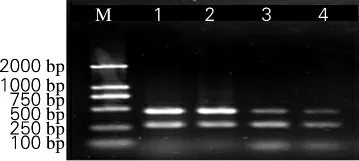
图3 模拟样品双重PCR 检测结果Fig.3 The duplex PCR of simulative samples
2.6 双重PCR快速检测新鲜海水贝类样品
以1~77号红螺样品、1~63号方形马珂蛤样品、1~61号菲律宾蛤仔增菌液的基因组DNA作模板,在双重PCR 最佳反应体系及条件下扩增,如图4 所示。所有PCR 均为阳性样品。77份新鲜红螺样品中共有15份PCR 阳性样品,63份四角蛤蜊样品有8份阳性样品、61份菲律宾蛤仔有5份阳性样品。
2.7 生理生化实验验证结果
对201份海水贝类样品(红螺、方形马珂蛤及菲律宾蛤仔)中的可疑菌落分别进行革兰氏染色、镜检及系列生理生化实验。图4结果与传统实验结果对比可知,28份同时出现两特异条带的PCR阳性样品中均可筛选到镜检结果及生理生化指标与副溶血性弧菌标准株相同的阳性菌株,与传统实验结果符合率100%;而没有条带出现的样品中未有副溶血性弧菌菌检出。

图4 双重PCR 检测新鲜红螺、方形马珂蛤、菲律宾蛤仔样品结果Fig.4 The duplex PCR result of fresh Rapana bezona Linnaeus,Mactra veneriformis and Ruditapes philippinarum samples
因此,在应用双重PCR 方法检测海水贝类样品时,当检测结果同时出现两条特异性条带的样品,可计为副溶血性弧菌阳性样品,当没有条带出现时可计为副溶血性弧菌阴性样品。表2分别列出春夏两季鲜活海水贝类样品中副溶血性弧菌的检出率。
3 结 论
本实验以副溶血性弧菌的特异基因tl与毒力基因tdh为靶基因选择了两对引物,检测海水贝类中副溶血性弧菌的双重PCR 快速方法。对双重PCR 的反应条件进行了优化,使双重PCR具有良好的特异性以及敏感性,灵敏度可达到2.5×102cfu/mL。人工污染副溶血性弧菌的海水贝类检出限为10cfu/g,每批样品从样品处理到出结果只需16h,且便于批量检测,而传统培养方法需要4~5d或更长的时间,不宜大批量操作。本实验所选两对引物较其他相比敏感性有较大提高,具有广阔的应用前景和较强的实际应用价值,为大连周边海鲜集市海水贝类的副溶血性弧菌检测提供一种有效的检测方法。
对海鲜市场随机抽取的77份新鲜红螺样品、63份方形马珂蛤样品、61份菲律宾蛤仔进行双重PCR 的实际检测,经验证,最终共检出阳性样品28份,春夏两季红螺样品中副溶血性弧菌的检出率分别为13.3%、25%,方形马珂蛤为6.7%、21.2%,菲律宾蛤仔为0、16.1%。由三类样品两季检出率对比可知,春季检出率均较低、夏季检出率均较高。随着天气逐渐转暖,致使一些食源性副溶血菌不容易灭活,所以生吃海鲜尤其在夏季可能会引起食物中毒,或者感染性的肠道腹泻,副溶血性弧菌在海水贝类中的危险性不容忽视。

表2 春夏两季鲜活海水贝类样品中副溶血性弧菌检出率Tab.2 Vibrio parahaemolyticus detection rate of fresh shellfish samples in spring and summer
[1]FABIANO L,THOMPSON,TETSUYA LIDA,et al.Biodiversity ofVibrios[J].Microbiology and Molecular Biology Reviews,2004,68(3):403-431.
[2]刘秀梅.食源性疾病监控技术的研究[J].中国食品卫生杂志,2004,16(1):3-9.
[3]DEPAOLA A,NORDSTROM J L,BOWERS J C,et al.Seasonal abundance of total and pathogenicVibrioparahaemolyticusin Alabama oysters[J].Applied and Environmental Microbiology,2003,69(3):1521-1526.
[4]GHOSH A R,SEHGAL S C.Detection oftdhandtrhgenes in a urea-hydrolyzing environment isolate ofVibrioparahaemolyticusfrom the andamans[J].Journal of Diarrhoeal Diseases Research,1998,16(2):87-90.
[5]LIDA T,PARK K S,SUTHIENKUL O,et al.Close proximity of thetdh,trhanduregenes on the chromosome ofVibrioparahaemolyticus[J].Microbiology,1998,144(9):2517-2523.
[6]翁文川,焦红,王方金,等.食品中副溶血弧菌荧光定量PCR 方法快速检测[J].中国公共卫生,2005,21(11):1359-1361.
[7]HAN-KUDO Y,KASUGA Y.Increased sensitivity in PCR detection of tdh-positiveVibrioparahaemolyticusin seafood with purified template DNA[J].Journal of Food Protection,2003,66(9):1675-1680.
[8]LIJIMA Y,ASAKO N T,AIHARA M,et al.Improvement in the detection rate of diarrhoeagenic bacteria in human stool specimens by a rapid realtime PCR assay[J].Journal of Medical Microbiology,2004,53(7):617-622.
[9]钟凯,田静,李业鹏,等.食品中副溶血弧菌PCR 快速检测方法的研究[J].中国食品卫生杂志,2004,16(4):317-320.
[10]BEJ A K,PATTERSON D P,BRASHER C W,et al.Detection of total and hemolysin-producingVibrioparahaemolyticusin shellfish using multiplex PCR amplification oftl,tdhandtrh[J].Journal of Microbiology Methods,1999,36(3):215-225.
[11]NAIM R,YANAGIHARA I,LIDA T,et al.Vibrioparahaemolyticusthermostable direct hemolysin can induce an apoptotic cell death in Rat-1cells from inside and outside of the cells[J].FEMS Microbiology Letters,2001,195(2):237-244.
