复合型季铵盐类抗菌剂的抑菌效果
2015-02-23王冰,金朝霞,张宗申
王 冰,金 朝 霞,张 宗 申
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
细菌、病毒等致病性微生物是威胁人类健康的杀手。各种塑料制品,尤其是医用制品的表面污染和细菌滋生会对人类生命健康造成极大的威胁[1]。世界各国对抗菌研究的投入逐年增加,高效环保的抗菌剂是研究的关键[2]。
抗菌剂是指在一定时间内能使某些微生物(细菌、真菌、酵母菌、藻类及病毒等)的生长或繁殖保持在必要水平以下的一类物质[3]。目前,对于有机小分子抗菌剂的抗菌活性已经有了较多的研究。人们发现带有长链烷基的季铵盐基团具有很强的抗菌性能[4]。但是有机小分子抗菌剂存在易挥发、不易加工、化学稳定性差等缺点。带有抗菌基团的有机高分子化合物恰巧可以克服上述缺点,同时高分子季铵盐抗菌剂不会渗透进人的皮肤,还具有比小分子抗菌剂更好的抗菌性能[5-6]。
壳聚糖季铵盐(HACC)不但具有季铵盐的典型性质,如抗菌、抑菌性以及吸湿、保湿性,还保持了壳聚糖原有的良好的成膜性、絮凝性以及生物相容性和可降解性,同时具有良好的水溶性,从而使其在食品工业、医药、工业水处理、纺织品加工等领域广泛应用[7-8]。有机硅季铵盐(OSQAS)是一类阳离子表面活性剂,具有耐高温、耐水洗、持久的效果,抑菌范围广,能有效抑制革兰阳性菌、革兰阴性菌、酵母菌和真菌[9]。作者希望通过将两种类型的抗菌剂复合使用,充分发挥各自的优势和特点,制成更安全、易加工、稳定性好、广谱高效、低毒性、可回收、廉价的抗菌剂。
1 材料与方法
1.1 材 料
牛肉膏、琼脂粉、蛋白胨、氯化钠;有机硅季铵盐,广州市诺康化工有限公司;甲壳素季铵盐,南通绿神生物工程有限公司。
大肠杆菌、藤黄八叠球菌和金黄色葡萄球菌,大连工业大学生物工程学院菌种保藏室提供。
1.2 方 法
1.2.1 菌种活化及培养
分别将革兰阴性菌(大肠杆菌)和革兰阳性菌(金黄色葡萄球菌、藤黄八叠球菌)活化。将各菌种经增殖培养,分离纯化,取单菌落接种于斜面培养基保存。
菌悬液的制备:将大肠杆菌菌种在无菌条件下接种于营养琼脂培养基上,然后在恒温箱内37 ℃培养12h,将菌种转接于液体培养基中,摇匀,置于37℃摇床180r/min培养12h,用灭菌的生理盐水稀释成106~107cfu/mL菌悬液备用。
1.2.2 抗菌谱的确定
将OSQAS 与HACC 分别配制成不同浓度梯度的溶液,分别作用于大肠杆菌、金黄色葡萄杆菌、藤黄八叠球菌的菌悬液,置于37 ℃的恒温振荡培养箱180r/min培养12h。移取30μL培养液到营养琼脂培养基上培养,倒置于37 ℃恒温箱培养24h。每个样品重复3次,通过活菌菌落计数法观察菌落生长情况,以不同浓度梯度抗菌剂作用后多数培养基上无菌落生长的菌种为抗菌谱。
实验主要研究OSQAS 和HACC 对大肠杆菌和金黄色葡萄球菌的抗菌活性。
1.2.3 最低抑菌浓度(MIC)的测定
将1mL 已稀释到106~107cfu/mL 的菌悬液加入到1mL下列不同浓度的OSQAS培养基溶液中:0.005 4、0.010 8、0.021 6、0.032 4、0.043 2、0.054 0mg/mL,置于180r/min的恒温摇床上,在37 ℃培养12h,以相同样品浓度且未加菌液的培养液作参比,并以未加抗菌剂的菌悬液作对照。在600nm 测定其分光度A600。以分光光度法确定其最低抑菌浓度[10]。确定培养基上不生长菌体的浓度为最低抑菌浓度。
同理配制不同浓度梯度的HACC:0.035、0.070、0.100、0.200、0.300、0.400 mg/mL。将不同浓度的HACC溶液作用于菌悬液,取30μL混合液加入平板培养基上,涂匀,倒置于37 ℃恒温箱培养24h,观察菌落生长情况,以培养不加抗菌剂的菌悬液的菌落数做空白对照实验。通过活菌菌落计数法确定培养基上不生长菌体的浓度为最低抑菌浓度。分别确定HACC 作用于大肠杆菌和金黄色葡萄球菌的最低抑菌浓度。
以实验确定的HACC和OSQAS对大肠杆菌的最低抑菌浓度的不同配比配制复配抗菌剂。HACC与OSQAS的浓度配比分别为:0.5MICHACC/0.5MICOSQAS、 0.67MICHACC/ 0.67MICOSQAS、0.5MICHACC/MICOSQAS、MICHACC/0.5MICOSQAS、MICHACC/MICOSQAS;通过活菌菌落计数法确定复配抗菌剂对大肠杆菌的抑菌效果。
同理,以两种抗菌剂分别作用于金黄色葡萄球菌的最低抑菌浓度来复配抗菌剂并确定复配抗菌剂对金黄色葡萄球菌的抑菌作用。HACC 与OSQAS 的浓度配比分别为:0.5 MIC′HACC/0.5MIC′OSQAS、 0.67MIC′HACC/ 0.67MIC′OSQAS、0.5MIC′HACC/MIC′OSQAS、MIC′HACC/0.5MIC′OSQAS、MIC′HACC/MIC′OSQAS。
1.2.4 混合抗菌剂的热稳定性
复配后最低抑菌浓度的抗菌剂在不同温度梯度的水浴锅内处理30 min,设定温度为:20、30、40、50、60、70 ℃,然后作用于大肠杆菌菌悬液。用7202B型分光光度计测定其在600nm 的分光度,以相同样品浓度且未加菌液的培养液作参比,并以室温下未加抗菌剂的菌悬液作对照。用分光光度法确定混合抗菌剂的热稳定性。
1.2.5 作用时间
复配剂与大肠杆菌菌悬液的作用时间不同对抑菌效果的影响,设定时间为5、10、20、30、40、50、60min,在不同时间分别取30μL的混合液涂布于培养基,采用活菌菌落计数法,观察菌落的生长情况,确定作用时间对抑菌活性的影响。
2 结果与讨论
2.1 OSQAS与HACC的抗菌谱
由图1可知,OSQAS的抗菌谱为大肠杆菌、藤黄八叠球菌、金黄色葡萄球菌;HACC 的抗菌谱为大肠杆菌、藤黄八叠球菌、金黄色葡萄球菌;其中OSQAS对藤黄八叠球菌的抑菌效果最为显著。这表明OSQAS与HACC这两种抗菌剂对革兰阳性菌和革兰阴性菌都具有较好的抑菌效果,对一些普遍存在的致病菌具有一定的抑制作用。
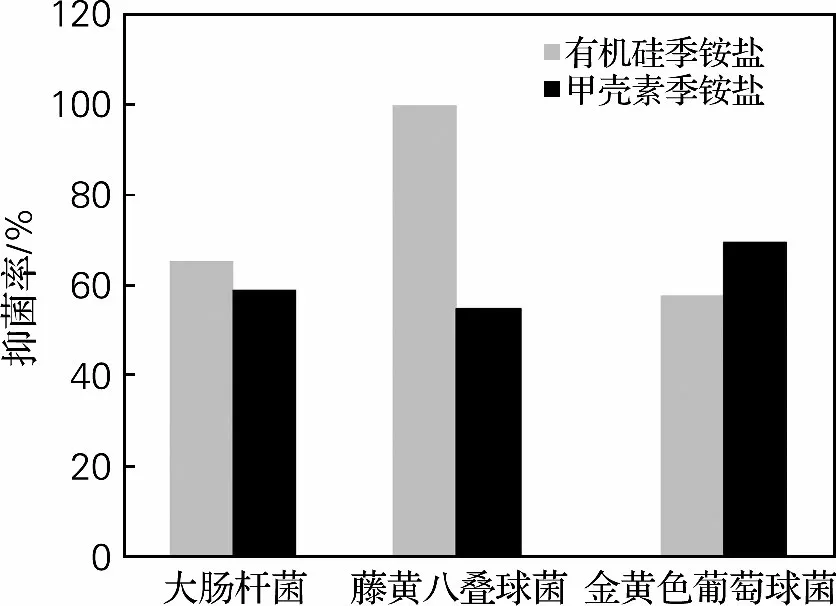
图1 抗菌谱的确定Fig.1 Determination of antibacterial spectrum
2.2 最低抑菌浓度的测定
2.2.1 抗菌剂的最低抑菌浓度
在一定范围内,随着OSQAS浓度的增大,对大肠杆菌的抑菌活性逐渐增强(表1);当OSQAS达到0.032 4mg/mL时,对大肠杆菌的抑菌效果最佳。同时,通过活菌菌落计数法佐证了OSQAS对大肠杆菌具有良好的抑菌效果。
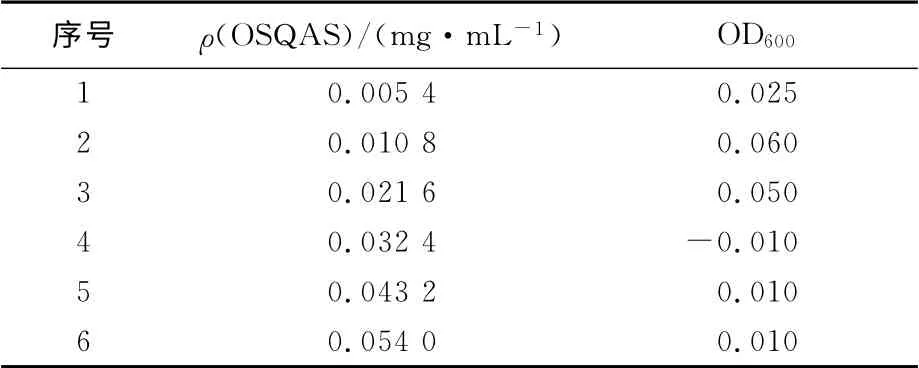
表1 OSQAS对大肠杆菌的最低抑菌浓度Tab.1 The MIC of OSQAS for E.coli
表2表明,OSQAS 对金黄色葡萄球菌的抑菌效果同样具有浓度依赖性,当其质量浓度增加到0.021 6mg/mL时,抑菌率达到96.15%;当浓度为0.032 4mg/mL时,抑菌率达到100%。
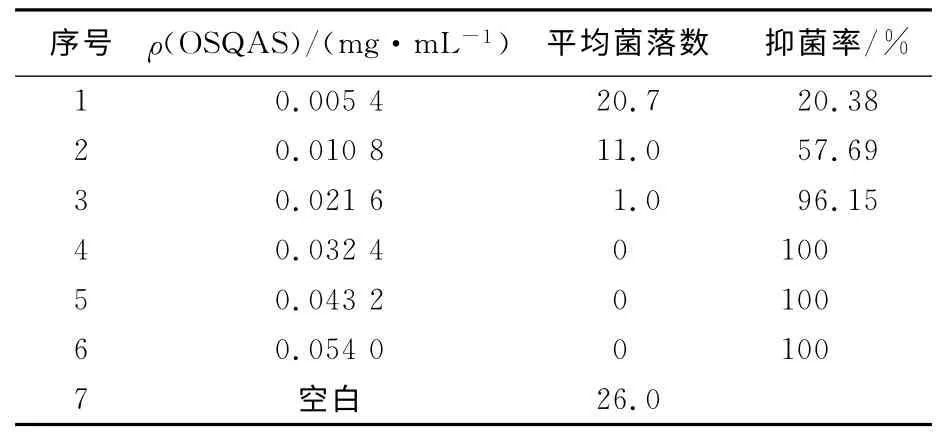
表2 OSQAS对金黄色葡萄球菌的最低抑菌浓度Tab.2 The MIC′of OSQAS for S.aureus
图2表明,随着HACC浓度的升高,对大肠杆菌与金黄色葡萄球菌的抑菌率逐渐增大。HACC对大肠杆菌的最低抑菌浓度为0.07 mg/mL;当HACC为0.1 mg/mL 时,对金黄色葡萄球菌的抑菌率达到97.94%。这表明HACC 对革兰阳性菌和革兰阴性菌均具有良好的抑菌性。

图2 HACC的最低抑菌浓度Fig.2 The MIC of HACC for E.coli and S.aureus
2.2.2 复配后的混合抗菌剂的最低抑菌浓度
如表3所示,当HACC 与OSQAS的质量浓度配比为0.5MICHACC/0.5MICOSQAS时,复配剂对大肠杆菌的抑菌率就可以达到98.68%。研究表明,由于OSQAS是一种表面活性剂,当含量过大时,反而使菌落成片生长,对抑菌不利。OSQAS与HACC复配后,抑菌效果大大超出两种抗菌剂单独作用时的抑菌效果,同时两种抗菌剂复配后,作用于菌液时,所需浓度也比单独作用的MIC低得多。该结果对于发展复配抗菌剂具有重要的指导意义。

表3 复配剂对大肠杆菌的最低抑菌浓度Tab.3 The MIC of combinations of both quaternary ammonium salts for E.coli
表4表明,OSQAS与HACC 复配后作用于金黄色葡萄球菌时,仅使用单独作用金黄色葡萄球菌的最低抑菌浓度的一半时,抑菌率就达到了96.05%;而当HACC 与OSQAS的质量浓度配比为0.67MIC′HACC/0.67MIC′OSQAS时,复配剂对大肠杆菌的抑菌得就达到99.44%。说明复配抗菌剂对金黄色葡萄球菌的抑菌效果非常显著。
2.3 复配抗菌剂的作用时间与热稳定性
表5、6所示,影响复配抗菌剂对大肠杆菌菌悬液抑菌效果的主要因素是温度和复配剂的热稳定性。该复配抗菌剂作用于大肠杆菌时,作用20min后,复配抗菌剂对大肠杆菌的抑菌率高达97.53%。这表明复配抗菌剂短时间作用于大肠杆菌菌悬液时,就可以获得最佳的抗菌活性。同时,复配抗菌剂的抑菌活性随温度的升高而增强,温度过低达不到最好的抑菌效果;当处理温度为40 ℃时,抑菌效果达到最佳。表5结果还表明,随着处理温度继续升高,抑菌率没有改变,说明复合抗菌剂具有良好的热稳定性。

表4 复配剂对金黄色葡萄球菌的最低抑菌浓度Tab.4 The MIC of combinations of both quaternary ammonium salts for S.aureus
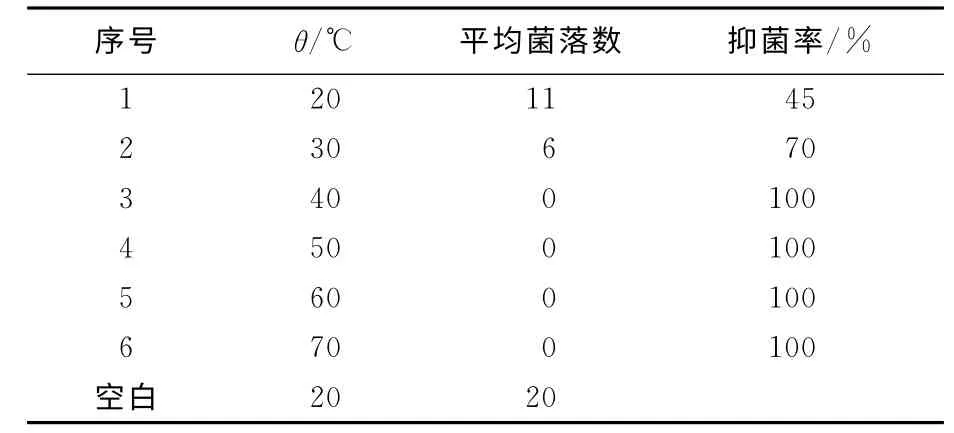
表5 复合抗菌剂的热稳定性Tab.5 The thermal stability of combinations of both quaternary ammonium salts for E.coli
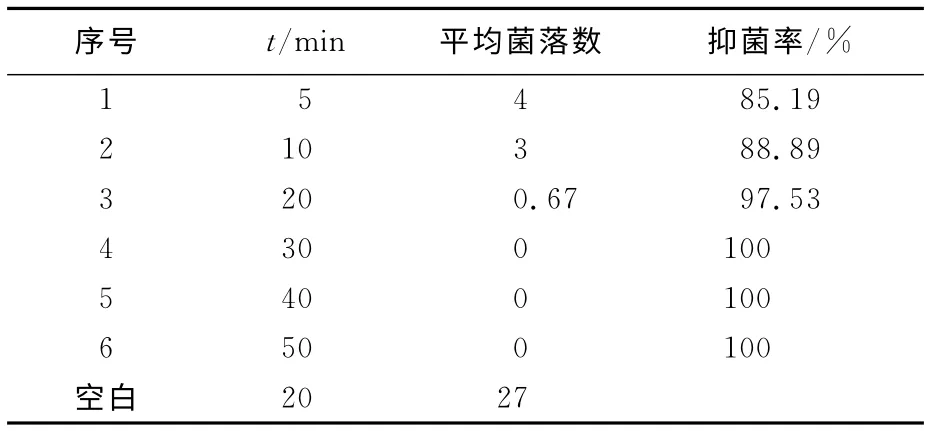
表6 复合抗菌剂的作用时间Tab.6 Time of antibacterial of combinations of both quaternaryammonium salts for E.coli
3 结 论
有机硅季铵盐与甲壳素季铵盐的抗菌谱均为大肠杆菌、藤黄八叠球菌和金黄色葡萄球菌。OSQAS对大肠杆菌和金黄色葡萄球菌的MIC均为0.032 4 mg/mL。HACC 对 大 肠 杆 菌 的MIC为0.07mg/mL,此时的抑菌率为99.54%;而对金黄色葡萄球菌的MIC 为0.1mg/mL。两种季铵盐复配后作用于大肠杆菌,HACC 与OSQAS在浓度配比为0.5MICHACC/0.5MICOSQAS时抑菌率达到98.68%,仅为单独使用时0.5d的MIC就达到了非常好的抑菌效果,优于前人的报告结果[11]。
与单独使用相比,有机硅季铵盐与甲壳素季铵盐复配后可以提高对致病菌的抗菌活性,并且具有杀菌时间短、见效快、抑菌率高等优点,有助于扩宽新一代季铵盐抗菌剂的应用范围。
[1]延秀银,王小晋,刘桂花,等.季铵盐、季膦盐类高分子抗菌剂的研究进展[J].广州化学,2012,37(4):56-61.
[2]佟会,邱树毅.季铵盐类抗菌剂及其应用研究进展[J].贵州化工,2006,31(5):1-7.
[3]王天奇,李翰祥,姚进孝,等.(1→3)-α-D-葡聚糖的季铵盐合成及其抗菌活性[J].北京化工大学学报,2004,34(4):418-420.
[4]谢瑜,张昌辉,徐旋.有机硅季铵盐抗菌剂的研究进展[J].中国胶粘剂,2008,17(2):52-64.
[5]江山,王立,俞豪杰,等.新型有机高分子抗菌剂[J].高分子通报,2002(6):57-62.
[6]李淳,孙蓉,曾秋苑,等.有机高分子抗菌剂的制备及抗菌机理[J].离子交换与吸附,2011(3):79-84.
[7]雷万学,韩春亮,赵雪萍,等.季铵盐型壳聚糖衍生物的合成与抗菌性能[J].河南教育学院学报,2010,19(2):18-21.
[8]徐霞,雷万学,李正军,等.壳聚糖季铵盐衍生物的合成及其抗菌活性[J].信阳师范学院学报,2006,19(1):58-60.
[9]池伟林,曾林涛,张蕊,等.壳聚糖季铵盐与表面活性剂复配性能及杀菌活性研究[J].日用化学工业,2006,36(5):299-302.
[10]CHAKRABARTY S,KING A,KURT P,et al.Highly effective,water-soluble,hemocompatible 1,3-propylene oxide-based antimicrobials:Poly(3,3-quaternary/PEG)-copolyoxetanes[J].Biomacromolecules,2011,12(3):757-769.
[11]董为民,左华江,吴丁财,等.季铵盐高分子抗菌剂的工艺优化与抗菌性能研究[J].离子交换与吸附,2011,27(1):1-9.
