类叶升麻苷通过激活ERK1/2诱导血红素加氧酶-1的表达
2015-02-23王洪权王玉敏崔其福赵伟丽王丽娜张俊毅
王洪权,王玉敏,崔其福,赵伟丽,王丽娜,张俊毅,4
(赤峰学院:1. 医学院,内蒙古赤峰市 024000;2. 附属医院神经内科; 3. 附属医院肿瘤内科;4. 附属医院病理科,内蒙古赤峰市 024005)
◇中医药研究◇
类叶升麻苷通过激活ERK1/2诱导血红素加氧酶-1的表达
王洪权1,2,王玉敏1,3,崔其福2,赵伟丽2,王丽娜1,张俊毅1,4
(赤峰学院:1. 医学院,内蒙古赤峰市 024000;2. 附属医院神经内科; 3. 附属医院肿瘤内科;4. 附属医院病理科,内蒙古赤峰市 024005)
目的 探讨类叶升麻苷(actesoide)诱导血红素加氧酶-1(HO-1)表达的信号机制。方法 类叶升麻苷单独处理体外培养的PC12细胞或运用ERK1/2抑制剂PD98059预处理, 提取细胞蛋白,Western blot方法检测pERK1/2和ERK1/2以及HO-1蛋白表达水平。结果 与正常对照组相比, 类叶升麻苷可以诱导HO-1的表达上调,类叶升麻苷激活ERK1/2,后者激活介导类叶升麻苷诱导HO-1的表达上调,因为PD98059预处理后可以减弱类叶升麻苷引起的HO-1蛋白表达水平降低。结论 类叶升麻苷通过激活ERK1/2通路诱导HO-1的表达。
类叶升麻苷;血红素加氧酶-1;细胞外调节蛋白激酶
筛选出能够上调血红素加氧酶-1(heme oxygenase-1, HO-1)表达的天然化合物成为探讨治疗氧化应激相关性神经退行性疾病治疗的新途径[1]。HO-1的保护作用引起了研究者的广泛关注[2-4]。我们的前期研究表明,天然化合物类叶升麻苷(actesoide, AS)能够在体内和体外诱导HO-1的表达,但其上调的信号转导机制有待于进一步探讨。最近研究显示,MAPKs主要参与ho-1基因的活化,MAPK可参与不同的HO-1诱导剂介导的ho-1基因的活化机制[5-6]。因此,本研究将从MAPK通路探讨HO-1的表达机制,探讨类叶升麻苷是否激活MAPK上调HO-1的表达。
1 材料与方法
1.1 材料 类叶升麻苷(分子结构见图1)购自Winherb Medical Technology Inc, HO-1抗体(#SPA895) 购自Stressgen公司。rabbit anti-phospho-ERK1/2 (Thr202/Tyr204) antibody (#9101)、rabbit anti-ERK antibody (#9102) 购自CST公司。免疫印迹化学发光试剂(electrochemiluminescence, ECL)购自Santa cruz公司,PVDF膜购自Millpore公司。
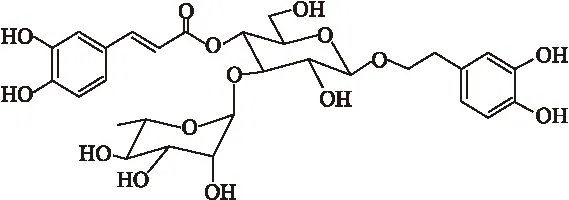
图1 类叶升麻苷的分子结构图
Fig.1 Molecular structure of actesoide
1.2 主要仪器 Western Blot电泳仪(Bio-Rad公司),酶标仪(Bio-Rad公司),多用脱色摇床(上海新波无线电厂),超纯水净化仪(Millipore公司)。
1.3 PC12细胞的培养 PC12细胞接种在含50 mL/L胎牛血清、100 mL/L马血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养基中(pH 7.2),37 ℃、50 mL/L CO2温育。细胞接种后每2~3 d换液1次,9/10融合时转种到相应的培养皿或培养板里,温育48 h后作为实验细胞。
1.4 Western blot 按照文献方法进行[7]。以β肌动蛋白作为内参照,计算待测蛋白条带积分吸光度与β肌动蛋白的比值,表示待测蛋白的相对表达水平。
1.5 统计学分析 结果以均数±标准差表示。资料采用GraphPad Prism 4.0 Software (GraphPad Software, Inc.,San Diego, CA)分析软件进行统计分析,多样本均数比较用单因素方差分析,P<0.05被认为差异具有统计学意义。
2 结 果
2.1 类叶升麻苷诱导HO-1蛋白的表达 首先检测类叶升麻苷对HO-1表达的可能影响。类叶升麻苷 (1、20、30 μmol/L)单独处理PC12细胞,提取蛋白,蛋白印记方法检测HO-1的表达。结果显示,类叶升麻苷可诱导HO-1的表达(图2)。
2.2 类叶升麻苷激活ERK通路 为了进一步探讨类叶升麻苷诱导HO-1表达上调的信号转导机制,首先研究类叶升麻苷是否通过MAPK通路上调HO-1的表达。结果表明,类叶升麻苷激活ERK1/2,类叶升麻苷时间依赖性(图3)升高磷酸化水平的ERK1/2。而对JNK和p38MAPK的激活没有影响(结果未显示)。
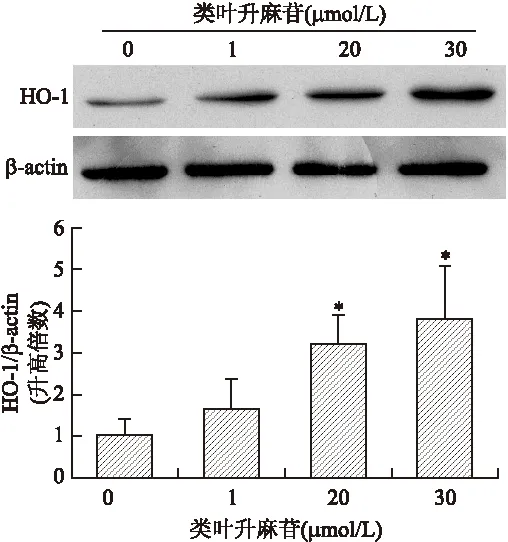
图2 类叶升麻苷诱导HO-1蛋白的表达
Fig.2 Acteoside induced HO-1 expression in PC12 cells
各种浓度的类叶升麻苷作用于细胞12 h,提取细胞蛋白,进行免疫印迹检测HO-1和β-actin表达。与正常对照组比较,*P<0.05。
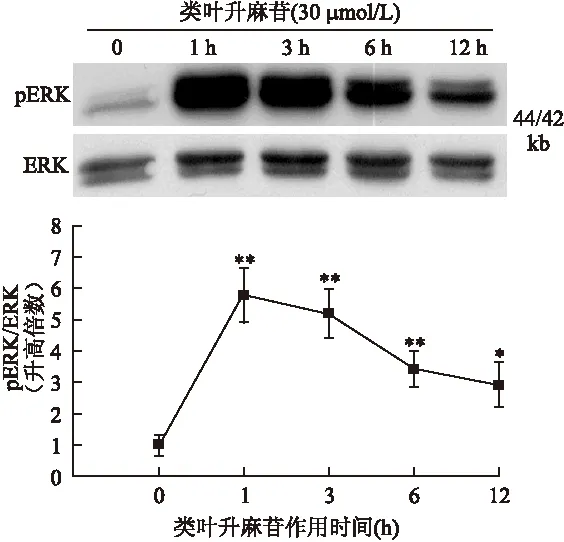
图3 类叶升麻苷激活ERK1/2通路
Fig.3 Actesoide activated ERK kinase pathway
30 μmol/L 类叶升麻苷作用于PC12细胞不同时间,提取细胞蛋白,进行进行免疫印迹检测磷酸化ERK1/2(pERK1/2)和总的ERK1/2。
2.3 ERK抑制剂可抑制类叶升麻苷诱导的ERK激活 类叶升麻苷可以激活ERK,接下来研究ERK抑制剂PD98059是否可以抑制类叶升麻苷诱导的ERK激活。结果发现,ERK抑制剂PD98059剂量依赖性降低类叶升麻苷诱导的ERK激活,即磷酸化的ERK1/2(pERK1/2)的量随着PD98059剂量的增加而逐渐降低(图4)。
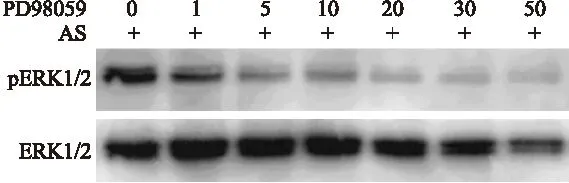
图4 ERK抑制剂PD98059剂量依赖性降低类叶升麻苷诱导的ERK激活
Fig.4 PD98059 inhibited actesoide-induced activation of ERK kinase in a dose-dependent manner
ERK1/2抑制剂 PD98059预处理细胞1 h后加入30 μmol/L 类叶升麻苷作用6 h,提取细胞蛋白,进行免疫印迹检测磷酸化的ERK1/2(pERK1/2)和总ERK1/2。
2.4 类叶升麻苷通过激活ERK诱导HO-1的表达上调 为了进一步阐明ERK1/2通路的激活在类叶升麻苷诱导的HO-1表达上调中的作用,接下来研究PD98059(ERK1/2特异性抑制剂)抑制ERK的激活后对类叶升麻苷引起的HO-1表达上调的影响。结果显示,PD98059能够抑制类叶升麻苷引起的HO-1表达上调(图5)。这表明ERK1/2通路的激活参与类叶升麻苷引起的HO-1表达上调。因此,类叶升麻苷可通过激活ERK1/2 通路上调HO-1的表达。
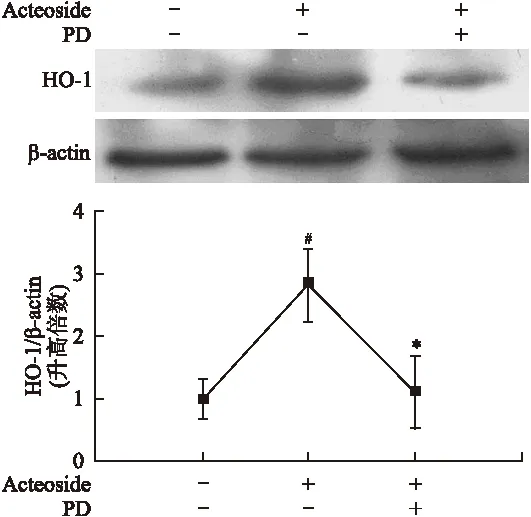
图5 ERK1/2的激活参与类叶升麻苷诱导HO-1的表达
Fig.5 Actesoide upregulated HO-1 expression through activating ERK kinase pathway
ERK1/2抑制剂 PD98059预处理细胞1 h后加入30 μmol/L 类叶升麻苷作用6 h,提取细胞蛋白,进行免疫印迹检测HO-1和β-actin。与对照组相比,#P<0.05;与类叶升麻苷单独处理组相比,*P<0.05。
3 讨 论
类叶升麻苷(actesoide)是一种糖苷类,其最早分离自毛蕊花素(verbascum sinuatum)并被命名为“verbascoside”。1968年, BIRKOFER 阐明了其化学结构,并引进了其新的名字“Actesoide”。 以前研究表明,类叶升麻苷具有许多药理学活性,如肝保护活性、抗凋亡活性和抗氧化活性[8-10]。最近研究显示,类叶升麻苷具有神经保护活性,其可以抑制1-甲基-4-苯基吡啶(1-methyl-4-phenylpyridinium ion, MPP+)和谷氨酸诱导的神经损伤[11-13]。另外,AS也可抑制鱼藤酮致SH-SY5Y细胞损伤[14-15],并在MPTP所致的帕金森病小鼠模型具有神经保护作用[16]。最近研究显示,类叶升麻苷可降低tau蛋白的磷酸化而在冈田酸诱导的阿尔茨海默病细胞模型中发挥其神经保护作用[17]。目前,AS的保护作用机制主要集中在其抗氧化[18]、抗凋亡活性[9],其药理学活性机制有待于进一步研究。我们前期研究表明,类叶升麻苷可在SD大鼠的皮层神经元、纹状体细胞、肾脏和肝脏中上调HO-1的表达,同时其亦可在PC12细胞中上调HO-1的表达,但其上调HO-1的机制不明。因此,本研究从MAPK信号通路水平探讨类叶升麻苷诱导HO-1表达上调的机制。
前人的研究表明,HO-1诱导剂激活蛋白磷酸化依赖的信号通路,最终活化调节ho-1基因表达的转录因子。最近研究显示,MAPKs主要参与ho-1基因的活化,MAPK可参与不同的HO-1诱导剂介导的ho-1基因的活化[5],MAPK为第一个确定的参与HO-1的表达调节的激酶。本研究结果显示,类叶升麻苷可以时间依赖性(图3)激活ERK1/2,而这种激活直接参与类叶升麻苷对HO-1表达上调的机制,因为ERK1/2特异性抑制剂PD98059抑制类叶升麻苷引起的HO-1表达上调。这表明类叶升麻苷通过激活ERK1/2 通路上调HO-1的表达。
总之,本研究鉴定出类叶升麻苷为一个新的诱导HO-1表达的新的化合物,其可通过激活ERK1/2来诱导HO-1的表达上调。本研究阐明了类叶升麻苷的新的药理作用,为进一步探讨其神经保护作用机制提供了依据,为进一步研究类叶升麻苷在氧化应激损伤性疾病中的神经保护作用奠定了实验基础。
[1] 钱海蓉,胡亚卓,张红红,等. 血红素加氧酶在阿尔茨海默病中的表达及意义[J]. 中国临床神经科学, 2010, 18(4):337-342.
[2] 乔丽杰,王延让,张明. Nrf2/HO-1通路在氧化损伤保护机制中研究进展[J]. 中国职业医学, 2013, 40(1):82-84.
[3] 薛挥,郭花,焦捷英. 血红素氧合酶-1对肝硬化大鼠肝脏缺血再灌注损伤的保护作用[J]. 西安交通大学学报:医学版, 2007, 28(1):47-50.
[4] 石晓东,尹闻科,张雄,等. 姜黄素对SH-SY5Y细胞血红素加氧酶同工酶表达的影响[J]. 中国药理学通报, 2010, 26(6):740-744.
[5] RYTER SW, ALAM J, CHOI AM. Heme oxygenase-1/carbon monoxide: from basic science to therapeutic applications[J]. Physiol Rev, 2006, 86(2):583-650.
[6] 庞天龙,曾仲. 调控血红素加氧酶1的信号转导通路的研究进展[J]. 国际移植与血液净化杂志, 2012, 10(3):14-17.
[7] 王洪权,赵伟丽,崔其福,等. 虾青素通过JNK和p38MAPK通路抑制Aβ诱导的神经毒性损伤[J]. 西安交通大学学报:医学版, 2013,35(2):205-209.
[8] XIONG Q, HASE K, TEZUKA Y, et al. Acteoside inhibits apoptosis in D-galactosamine and lipopolysaccharide-induced liver injury[J]. Life Sci, 1999, 65(4):421-30.
[9] PU X, SONG Z, LI Y, et al. Acteoside from Cistanche salsa inhibits apoptosis by 1-methyl-4-phenylpyridinium ion in cerebellar granule neurons[J]. Planta Med, 2003, 69(1):65-66.
[10] CHIOU WF, LIN LC, CHEN CF. Acteoside protects endothelial cells against free radical-induced oxidative stress[J]. J Pharm Pharmacol, 2004, 56(6):743-748.
[11] SHENG GQ, ZHANG JR, PU XP, et al. Protective effect of verbascoside on 1-methyl-4-phenylpyridinium ion-induced neurotoxicity in PC12 cells[J]. Eur J Pharmacol, 2002, 451(2):119-124.
[12] LI YY, LU JH, LI Q, et al. Pedicularioside A from Buddleia lindleyana inhibits cell death induced by 1-methyl-4-phenylpyridinium ions (MPP+) in primary cultures of rat mesencephalic neurons[J]. Eur J Pharmacol, 2008, 579(1-3):134-140.
[13] KOO KA, KIM SH, OH TH, et al. Acteoside and its aglycones protect primary cultures of rat cortical cells from glutamate-induced excitotoxicity[J]. Life Sci, 2006, 79(7):709-716.
[14] 高燕, 蒲小平. 类叶升麻苷抗鱼藤酮致SH-SY5Y细胞损伤机制的研究[J]. 中国药理学通报, 2007, 23(2):161-165.
[15] 杨芳艳, 蒲小平. 类叶升麻苷对鱼藤酮致SH-SY5Y细胞凋亡的保护作用[J]. 中国药理学通报, 2006, 22(2):159-164.
[16] 赵磊,蒲小平. 类叶升麻苷对MPTP所致帕金森病小鼠模型的神经保护作用[J]. 中国药理学通报, 2007, 23(1):42-46.
[17] 白鹏,彭晓明,高莉,等. 类叶升麻苷对冈田酸诱导的阿尔茨海默病细胞模型的保护作用研究[J]. 中国中药杂志, 2013, 38(9):1323-1326.
[18] 彭晓明,高莉,甘萍,等. 类叶升麻苷抗H2O2诱导的PC12细胞氧化损伤的保护作用[J]. 中药药理与临床, 2013, 29(3):35-38.
(编辑 韩维栋)
Actesoide induces heme oxygenase-1 expression through activating ERK1/2 pathway
WANG Hong-quan1,2, WANG Yu-min1,3, CUI Qi-fu2, ZHAO Wei-li2, WANG Li-na1, ZHANG Jun-yi1,4
(1. Chifeng Medical College, Chifeng University, Chifeng 024000, China; 2. Department of Neurology; 3. Department of Oncology; 4. Department of Pathology, the Affiliated Hospital of Chifeng Uinversity, Chifeng 024005, China)
Objective To investigate the molecular mechanism for actesoide inducing heme oxygenase-1 (HO-1) expression through activating ERK1/2 pathway. Methods Cultured PC12 cells were treated with preincubated with or without ERK1/2 inhibitor, PD98059. The expressions of pERK1/2, ERK1/2 and HO-1 protein were measured by Western blot. Results Actesoide induced the upregulated expression of HO-1 in a concentration-dependent manner. Actesoide activated the ERK1/2 cascade. Actesoide treatment resulted in time-related induction of the phosphorylation of ERK1/2 in PC12 cells. Actesoide-induced HO-1 expression was blocked by ERK1/2 inhibitor PD98059 in a concentration-dependent manner. Conclusion Actesoide induces HO-1 expression through activating ERK1/2 pathway.
actesoide; heme oxygenase-1; ERK1/2; expression
2014-02-17
2014-04-30
国家自然科学基金项目资助项目(No.81260196, 81450036, 81201844);内蒙古自治区高等学校青年科技英才支持计划(No.NJYT-13-B20);内蒙古自治区高等学校科学研究项目(No.NJZZ12306, NJZZ14271);国家社科基金项目(No.13CRK009); 内蒙古自然科学基金项目(No.2014MS0892, 2014BS0802, 2014MS0814, 2013MS1176) Supported by the National Natural Science Foundation of China (No.81260196, 81450036, 81201844), Program for Young Talents of Science and Technology in Universities of Inner Mongolia Autonomous Region (No.NJYT-13-B20), Scientific Research Projects in Universities of Inner Mongolia Autonomous Region (No.NJZZ12306, NJZZ14271), the National Social Science Foundation of China (No.13CRK009), and the Natural Science Foundation of Inner Mongolia Autonomous Region (No.2014MS0892, 2014BS0802, 2014MS0814, 2013MS1176)
王洪权. E-mail: whongquan@alu.fudan.edu.cn
R741.05
A
10.7652/jdyxb201501022
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20141119.0900.007.html(2014-11-19)
