弥漫性轴索损伤后CD4+/CD8+ T细胞比值、IL-6、IL-10 水平变化及预后相关危险因素的Logistic回归分析
2015-02-23宋锦宁李丹东赵永林郭小叶屈建强王睿智权俊杰
张 明,宋锦宁,李丹东,赵永林,吴 媛,郭小叶,屈建强,王睿智,权俊杰
(西安交通大学医学院:1.第二附属医院神经外科,陕西西安 710004;2.第一附属医院神经外科,陕西西安 710061; 3.第二附属医院重症医学科,陕西西安 710004)
◇专题研究◇
弥漫性轴索损伤后CD4+/CD8+T细胞比值、IL-6、IL-10 水平变化及预后相关危险因素的Logistic回归分析
张 明1,2,宋锦宁2,李丹东2,赵永林2,吴 媛3,郭小叶2,屈建强1,王睿智1,权俊杰1
(西安交通大学医学院:1.第二附属医院神经外科,陕西西安 710004;2.第一附属医院神经外科,陕西西安 710061; 3.第二附属医院重症医学科,陕西西安 710004)
目的 研究弥漫性轴索损伤(DAI)后患者外周血CD4+/CD8+T细胞比值及炎症因子IL-6、IL-10水平的变化,探讨影响DAI患者预后的相关危险因素及可能的预测因子。方法 收集115例DAI患者的相关临床资料及伤后至少6个月的随访结果,并将采集的患者外周血采用流式细胞仪检测CD4+、CD8+T细胞及其比值,ELISA法检测IL-6、IL-10水平,对免疫炎症指标及临床资料进行单因素和多因素分析,多因素分析采用Logistic回归分析。结果 DAI后合并其他脑损伤、瞳孔改变、伤后昏迷时间及入院时GCS评分是影响患者预后的危险因素,而其他因素则与预后不相关。CD4+/CD8+T淋巴细胞比值降低是DAI后发生ARDS/ALI的危险因素,CD4+/CD8+T淋巴细胞比值与患者预后关系不大,而ARDS/ALI的发生则是影响DAI患者预后的重要危险因素。IL-6增加与DAI后ARDS/ALI密切相关,可作为ARDS/ALI发生的预测因子,其水平是患者预后的危险因素,而IL-10则在此过程中与ARDS/ALI不相关,且与患者预后无关。结论 CD4+/CD8+T淋巴细胞比值降低是DAI后发生ARDS/ALI的危险因素,IL-6可作为ARDS/ALI发生的预测因子。DAI后与患者预后相关的危险因素包括合并其他脑损伤、瞳孔改变、伤后昏迷时间、入院时GCS评分、IL-6水平及并发ARDS/ALI。
弥漫性轴索损伤;CD4+T淋巴细胞;CD8+T淋巴细胞;IL-6;IL-10;颅脑损伤
创伤性脑损伤(traumatic brain injury, TBI)以青壮年男性多见,发病率及死亡率高,流行病学调查显示,约39%的重度TBI患者在伤后死亡,而60%左右的患者预后不良[1-2]。大量研究表明,神经免疫炎症的发生是TBI后一个重要的继发性损伤机制,可促进与TBI相关的持续的神经退行性变和神经功能损害,TBI后T淋巴细胞亚群(CD4+、CD8+)可能与患者细胞免疫功能抑制相关[3-4],而患者外周血或脑脊液中的免疫炎症相关因子如IL-6、IL-8、IL-10等则与脑损伤程度相关[5]。由于TBI后主要的病理学改变之一是弥漫性轴索损伤(diffuse axonal injury,DAI),但是,DAI患者免疫功能抑制后免疫炎症相关指标改变是否会引起相关并发症的发生,以及与患者预后之间的关系尚不明确。本研究以健康人群为对照,研究DAI后患者外周血CD4+/CD8+T细胞比值及促炎因子IL-6、抗炎因子IL-10水平变化及与相关并发症的相关性,旨在探讨影响DAI患者预后的相关危险因素及可能的预测因子。
1 资料与方法
1.1 研究对象及分组 选择2008年6月至2013年6月西安交通大学医学院第一附属医院及第二附属医院神经外科收治入院的146例诊断为DAI的患者,全组患者诊断标准及治疗方法一致。病例纳入标准:①符合DAI的临床及影像学诊断标准[6-7];②有完整病例资料及伤后6个月以上的随访;③排除既往颅内病变史、严重多发复合伤、严重慢性疾病史等以及临床病例资料不齐全的患者。经过筛选排除31例不符合病例纳入标准的患者,共有115例患者入选。均征得患者家属知情同意,并通过医院伦理委员会批准。选择健康查体人群为正常对照组,共45例,其中男性32例,女性13例,平均年龄为(35.56±14.23)岁,均排除高血压、糖尿病、神经系统相关疾病、颅脑外伤及心肺肝肾等重要脏器疾病。正常对照组与DAI预后良好组及不良组之间的性别、构成比、年龄,经统计学处理差异均无统计学意义。
1.2 病例资料特点及处理 本组患者病例资料见表1。本组病例中,25例有开放性损伤患者立即行清创术;合并颅内血肿的患者中5例血肿有占位效应,行幕上开颅血肿清除并去骨瓣减压术;其余合并颅内血肿的患者因生命体征不平稳或血肿量少、无明显占位效应,未行手术治疗。所有患者均收住神经外科重症监护室,给予常规脱水、抑酸、防止感染、保护神经元等治疗,维持水电解质平衡,保持呼吸道通畅,保护周围脏器功能完整,加强基础护理,积极防治并发症,注意加强全身营养支持治疗,严密监测生命体征改变。对昏迷时间较长患者行气管切开术。
1.3 研究指标 监测入院第1、3、7、15天CD4+、CD8+T淋巴细胞水平、CD4+/CD8+比值以及细胞因子IL-6、IL-10的含量。所有患者入院后均进行格拉斯哥昏迷评分(Glasgow coma scale, GCS),所有患者均在伤后6个月进行格拉斯哥预后评分(Glasgow outcome scale, GOS)。将伤后昏迷时间长短分为4级,<1 h为1级,1~6 h为2级,6~24 h为3级,>24 h为4级,死亡及植物状态记为4级。将患者的性别、年龄、致伤原因、伤后体征、入院格拉斯哥昏迷评分(GCS)、入院瞳孔变化及并发症等作为统计分析的指标。预后判断:除外住院期间死亡的患者(21例),在伤后至少6个月以后对其余患者行电话、通信随访,最长随访时间为1年。根据GOS量表评价患者预后。分为预后不良组(1~3分,共57例)、预后良好组(4~5分,共58例)。
1.4 主要试剂及仪器 FITC标记的CD4+及PE标记的CD8+抗体试剂(BD Biosciences,美国);人IL-6、人IL-10 ELISA试剂盒(BD Biosciences,美国);流式细胞仪(Beckman Coulter EPICS XL4,美国)。
表1 115例患者病例资料及各因素与预后的关系
Tab.1 The clinical information of 115 patients and the relationship between risk factors and outcomes (Chi-Square test)
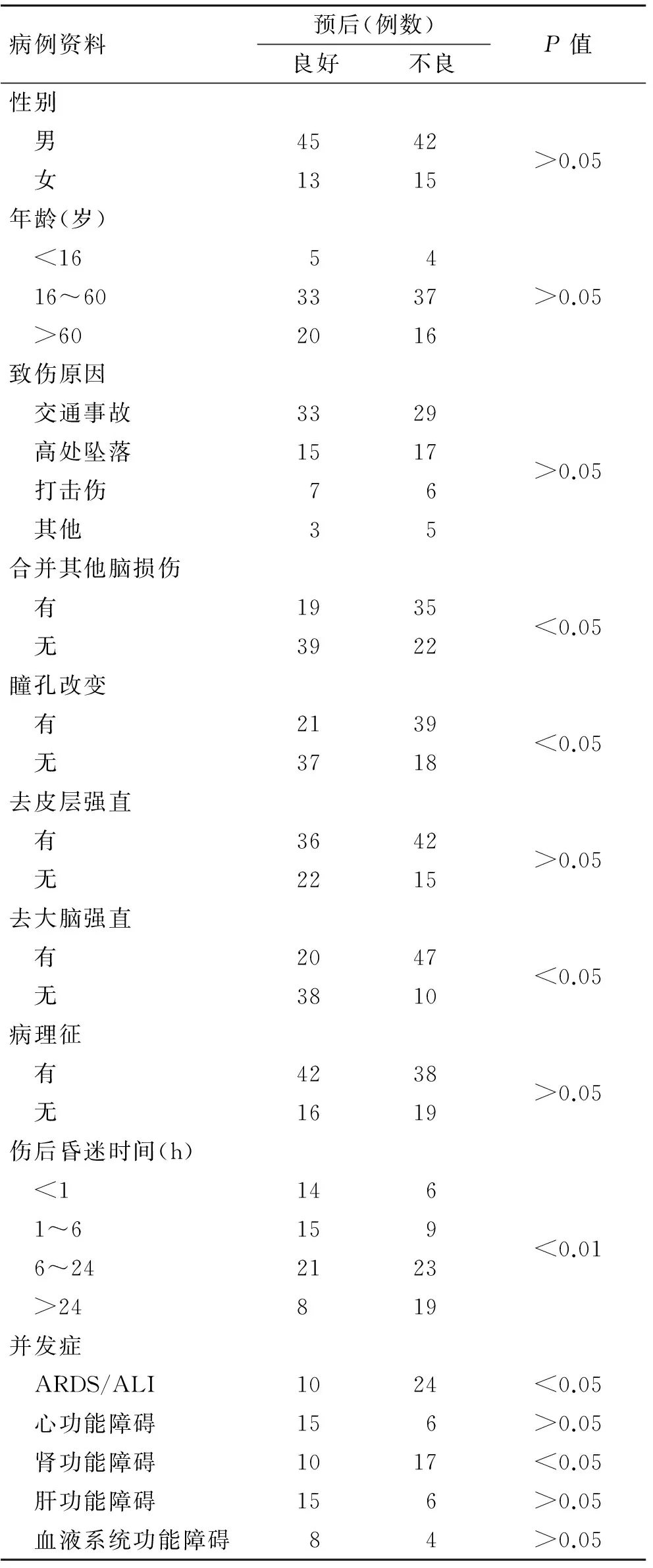
病例资料预后(例数)良好不良P值性别 男4542 女1315>0.05年龄(岁) <1654 16~603337 >602016>0.05致伤原因 交通事故3329 高处坠落1517 打击伤76 其他35>0.05合并其他脑损伤 有1935 无3922<0.05瞳孔改变 有2139 无3718<0.05去皮层强直 有3642 无2215>0.05去大脑强直 有2047 无3810<0.05病理征 有4238 无1619>0.05伤后昏迷时间(h) <1146 1~6159 6~242123 >24819<0.01并发症 ARDS/ALI1024<0.05 心功能障碍156>0.05 肾功能障碍1017<0.05 肝功能障碍156>0.05 血液系统功能障碍84>0.05
1.5 实验方法
1.5.1 CD4+、CD8+T淋巴细胞水平、CD4+/CD8+比值的检测 采集2 mL静脉血于上机管中,检测其白细胞数及淋巴细胞数,控制白细胞数在5×109个/L。避光条件下分别加入CD4+、CD8+相应荧光抗体试剂30 μL, 振荡并混匀。置室温暗处孵育15 min。加入1.5 mL红细胞溶解液迅速于混旋器上混匀。再置室温暗处孵育10 min后,1 500 r/min离心5 min,弃上清,留下50 μL残液。于混旋器彻底混匀沉淀物后,加入PBS溶液5 mL洗涤,并以1 200 r/min离心沉淀5 min,弃上清,如此3次。混匀细胞后加入40 g/L多聚甲醛300 μL振荡混匀,固定后上流式细胞仪检测。分析采用CELL Quest软件。
1.5.2 细胞因子IL-6、IL-10含量的检测 所有标本均离心分离后留取血清,标本存放于冰箱内-20 ℃以下冷冻保存。标本均采用放射免疫法测定,严格按试剂盒说明对IL-6、IL-10进行测定。在450 nm处测吸光度(A)值,所有测得值减去空白值后再行计算。通过绘制标准曲线,根据各样本值在标准曲线上计算相应的IL-6、IL-10的含量。
1.6 统计学分析 应用SPSS 18.0统计软件分析数据。将患者伤后6个月预后作为因变量,选取患者入院时临床各项特征作为自变量。组间比较采用卡方检验(Chi-Square Test)及Fish’s精确概率法;多分类有序数据可采用Cochran-Mantel-Haenszel检验(Cochran-Mantel-Haenszel Test);重复测量数据采用方差分析(ANOVA)。采用前向逐步回归法对相关因素进行二值Logistic回归分析。以P<0.05表示差异有统计学意义。
2 结 果
2.1 单因素分析结果
2.1.1 各项研究指标与预后的关系 经单因素统计分析可知,DAI后合并其他脑损伤、瞳孔改变、去大脑强直、伤后昏迷时间、并发ARDS/ALI、肾功能障碍与患者预后有关(P<0.05)。而性别、年龄、致伤原因、去皮层强直、病理征及心、肝、血液系统功能障碍与患者预后不存在相关关系(表1)。
2.1.2 GCS与预后的关系 入院时GCS评分预后不良组共57例,入院时GCS评分为(4.78±1.23)分,预后良好组共58例,入院时GCS评分为(7.56±2.14)分。两组比较差异有统计学意义(P<0.05),说明入院时GCS与预后存在相关性。
2.1.3 CD4+/CD8+T淋巴细胞比值、IL-6、IL-10与ARDS/ALI的关系 与未发生ARDS/ALI组及对照组比较,发生ARDS/ALI组患者外周血中CD4+T淋巴细胞百分比含量在伤后第1天、第3天存在组间差别(P<0.05)。CD4+/CD8+T淋巴细胞比值在该组明显降低,在伤后第3天时,与未发生ARDS/ALI组相比存在组间差别(P<0.05);在第1、3天时与对照组相比存在组间差别(P<0.05)。未发生ARDS/ALI组与对照组相比较,其CD4+T淋巴细胞百分比含量、CD8+T淋巴细胞百分比含量及CD4+/CD8+T淋巴细胞比值则不存在组间差别(表2)。
表2 各组患者外周血T淋巴细胞亚群指标的比较
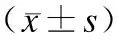
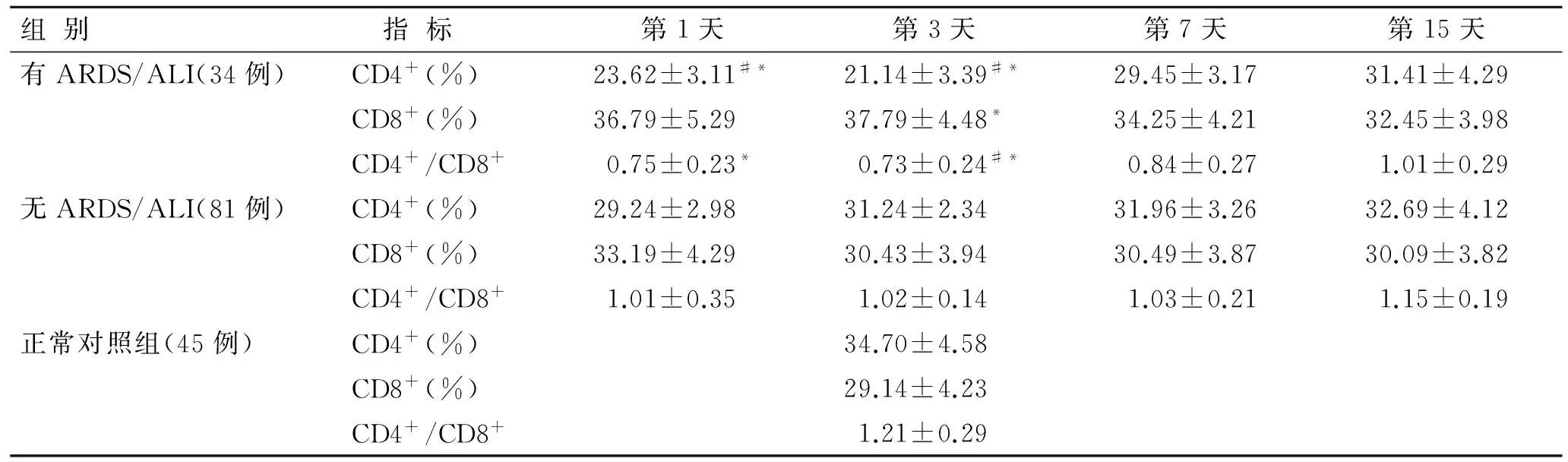
组别指标 第1天第3天第7天第15天有ARDS/ALI(34例)CD4+(%)23.62±3.11#*21.14±3.39#*29.45±3.1731.41±4.29CD8+(%)36.79±5.2937.79±4.48*34.25±4.2132.45±3.98CD4+/CD8+0.75±0.23*0.73±0.24#*0.84±0.271.01±0.29无ARDS/ALI(81例)CD4+(%)29.24±2.9831.24±2.3431.96±3.2632.69±4.12CD8+(%)33.19±4.2930.43±3.9430.49±3.8730.09±3.82CD4+/CD8+1.01±0.351.02±0.141.03±0.211.15±0.19正常对照组(45例)CD4+(%)34.70±4.58CD8+(%)29.14±4.23CD4+/CD8+1.21±0.29
与无ARDS/ALI组比较,#P<0.05;与对照组比较,*P<0.05。
DAI患者血清细胞因子IL-6水平均显著增高(P<0.05),其水平在外伤后第3天达到峰值,以后逐渐降低;发生ARDS/ALI组与未发生ARDS/ALI组及对照组在第1、3、7、15天时比较存在组间差别(P<0.05);血清细胞因子IL-10水平在发生ARDS/ALI组显著增高,与未发生ARDS/ALI组及对照组在第1、3、7、15天时比较存在组间差别(P<0.05)。未发生ARDS/ALI组中IL-10水平与对照组相比较不存在组间差别(表3)。
表3 各组患者血清IL-6、IL-10含量的比较
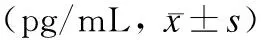
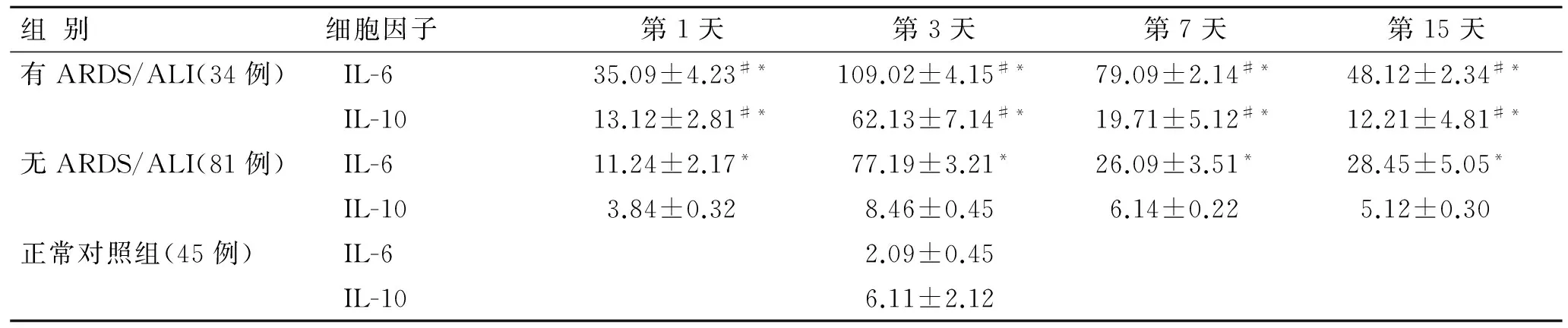
组别细胞因子第1天第3天第7天第15天有ARDS/ALI(34例)IL-635.09±4.23#*109.02±4.15#*79.09±2.14#*48.12±2.34#*IL-1013.12±2.81#*62.13±7.14#*19.71±5.12#*12.21±4.81#*无ARDS/ALI(81例)IL-611.24±2.17*77.19±3.21*26.09±3.51*28.45±5.05*IL-103.84±0.328.46±0.456.14±0.225.12±0.30正常对照组(45例)IL-62.09±0.45IL-106.11±2.12
与无ARDS/ALI组比较,#P<0.05;与对照组比较,*P<0.05。
2.2 多因素分析结果Logistic回归模型的建立:将本组病例中所有单因素分析变量以及本研究中的免疫学研究指标作为自变量,预后作为应变量,利用SPSS 18.0中的前向逐步法进行二元Logistic回归分析。入选因子和删除因子的概率临界值均规定为0.05。其余数项指标如去大脑强直、肾功能障碍、CD4+/CD8+比值、IL-10水平等因素未达到入选因子的概率临界值而未入选。独立相关危险因素中包括合并其他脑损伤、瞳孔改变、伤后昏迷时间、入院时GCS评分以及并发ARDS/ALI(表4)。
表4 DAI后6个月GOS影响因素的Logistic回归分析
Tab.4 The Logistic regression analysis of risk factors for GOS
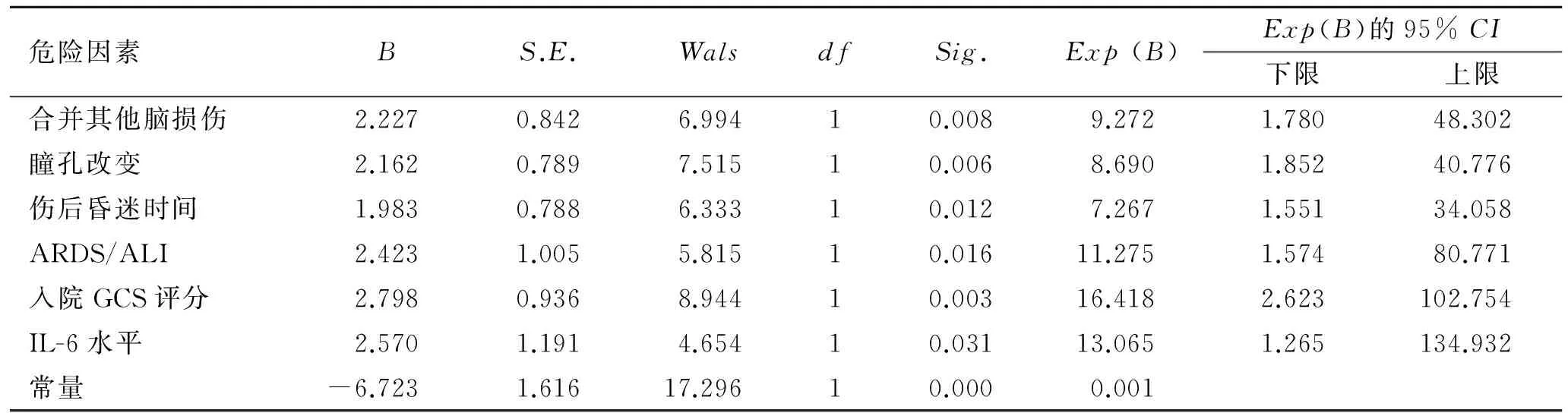
危险因素BS.E.WalsdfSig.Exp(B)Exp(B)的95%CI下限上限合并其他脑损伤2.2270.8426.99410.0089.2721.78048.302瞳孔改变2.1620.7897.51510.0068.6901.85240.776伤后昏迷时间1.9830.7886.33310.0127.2671.55134.058ARDS/ALI2.4231.0055.81510.01611.2751.57480.771入院GCS评分2.7980.9368.94410.00316.4182.623102.754IL-6水平2.5701.1914.65410.03113.0651.265134.932常量-6.7231.61617.29610.0000.001
3 讨 论
DAI是TBI后加速性或减速性剪切力对轴索造成的损伤[8]。DAI后极早期(数小时)内,轴突受到严重剪切后连续性改变可使轴突肿胀进而破坏轴突运输,细胞器向轴突处聚集,造成轴索断裂,形成Waller变性,最终形成轴索收缩球[9-10]。因此,DAI后病理学改变程度决定了患者的预后。本研究通过对病例资料特点与预后的单因素分析可见,DAI后是否合并其他脑损伤、瞳孔异常、去大脑强直、伤后昏迷时间、并发ARDS/ALI、肾功能障碍与患者预后有关,而性别、年龄、致伤原因、去皮层强直、病理征及心、肝、血液系统功能障碍与患者预后关系不大。Logistic回归分析结果表明,DAI后是否合并其他脑损伤、瞳孔改变、伤后昏迷时间及入院时GCS评分是影响患者预后的危险因素,而性别、年龄等因素则被剔除,这可能与本研究纳入的病例数有限相关。在危险因素中,瞳孔改变可反映DAI后脑干功能及受损程度,有研究发现双侧瞳孔异常是预后不良的独立危险因素[11]。GCS评分仍是判别DAI后患者病情轻重、评估患者预后的简单有效的指标,而患者伤后昏迷时间长短可作为GCS评估预后的辅助指标。
已有研究证明[12],神经炎症是DAI后脑损伤的关键病理学改变,但中枢神经系统由于缺少明显的淋巴系统、缺乏大脑实质中白细胞、主要组织相容性复合物抗原I及II型表达水平较低,更为重要的是血脑屏障的存在,决定了大脑免疫赦免状态,具备不引起免疫应答的能力。因此,即使DAI后血脑屏障受到破坏,中枢神经系统的上述特点决定了周围血T淋巴细胞对其影响不大,但可对外周器官尤其是呼吸系统造成严重影响,诱发ARDS/ALI。本研究结果显示,DAI后发生ARDS/ALI的患者外周血中CD4+T淋巴细胞百分比含量在伤后第1天、第3天显著降低,而CD8+T淋巴细胞水平虽有变化,但与未发生ARDS/ALI的患者及正常对照组相比不存在组间差别。发生ARDS/ALI的患者CD4+/CD8+T淋巴细胞比值在DAI后第1、3天与对照组相比存在组间差别,说明CD4+/CD8+T淋巴细胞比值降低是DAI后发生ARDS/ALI的危险因素,CD4+T淋巴细胞水平较CD8+T淋巴细胞水平更能说明免疫改变与ARDS/ALI发生的关系。进一步的Logistic回归分析结果表明,CD4+/CD8+T淋巴细胞比值与患者预后关系不大,而ARDS/ALI的发生则是影响DAI患者预后的重要危险因素。这与RINCON等[13]的研究结果一致。
实验性TBI模型的基因谱研究显示,与神经炎症相关的基因在损伤后的急性期内显著地被上调[14]。在人类TBI和脑损伤的动物模型中均发现,大脑实质中有来源于血液的免疫细胞聚集[15]。除了免疫细胞的渗透作用外,原有小神经胶质细胞活化可能在外伤性脑损伤后形成第一道防线。但当小神经胶质细胞过度激活或过度活化,则可通过释放多种细胞毒性物质,如促炎细胞因子IL-1β、肿瘤坏死因子α、干扰素γ、氧化代谢产物一氧化氮、活性氧、活性氮类等,导致有害的神经毒性作用。本研究结果显示,DAI患者外周血IL-6水平明显增高,在外伤后第3天达到峰值,而这一变化趋势在DAI后发生ARDS/ALI的患者更为显著,而IL-10水平在发生ARDS/ALI的患者中显著增高,在未发生ARDS/ALI的患者中IL-10水平变化不大,说明IL-6的增加与DAI后ARDS/ALI密切相关,可作为ARDS/ALI发生的预测因子,而IL-10则在此过程中与ARDS/ALI不相关。Logistic回归分析结果表明,IL-6水平是患者预后的危险因素,而IL-10水平则与患者预后无关。
综上所述,DAI后患者神经免疫及炎症因子均发生改变,多变量分析结果表明,CD4+/CD8+T淋巴细胞比值降低是DAI后发生ARDS/ALI的危险因素,IL-6可作为ARDS/ALI发生的预测因子。DAI后与患者预后相关的危险因素包括合并其他脑损伤、瞳孔改变、伤后昏迷时间、入院时GCS评分及并发ARDS/ALI,入院时GCS评分是判别患者病情轻重、评估预后简单有效的指标。DAI后免疫相关因子的改变对是否发生ARDS/ALI至关重要,但并非是评估预后的有效指标。
[1] MAAS AI, STOCCHETTI N, BULLOCK R. Moderate and severe traumatic brain injury in adults[J]. Lancet Neurol, 2008, 7(8):728-741.
[2] ABELSON-MITCHELL N. Epidemiology and prevention of head injuries: literature review[J]. J Clin Nurs, 2008, 17(1):46-57.
[3] ROSENFELD JV, MAAS AI, BRAGGE P, et al. Early management of severe traumatic brain injury[J]. Lancet, 2012, 380(9847):1088-1098.
[4] FEE D, CRUMBAUGH A, JACQUES T, et al. Activated/effector CD4+T cells exacerbate acute damage in the central nervous system following traumatic injury[J]. J Neuroimmunol, 2003, 136(1-2):54-66.
[5] MAIER B, SCHWERDTFEGER K, MAUTES A, et al. Differential release of interleukines 6, 8, and 10 in cerebrospinal fluid and plasma after traumatic brain injury[J]. Shock, 2001, 15(6):421-426.[6] LEVI L, GUILBURD JN, LEMBERGER A, et al. Diffuse axonal injury: analysis of 100 patients with radiological signs[J]. Neurosurgery, 1990, 27(3):429-432.
[7] SMITH DH, HICKS R, POVLISHOCK JT. Therapy development for diffuse axonal injury[J]. J Neurotrauma, 2013, 30(5):307-323.
[8] LI Y, SONG J, LIU X, et al. High expression of STIM1 in the early stages of diffuse axonal injury[J]. Brain Res, 2013, 1495:95-102.
[9] JOHNSON VE, STEWART W, SMITH DH. Axonal pathology in traumatic brain injury[J]. Exp Neurol, 2013, 246:35-43.
[10] BARKHOUDARIAN G, HOVDA DA, GIZA CC. The molecular pathophysiology of concussive brain injury[J]. Clin Sports Med, 2011, 30(1):33-48.
[11] 王洪财,陈海,王波定,等. 弥漫性轴索损伤预后影响因素的Logistic回归分析[J]. 上海交通大学学报:医学版, 2010, 30(12):1466-1469.
[12] ZIEBELL JM, MORGANTI-KOSSMANN MC. Involvement of pro- and anti-inflammatory cytokines and chemokines in the pathophysiology of traumatic brain injury[J]. Neurotherapeutics, 2010, 7(1):22-30.
[13] RINCON F, GHOSH S, DEY S, et al. Impact of acute lung injury and acute respiratory distress syndrome after traumatic brain injury in the United States[J]. Neurosurgery, 2012, 71(4):795-803.
[14] NATALE JE, AHMED F, CEMAK I, et al. Gene expression profile changes are commonly modulated across models and species after traumatic brain injury[J]. J Neurotrauma, 2003, 20(10):907-927.
[15] MORGANTI-KOSSMANN MC, RANCAN M, OTTO VI, et al. Role of cerebral inflammation after traumatic brain injury: a revisited concept[J]. Shock, 2001, 16(3):165-177.
(编辑 韩维栋)
The changes of CD4+/CD8+T lymphocyte ratio and the levels of IL-6 and IL-10 after diffuse axonal injury andLogisticregression analysis of risk factors associated with prognosis
ZHANG Ming1,2, SONG Jin-ning2, LI Dan-dong2, Zhao Yong-lin2, WU Yuan3, GUO Xiao-ye2, QU Jian-qiang1, WANG Rui-zhi1, QUAN Jun-jie1
(1. Department of Neurosurgery, the Second Affiliated Hospital, Medical School of Xi’an Jiaotong University, Xi’an 710004; 2. Department of Neurosurgery, the First Affiliated Hospital, Medical School of Xi’an Jiaotong University, Xi’an 710061; 3. Department of Critical Care Medicine, the Second Affiliated Hospital, Medical School of Xi’an Jiaotong University, Xi’an 710004, China)
Objective To investigate the changes of CD4+/CD8+T lymphocyte ratio and the levels of IL-6 and IL-10 in peripheral blood after diffuse axonal injury (DAI) so as to explore the risk factors affecting the prognosis of DAI patients and possible predictors. Methods A prospective study was performed by using DAI cases. The related clinical information of 115 patients with DAI and at least 6 months’ follow-up results were recorded. The levels of CD4+and CD8+T lymphocytes in peripheral blood taken from the patients and their ratio were detected by flow cytometer. IL-6 and IL-10 levels were detected using ELISA kits. Univariate and multivariate analyses were used to analyze the immuno-inflammatory markers and clinical data. Logistic regression analysis was used in multivariate analysis. Results The complication with other brain injury, pupil changes, post-DAI coma duration and GCS score on admission were the risk factors affecting the patients’ prognosis; other factors were not associated with the prognosis. The reduction of CD4+/CD8+T lymphocyte ratio was the risk factor for ARDS/ALI after DAI, but not associated with the prognosis. The occurrence of ARDS/ALI was an important risk factor for DAI patients’ prognosis. The increase of IL-6 was associated with the occurrence of ARDS/ALI after DAI. Its level was a predictor of ARDS/ALI occurrence in the patients and was a risk factor for prognosis. The level of IL-10 was neither associated with ARDS/ALI nor associated with the patients’ prognosis. Conclusion The reduction of CD4+/CD8+T lymphocyte ratio is the risk factor for ARDS/ALI after DAI. IL-6 can be used as a predictor of ARDS/ALI occurrence. The risk factors associated with the prognosis of patients after DAI include the complication with other brain damage, pupil changes, coma duration after injury, GCS score on admission, and concurrent ARDS/ALI.
diffuse axonal injury; CD4+T lymphocyte; CD8+T lymphocyte; interleukin-6; interleukin-10; traumatic brain injury
2014-07-14
2014-10-23
国家自然科学基金资助项目(No.30471774);教育部新世纪优秀人才支持计划资助项目(No.NCET-05-0831);陕西省自然科学基金资助项目(No.2003C1-16) Supported by the National Natural Science Foundation of China (No.30471774), the New-Century Excellent Talents Program of Ministry of Education (No.NCET-05-0831), and the Natural Science Foundation of Shaanxi Province (No.2003C1-16)
宋锦宁. E-mail: jinnings@126.com
R651.1+5
A
10.7652/jdyxb201501013
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20141119.1501.016.html(2014-11-19)
