大鼠弥漫性轴索损伤后Nogo-A在脑组织中表达的 分布与动态变化及其意义
2015-02-23宋锦宁王文博刘晓斌
赵 修,宋锦宁,郗 磊,隋 龙,王文博,刘晓斌
(1.西安交通大学医学院第一附属医院神经外科,陕西西安 710061; 2.第四军医大学附属唐都医院神经外科,陕西西安 710038)
◇专题研究◇
大鼠弥漫性轴索损伤后Nogo-A在脑组织中表达的 分布与动态变化及其意义
赵 修1,2,宋锦宁1,郗 磊1,隋 龙1,王文博1,刘晓斌1
(1.西安交通大学医学院第一附属医院神经外科,陕西西安 710061; 2.第四军医大学附属唐都医院神经外科,陕西西安 710038)
目的 研究Nogo-A在弥漫性轴索损伤(DAI)大鼠脑组织中表达的分布与动态变化,探讨其在DAI后轴突再生中的作用及意义。方法 SPF级雄性SD大鼠42只,随机分为正常对照组及DAI后2 h组、6 h组、12 h组、24 h组、72 h 组、7 d组,每组6只。应用大鼠头颅瞬间旋转损伤装置制作大鼠DAI动物模型。伤后不同时间点行病理切片HE染色及Nogo-A免疫组织化学染色。按大脑皮层、大脑白质、海马、胼胝体及脑干5个脑区,分析Nogo-A的表达变化规律。结果 DAI后各观测脑区神经元及少突胶质细胞中均可见明显的Nogo-A表达,其中以神经元表达为著,Nogo-A表达变化的时间规律为:2 h即已明显升高(P<0.05),12 h达高峰,至7 d时,各脑区Nogo-A表达已有明显下降,但仍高于正常对照组(P<0.05)。结论 DAI后脑组织Nogo-A表达的分布与动态变化与DAI病理变化趋势基本一致。此种变化规律可能为伤后神经再生过程中在某种信号调节机制下的一种调适性表达变化,其可能为新生轴突延伸导向以及介导建立突触联系。
弥漫性轴索损伤;Nogo-A;中枢神经损伤;轴突再生;颅脑损伤
弥漫性轴索损伤(diffuse axonal injury, DAI)病情复杂,其病理机制目前尚不十分清楚。近年来Nogo-A-NgR系统在脑损伤中作用机制的研究越来越受到重视。既往研究认为Nogo-A作为配体,主要表达于少突胶质细胞表面,在神经发育及病理条件下,与表达于神经元表面的受体NgR结合[1-2]。进而,通过一系列复杂的细胞内信号转导过程,最终导致神经轴突生长锥溃变,起到抑制神经轴突生长延伸的生物学作用。但近年来研究发现Nogo-A在神经元内也高度表达,除抑制轴突生长外,尚有多种不同的生物学功能[3-5]。而对于Nogo-A-NgR系统如何参与DAI的病理过程却了解甚少。因此,本研究采用免疫组织化学方法检测大鼠DAI后Nogo-A表达的分布与随时间动态变化的规律,初步探讨Nogo-A在DAI发生发展中的病理生理作用。
1 材料与方法
1.1 仪器与试剂 大鼠头颅瞬间旋转损伤装置(西安交通大学医学院第一附属医院神经外科),Nogo-A Rabbit polyclonal IgG(Santa Cruz Biotechnology),UltraSensitive SP超敏试剂盒(北京中杉金桥生物技术公司)。图像采集与分析系统(德国LEICA公司Leica-Q550CW)等。
1.2 实验动物及分组 实验用SPF级SD大鼠42只,雄性,体质量256~300 g(西安交通大学医学院实验动物中心)。饲养条件:6只/笼,自由进食进水,室温维持25 ℃左右,12 h光照/黑暗循环。实验动物饲养1周后进行实验。按随机数字表法分为正常对照组及DAI后2 h组、6 h组、12 h组、24 h组、72 h组、7 d 组,每组各6只。制作模型过程中死亡或未达到病理诊断DAI标准的大鼠剔除并补做。本实验动物伦理经西安交通大学医学院生物伦理委员会批准。
1.3 DAI模型制作 采用刘晓斌等[6]的方法制作大鼠DAI模型:致伤大鼠给予腹腔注射100 g/L水合氯醛(0.2 mL/100 g)麻醉,麻醉生效后将大鼠俯卧于20 cm厚的海绵床上,其头颅经头夹、门齿孔及耳棒呈水平位固定在致伤装置上,使其与躯干成30°角俯卧于实验台面。待其清醒后于挣扎间歇期按下扳机释放弹簧,使大鼠头颅瞬间旋转90°致伤,如此重复打击8次;正常对照组仅给予麻醉。模型建成后,观察动物的临床表现并进行行为学评分,正常对照组在清醒后即进行。
1.4 动物行为学观察 在建立DAI模型后5~10 min,参照MARMAROU[7]的方法及评分标准对致伤后大鼠进行行为学评分。
1.5 标本取材及组织切片制备 各组大鼠于伤后规定时间点取材,100 g/L水合氯醛腹腔注射麻醉,40 g/L多聚甲醛经心脏灌注固定。开颅,完整剥离脑干及大脑,留取要研究的脑组织皮层、白质、海马、胼胝体及脑干,放入40 g/L多聚甲醛溶液固定48 h。行常规脱水、透明、浸蜡、包埋、切片,切片厚度均为5 μm,各组标本大脑均行冠状切,脑干行矢状切,参考包新民等[8]的定位方法,大脑切片取约前囟后4.0 mm前后层面,脑干切片取0点左右切面。每部位留取2张,分别用于HE染色和Nogo-A免疫组化染色。
1.6 HE染色 采用人工操作HE染色方法,苏木精染色5 min。常规脱蜡、染色、脱水、透明等操作后封片,置于光镜下观察病理改变。
1.7 Nogo-A兔抗大鼠多克隆抗体免疫组织化学染色 石蜡切片常规脱蜡。微波修复抗原,按免疫组化试剂盒提供的实验步骤操作,Nogo-A兔抗大鼠多克隆抗体工作液稀释比为1∶200。DAB显色,中性树脂封片。显微镜下观察、拍照并进行图像分析。
1.8 图像分析 采用Lerca DMRE图像采集与分析系统,因Nogo-A阳性染色结果分布广泛,既有神经元及少突胶质细胞,又有神经纤维髓鞘染色,因此对所染切片采取灰度分析。抗体的标记强度用平均灰度值(A值)表示。用A值进行计量数据的统计学比较分析。
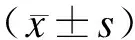
2 结 果
2.1 大鼠DAI后的行为学表现 大鼠致伤后均存活良好。均表现为不同程度的原发昏迷,表现为翻正反射较正常组稍慢或消失,刺痛反射减弱或消失,瞳孔对光反射迟钝或消失,持续约1 min~2 h。2只大鼠出现尿失禁。原发昏迷清醒后反应性、活动能力及平衡能力均有不同程度的下降,持续约15 min~2 h。正常对照组大鼠麻醉清醒后生命体征正常,活动自如,反应敏捷,逃跑迅速。行为学评分结果显示损伤组较正常对照组评分低(P<0.05,表1)。
表1 各组行为学评分结果
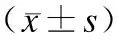
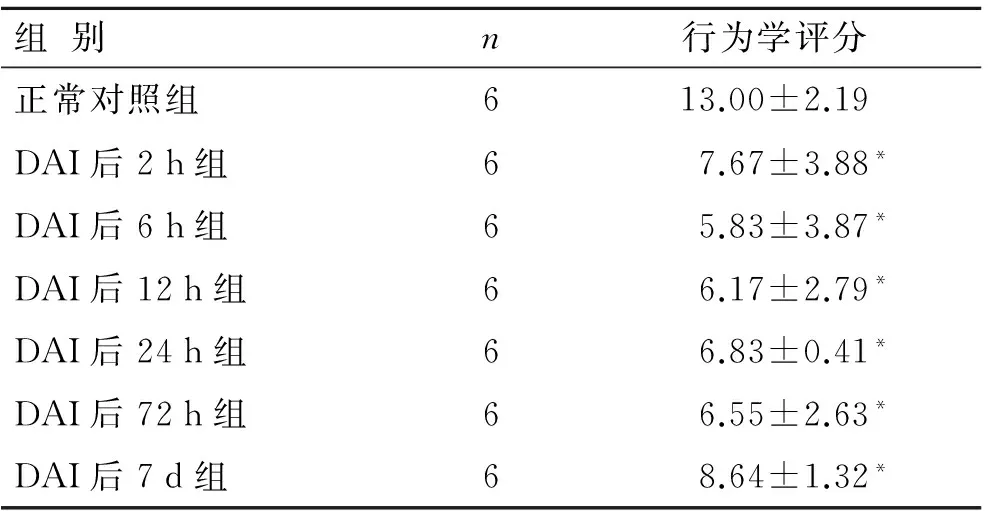
组别n行为学评分正常对照组613.00±2.19DAI后2h组67.67±3.88*DAI后6h组65.83±3.87*DAI后12h组66.17±2.79*DAI后24h组66.83±0.41*DAI后72h组66.55±2.63*DAI后7d组68.64±1.32*
与正常对照组比较,*P<0.05。
2.2 大体标本 各组实验动物均未见蛛网膜下腔出血,损伤大鼠肉眼观未见明显脑水肿,未见局部脑挫裂伤及血肿。
2.3 HE染色结果 大鼠DAI后30 min大脑皮质(额顶区,嗅皮质)、桥延(腹侧,小脑脚)等出现少量神经元细胞胞核固缩,胞质深染,脑血管无明显改变;DAI后6 h组在以上各区域出现较多神经元细胞核固缩深染、核仁不清,部分轴突肿胀并呈现波浪状,同时伴有明显的细胞周间隙。脑皮质血管内皮细胞肿胀,出现较多血管周间隙;12 h以上变化有所加重;24 h 脑皮质及桥延脑神经元细胞核固缩稍减轻,但是仍伴随着细胞周间隙,血管周间隙不明显。到第7天脑额顶区及桥延脑区域存在少量神经元细胞核固缩深染,细胞周间隙及血管周间隙均不明显,胶质细胞增生不明显。
2.4 脑组织Nogo-A免疫组化染色结果 Nogo-A DAB显色后,阳性染色表现为黄褐色。在正常对照组大鼠脑组织大脑皮层、胼胝体、深部白质、海马及脑干处均可见基础水平表达,染色均较淡,呈现稍高于背景的浅棕色。细胞定位主要表达于神经元的胞质及突起,亦可见少突胶质细胞胞质及神经纤维染色,不能区分髓鞘和轴突,亦可偶见胞核着色。DAI后2 h 各脑区染色强度即已明显高于正常对照组,呈现深棕褐色。DAI后12 h组脑组织中Nogo-A的阳性表达较正常对照组明显增多。神经元、少突胶质细胞及神经纤维均呈现深棕褐色的强阳性着色,尤以神经元胞质着色为著。尤其以白质、海马及脑干为著。阳性部位位于胞膜、胞质,亦可见胞核着色,神经纤维着色光镜下不能分辨轴突和髓鞘(图1)。
2.5 脑组织Nogo-A免疫组化染色结果灰度分析 DAI后各组所有观察区域Nogo-A表达与正常对照组比较均有不同程度升高,DAI后2 h即可观察到表达明显升高(P<0.05)。其中胼胝体、海马、白质及脑干升高更为明显,且程度相近。相比较而言,2 h时皮层升高程度低于其他区域,但与正常对照组比较P值仍小于0.05。6 h时Nogo-A表达继续升高至接近峰值,至12 h达到高峰,之后胼胝体、海马、白质及脑干持续至72 h,表达仅略有下降。其中海马、白质及脑干区域6、12、24 h及72 h Nogo-A表达差异无统计学意义,胼胝体区6 h、12 h及24 h Nogo-A表达差异无统计学意义,72 h Nogo-A表达仅与12 h差异有统计学意义,而与6 h及24 h差异无统计学意义。皮层Nogo-A表达至72 h已有显著下降,6 h、12 h及24 h Nogo-A表达差异无统计学意义,72 h Nogo-A表达与6 h、12 h及24 h差异均有统计学意义。至 7 d 时,各时间点Nogo-A表达已有明显下降,但仍高于正常对照组。其中,胼胝体、海马及白质略低于DAI后2 h组(P<0.05),皮层略高于DAI后2 h组(P<0.05),而脑干DAI后7 d组与DAI后2 h组Nogo-A表达差异无统计学意义(图1、表2)。
表2 各组脑组织Nogo-A免疫组化染色结果灰度值检测结果
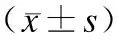
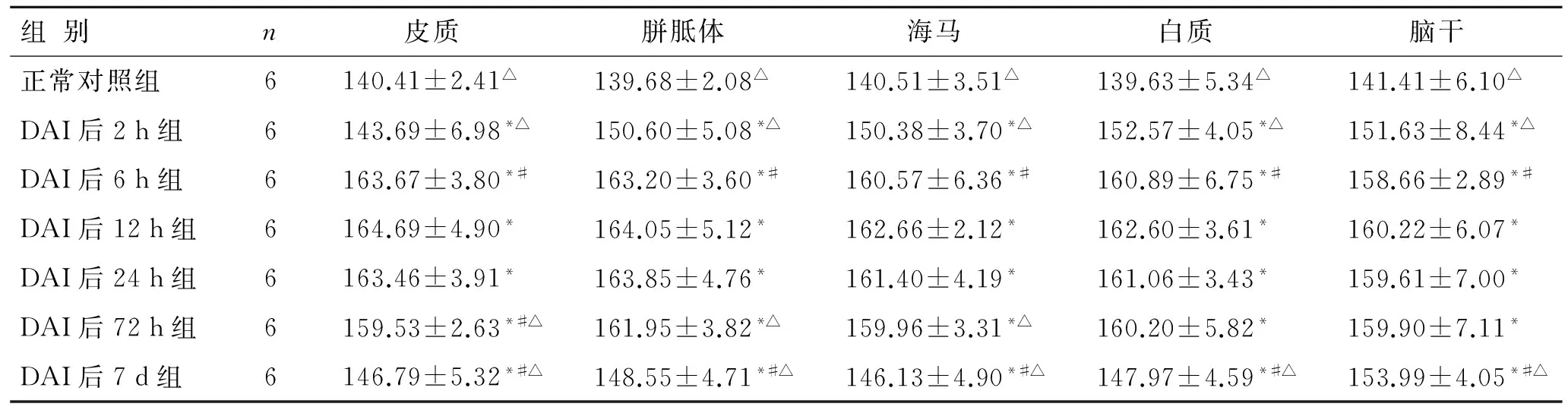
组别n皮质胼胝体海马白质脑干正常对照组6140.41±2.41△139.68±2.08△140.51±3.51△139.63±5.34△141.41±6.10△DAI后2h组6143.69±6.98*△150.60±5.08*△150.38±3.70*△152.57±4.05*△151.63±8.44*△DAI后6h组6163.67±3.80*#163.20±3.60*#160.57±6.36*#160.89±6.75*#158.66±2.89*#DAI后12h组6164.69±4.90*164.05±5.12*162.66±2.12*162.60±3.61*160.22±6.07*DAI后24h组6163.46±3.91*163.85±4.76*161.40±4.19*161.06±3.43*159.61±7.00*DAI后72h组6159.53±2.63*#△161.95±3.82*△159.96±3.31*△160.20±5.82*159.90±7.11*DAI后7d组6146.79±5.32*#△148.55±4.71*#△146.13±4.90*#△147.97±4.59*#△153.99±4.05*#△
与正常对照组比较,*P<0.05;数据与表中上方数据,即前一时间组别数据比较,#P<0.05;与12 h组比较,△P<0.05。
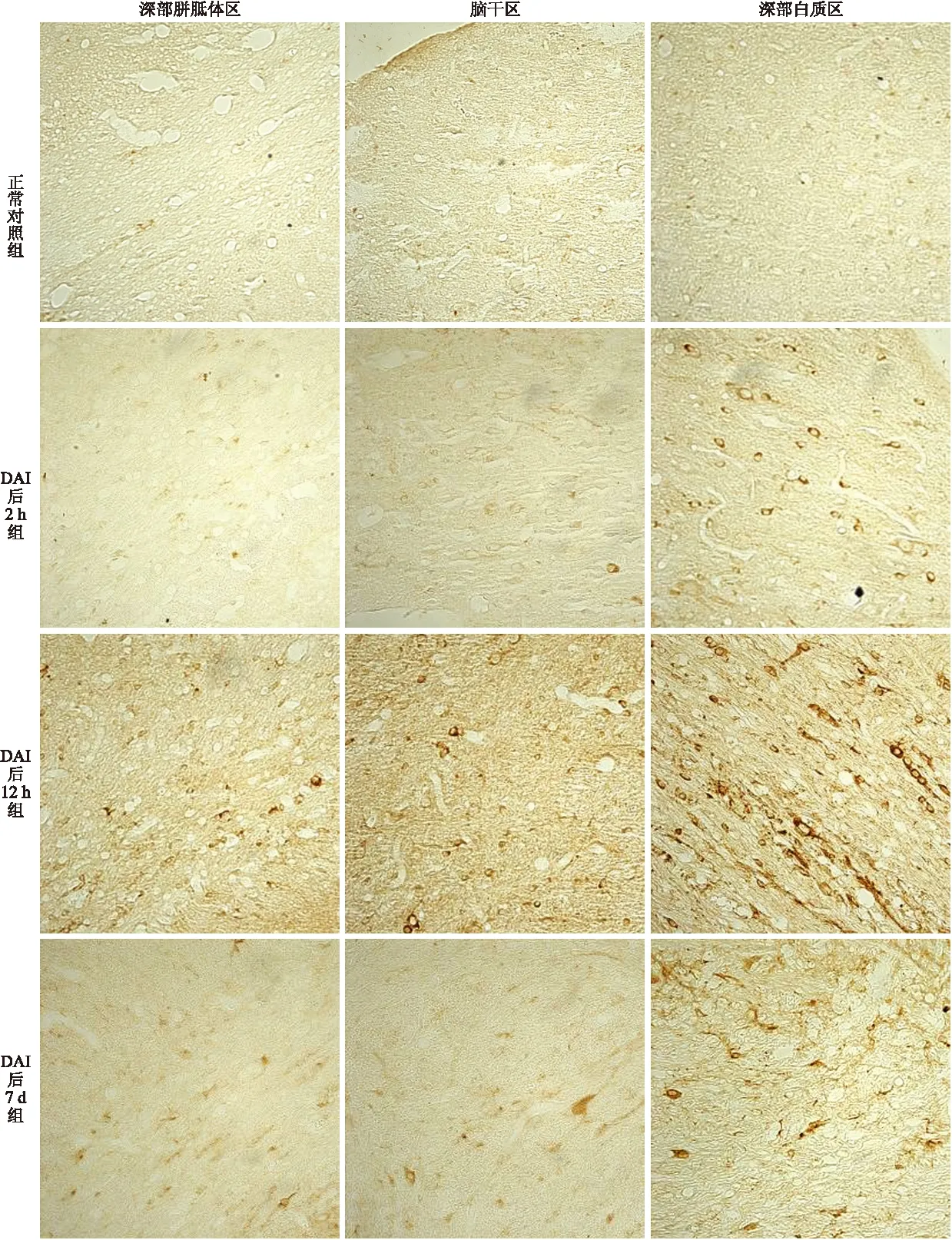
图1 不同脑区各时段Nogo-A免疫组化染色切片
Fig.1 Immunohistochemical staining of Nogo-A in different brain regions at each time point (×400)
3 讨 论
既往研究认为,Nogo-A的生物学作用在于防止轴突过度芽生以维持正常的中枢神经网络[1-2]。然而近年研究发现,在神经发育阶段,Nogo-A-NgR系统尚存在帮助建立稳定的髓鞘通道,引导轴突向着正确的方向延伸以及介导神经元之间建立联系,形成突触等作用[3-5]。WANG等[4]检测出发育期小鼠前脑Nogo-A呈网络状大量表达于神经元,而成熟小鼠少突胶质细胞表面Nogo-A染色明显,将发育阶段的脑与成熟个体进行比较,则发现发育阶段的脑几乎不表达NgR,此即Nogo-A与NgR在发育过程中表现出的独特的补充表达和守恒模式[9],这表明早期Nogo-A作用可能与网状蛋白功能相关,而并不与NgR作用。
DAI后必然伴随着神经元及轴突的再生修复过程,本研究观测到Nogo-A在伤后明显升高。Nogo-A是一类多功能信号分子,可能随其表达部位的不同而发挥不同的生物学功能[10]。本实验观察到DAI后Nogo-A表达主要位于神经元及轴突,而非少突胶质细胞及其髓鞘。HUBER等[10]认为Nogo-A作为神经元表面的信号分子时,具有排斥、吸引其他神经元、轴突和非神经细胞的功能,很可能在神经元-神经元、神经元-胶质细胞交互作用中起到重要作用。
本实验结果表明,各脑区Nogo-A表达与DAI病理损伤的时间演变基本同步。这可能是DAI后机体将某种损伤信号传递至细胞胞体,进而调控Nogo-A的表达上调。在DAI后,神经元中大量表达的Nogo-A的作用可能与发育阶段相类似,可能与网状蛋白功能相关,在于介导神经元间直接相互作用及建立突触连接,引导轴突向着正确的方向延伸。
从本实验结果显示各脑区Nogo-A表达强度至迟在伤后72 h即已开始下降,至7 d时达到2 h水平。目前,关于Nogo-A表达调控的基础研究尚十分模糊,且在脊髓损伤、脑缺血缺氧性损伤及脑挫伤等不同类型的脑损伤中Nogo-A的表达曲线形态各异[11-13]。如前所述,NgR亦可能参与了Nogo-A的表达调控,而在脊髓损伤以后,Nogo-A的表达上调至中等程度,而NgR的表达水平仍然维持不变[12]。沈剑虹等[14]研究大鼠DAI后脑内NgR表达时发现,伤后24 h的NgR表达轻度下降;第72 h时轴索的NgR表达则显著下降(P<0.05);到伤后第7天,轴索的NgR表达水平基本恢复。DAI后NgR表达出现迅速下降的可能机制为Nogo-A与NgR补充表达和守恒模式的再现有关。在DAI急性期,损伤因素可能通过某种机制使少突胶质细胞Nogo-A伴随神经元Nogo-A共同表达升高。随之机体启动神经再生修复机制,包括神经元大量表达Nogo-A而NgR表达下调等。短暂下调后继而升高水平的NgR表达随即抑制了神经组织(尤其是少突胶质细胞)表达Nogo-A,并使之维持在一个合适的水平,以利于修复。
本组皮层Nogo-A的表达表现为升高相对延迟,平台期与其他区域基本相近,下降相对提前。分析其原因,可能由于皮层系神经元分布密集的区域,在DAI中,该区域并非损伤敏感区域,故不如其他神经纤维及少突胶质细胞分布密集区域反应迅速。但一方面,皮髓交界区亦是DAI易损区之一,另一方面,远端神经纤维的损伤必然会在神经元胞体引发相应病理生理变化,故皮层Nogo-A表达随后也于6 h迅速达到平台。之后72 h时即已开始下降,明显早于其他区域,这可能是损伤早期神经元合成的大量Nogo-A 迅速顺轴浆流转运至远端所致。而在单纯性DAI中,皮层相对完好,故并不出现早期Nogo-A的表达下降,反而在远端轴突损伤的病理生理改变的刺激下,神经元大量合成Nogo-A并向远端轴突输送,导致皮层Nogo-A表达先升高后迅速下降。
尽管DAI后神经元Nogo-A表达明显上调,然而,成熟个体神经元及轴突大量表达的NgR仍可与少突胶质细胞髓鞘膜表达的Nogo-A及其他髓鞘相关抑制因子结合。另一方面,在少突胶质细胞中,仅少部分Nogo-A被转运到细胞表面,其余大部分则是和内质网、高尔基体相关联[15]。结合本组实验结果,我们认为:DAI损伤后,表达于神经元及少突胶质细胞的Nogo-A-NgR系统在某种信号调节机制下出现调适性表达变化,其结果可能为新生轴突延伸导向以及介导建立突触联系的作用。其具体调适机制尚有待进一步实验研究揭示。
[1] YUSTE R, BONHOEFFER T. Morphological changes in dendrite spines associated with long-time synaptic plasticity[J]. Annu Rev Neurosci, 2001, 24:1071-1089.
[2] RAINETEAU O, FOUAD K, NOTH P, et al. Functional switch between motor tracts in the presence of the mAb IN-1 in the adult rat[J]. Proc Natl Acad Sci USA, 2002, 98(12):6929-6934.
[3] JOSEPHSON A, TRIFUNOVSKI A, WIDMER HR, et al. Nogo-receptor gene activity: cellular localization and developmental regulation of mRNA in mice and humans[J]. J Comp Neurol, 2002, 453(3):292-304.
[4] WANG XX, CHUN SJ, TRELOAR H, et al. Location of Nogo-A and Nogo-66 receptor proteins at sites of axon-myelin and synaptic contact[J]. J Neurosci, 2002, 22:5505-5515.
[5] O’NEILL P, WHALLEY K, FERRETTI P. Nogo and Nogo-66 receptor in human and chick: implications for development and regeneration[J]. Dev Dyn, 2004, 231(1):109-121.
[6] 刘晓斌,宋锦宁,陈景宇,等. 脑弥漫性轴索损伤实验装置的研制及动物模型的建立[J]. 西安交通大学学报:医学版, 2008,29(5):595-598.
[7] MARMAROU A, FODA MA. A new model of diffuse brain injury in rats. Part I: Pathophysiology and Biomechanics[J]. J Neurosurg, 1994, 80(2):291-300.[8] 包新民,舒斯云. 大鼠脑立体定位图谱[M]. 北京:人民卫生出版社,1992,12:47.
[9] PRINJHA R, MOORE SE, VINSON M, et al. Inhibitor of neurite outgrowth in humans[J]. Nature, 2000, 403(6768):383-384.
[10] HUBER AB, WEINMANN O, BRAMLE C, et al. Patterns of Nogo—mRNA and protein expression in the developing and adult rat and after CNS lesions[J]. J Neurosci, 2002, 22:3553-3567.
[11] PIGNOT V, HEIN AE, BARSKE C, et al. Characterization of two novel proteins, NgRH1 and NgRH2, structurally and biochemically homologous to the Nogo-66 receptor[J]. J Neurochem, 2003, 85(3):717-728.
[12] WEISS J, TAKIZAWA B, MCGEE A, et al. Neonatal hypoxia suppresses oligodendrocyte Nogo-A and increases axonal sprouting in a rodent model for human prematurity[J]. Exp Neurol, 2004, 189:141-149.
[13] 闫凤霞,李永刚,王守彪. 局灶性脑缺血再灌注大鼠Nogo-A mRNA的表达[J]. 神经解剖学杂志, 2004, 20(4):394-398.
[14] 沈剑虹, 文立, 马进. 大鼠弥漫性轴索损伤对脑内NgR表达的影响[J]. 交通医学, 2007, 21(4):347-349.
[15] VAN DER HAAR ME, SIMONEN M, HUBER AB, et al. Localization and membrane topology of the myelin protein Nogo-A[J]. Soc Neurosci Abstr, 2001, 10(27):257-258.
(编辑 国 荣)
Expression changes of Nogo-A and its significance in rat brain with diffusive axonal injury
ZHAO Xiu1,2, SONG Jin-ning1, XI Lei1, SUI Long1, WANG Wen-bo1, LIU Xiao-bin1
(1. Department of Neurosurgery, the First Affiliated Hospital, Medical School of Xi’an Jiaotong University, Xi’an 710061; 2. Department of Neurosurgery, Tangdu Hospital, Fourth Military Medical University, Xi’an 710038, China)
Objective To investigate the expression changes of Nogo-A in rat brain with diffuse axonal injury (DAI) and discuss the significance and mechanisms of Nogo-A in axon regeneration after DAI. Methods We divided 42 male SD rats of SPF grade into 7 groups randomly: the control group, DAI 2 h group, DAI 6 h group, DAI 12 h group, DAI 24 h group, DAI 72 h group and DAI 7 d group, with 6 rats in each. The DAI animal models were established using the rat head coronal plane moment rotation acceleration vulnerant equipment. Then HE staining and immunohistochemical staining were used respectively at several time intervals after DAI. Image collection and gradation analysis were carried out in 5 encephalic regions to analyze the changes of Nogo-A expression: the cortex, white matter, hippocampus, corpus callosum and brain stem. Results Nogo-A was expressed significantly in the neurons in all the five encephalic regions and in a small number of oligodendroglia cells, especially in the former. The expression of Nogo-A protein increased obviously 2 hours after DAI (P<0.05), and reached the highest level at 12 h, and had a gradual recovery to the 2-h level by day 7. Conclusion After DAI, Nogo-A expression increased obviously and had dynamic changes, the tendency of which is the same as the pathological change of DAI. After DAI the high expression of Nogo-A in the neurons may be related to the development stage. Nogo-A may play an important role in the process of neural repair.
diffusive axonal injury (DAI); Nogo-A; central nerve injury; axon regeneration; traumatic brain injury
2014-04-21
2014-06-30
国家自然科学基金资助项目(No.30471774);教育部新世纪优秀人才支持计划资助项目(No.NCET-05-0831);陕西省自然科学基金资助项目(No.2003C1-16) Supported by the National Natural Science Foundation of China (No.30471774), the New-Century Excellent Talents Program of Ministry of Education (No.NCET-05-0831), and the Natural Science Foundation of Shaanxi Province (No.2003C1-16)
宋锦宁. E-mail: jinnings@126.com
R651.1+5
A
10.7652/jdyxb201501014
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20141119.0850.004.html(2014-11-19)
