人胰腺癌吉西他滨耐药细胞株的建立及其耐药机制初步探讨
2015-02-22聂佳佳,熊光苏,吴叔明
人胰腺癌吉西他滨耐药细胞株的建立及其耐药机制初步探讨
聂佳佳*熊光苏吴叔明#
上海交通大学医学院附属仁济医院消化内科上海市消化疾病研究所(200001)

*Email: 351727335@qq.com
背景:吉西他滨是胰腺癌的一线化疗药物,但由于存在原发性和获得性耐药,其改善胰腺癌患者预后的作用并不明显。因此,探讨吉西他滨获得性耐药机制具有重要临床意义。目的:建立人胰腺癌吉西他滨耐药细胞株,初步探讨胰腺癌对吉西他滨的耐药机制。方法:在体外以0.5 μmol/L吉西他滨持续刺激人胰腺癌细胞株SW1990,获得耐药细胞株SW1990-0.5。以CCK-8实验检测SW1990-0.5细胞株的耐药指数,细胞群体倍增实验和划痕实验分别检测亲本和耐药细胞株在体外的生长和侵袭能力,流式细胞术检测细胞周期和细胞凋亡,real-time PCR检测多药耐药相关基因MDR-1、MRP-1、BRCP和吉西他滨代谢相关酶基因dCK、RRM1、RRM2表达。结果:SW1990-0.5细胞株的耐药指数为9.32。与亲本细胞株相比,耐药细胞株体外增殖能力减弱,体外侵袭能力无明显变化;经吉西他滨作用后,耐药细胞株细胞周期无明显变化,但细胞凋亡率显著降低,MRP-1、BRCP、dCK mRNA表达降低,MDR-1、RRM1、RRM2 mRNA表达无明显变化。结论:成功建立了稳定的人胰腺癌吉西他滨耐药细胞株SW1990-0.5;胰腺癌对吉西他滨获得性耐药可能与拮抗细胞凋亡和dCK表达下调有关。
关键词胰腺肿瘤;吉西他滨;抗药性,肿瘤;细胞凋亡
胰腺癌是最难治疗且预后最差的恶性肿瘤之一,5年生存率不到4%[1],其主要危险因素包括饮酒、吸烟、肥胖、糖尿病等[2]。由于早期症状不是很明显,胰腺癌发现时多已为中晚期,大部分患者已不能接受外科手术切除治疗,因此对于中晚期胰腺癌患者,化疗为其主要治疗手段。吉西他滨(gemci-tabine,2’-2’二氟脱氧胞嘧啶核苷)是1997年由美国食品药品管理局(FDA)批准用于治疗胰腺癌的一线化疗药物,然而由于胰腺癌对吉西他滨的原发性以及获得性耐药明显,使用吉西他滨治疗的胰腺癌患者生存率并无明显改善[3-5]。本研究旨在建立人胰腺癌吉西他滨耐药细胞株,通过了解其体外生长特性、生物学行为以及多药耐药相关基因和吉西他滨代谢相关酶基因表达,初步探讨胰腺癌对吉西他滨的耐药机制。
材料与方法
一、细胞株和主要试剂
人胰腺癌细胞株SW1990由上海市消化疾病研究所保存。胎牛血清(杭州四季青生物工程材料有限 公司),DMEM培养基、0.25%胰酶(Gibco®, Thermo Fisher Scientific Inc.),注射用盐酸吉西他滨(美国礼来制药),CCK-8试剂盒(日本同仁化学研究所),Annexin V-FITC/PI 细胞凋亡双染试剂盒(BD Biosciences),总RNA 提取试剂RNAiso Plus、PrimeScriptTMRT试剂盒(Perfect Real Time)、SYBR®Premix Ex Taq(Perfect Real Time)(TAKARA BioInc.)。
二、实验方法
1. 细胞培养和人胰腺癌吉西他滨耐药细胞株的建立:将SW1990细胞置于含10%胎牛血清的DMEM培养基中,于37 ℃、5% CO2孵育箱中培养,细胞密度达到80%~90%时予以传代,2~3 d传代一次。取对数生长期细胞,PBS洗2次,0.25%胰酶消化,调整密度为5×104/mL,以1 mL/孔接种于6孔板,24 h后细胞密度达到30%~40%时,加入不同浓度(0、0.1、0.3、0.5、0.8、1.0 μmol/L)吉西他滨,其后每2~3 d加药1次。1周后,含0.5 μmol/L吉西他滨的培养基中大部分细胞死亡,胰酶消化小部分存活细胞并移入培养瓶中培养,持续加药2个月,所得细胞命名为SW1990-0.5,停药1周后进行后续实验。后续实验步骤均重复3次,实验结果取均值。
2. CCK-8实验:取对数生长期SW1990和SW1990-0.5细胞,胰酶消化,制成单细胞悬液,调整密度为3×104/mL,以100 μL/孔接种于96孔板,24 h 后更换为含不同浓度(0、0.1、1.0、10、100、1 000 μmol/L)吉西他滨的完全培养基,每组设6个复孔,每2 d换液1次,96 h后更换为含10% CCK-8试剂的培养基100 μL,培养1.5 h,于酶标仪450 nm处读取吸光度(A)值。细胞存活率=(加药组A值-空白对照A值)/(对照组A值-空白组对照A值)×100%,分别绘制2株细胞的剂量-存活率曲线,计算50%抑制浓度(IC50)。SW1990-0.5细胞耐药指数RI=IC50(SW1990-0.5)/IC50(SW1990)。
3. 细胞群体倍增实验:取对数生长期SW1990和SW1990-0.5细胞,胰酶消化,制成单细胞悬液,调整密度为1×104/mL,以1 mL/孔接种于24孔板,置于37 ℃、5% CO2孵育箱中培养。连续9 d隔天取3个复孔计数活细胞并计算均值,以培养时间为横轴、活细胞数为纵轴绘制细胞生长曲线,计算细胞群体培增时间[T=t×ln2/(lnNt-lnN0)×24,t:培养时间(h),Nt:培养最后1 d活细胞数,N0:培养第1 d活细胞数]。
4. 划痕实验:用记号笔在6孔板背后以直尺均匀画横线,每一孔画5条线,横穿过孔,横线间距 0.5~1 cm。取对数生长期SW1990和SW1990-0.5 细胞,胰 酶消化,制成单细胞悬液,调整密度为5×105/mL,以1 mL/孔接种于6孔板,24 h后细胞长满100%。用黄枪头以直尺尽量垂直于背后横线划痕,枪头须垂直,不能倾斜。PBS洗3次,去除划下的细胞,加入含吉西他滨(20 μmol/L)的无血清培养基,0 h取样拍照,置于孵育箱中培养,24 h后取样拍照,计算0 h划痕宽度与24 h划痕宽度的差值。
5. 流式细胞术检测细胞周期:取对数生长期SW1990和SW1990-0.5细胞各1瓶,胰酶消化,铺于培养皿,每组3个复孔。24 h后细胞密度达到40%~50%时,更换为含吉西他滨(20 μmol/L)的完全培养基,48 h后收集细胞,1 500×g4 ℃离心5 min,PBS洗1次,1 500×g4 ℃离心5 min,置于75%冰乙醇中-20 ℃固定24 h,2 000×g4 ℃离心5 min,PBS洗1次,1 500×g4 ℃离心5 min,弃上清液,加入RNA酶(10 mg/mL)10 μL,37 ℃孵育30 min,加入PI(250 μg/mL),室温避光孵育10~15 min,终体积300 μL,上流式细胞仪检测。
6. 流式细胞术检测细胞凋亡:取对数生长期SW1990和SW1990-0.5细胞各1瓶,胰酶消化,铺于培养皿,设置加药组和不加药对照组,每组3个复孔。24 h后细胞密度达到40%~50%时,加药组更换为含吉西他滨(20 μmol/L)的完全培养基,对照组换液,72 h后收集细胞,按试剂盒说明书操作,简要步骤为:2 000×g4 ℃离心 5 min,结合缓冲液洗1次,2 000×g4 ℃离心 5 min,加入Annexin V-FITC 10 μL,室温避光孵育20 min,加入PI 5 μL,终体积300 μL,上流式细胞仪检测。
7. Real-time PCR:细胞培养和处理同细胞周期检测。提取细胞总RNA,逆转录合成cDNA,以之为模板行PCR扩增,检测多药耐药相关基因MDR-1、MRP-1、BRCP mRNA和吉西他滨代谢相关酶基因脱氧胞苷激酶(dCK)、核苷酸还原酶(RR)M1、RRM2 mRNA表达。PCR引物由生工生物工程(上海)股份有限公司合成,引物序列和扩增片段长度见表1。PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环。以2-ΔΔCt法计算目的基因mRNA相对表达量,ΔΔCt=实验组(Ct目的基因-Ct内参基因)-对照组(Ct目的基因-Ct内参基因),实验组和对照组分别为SW1990-0.5和SW1990细胞。
三、统计学分析
结果
一、SW1990-0.5细胞耐药指数
SW1990和SW1990-0.5细胞的剂量-存活率曲线见图1,吉西他滨对亲本和耐药细胞株的IC50分别为 0.94 μmol/L 和8.76 μmol/L,SW1990-0.5细胞的耐药指数为9.32。
二、细胞群体倍增实验
SW1990和SW1990-0.5细胞的生长曲线见图2,两株细胞群体倍增时间分别为(40.31±0.54) h和(45.94±0.51) h (t=-13.26,P<0.05),表明与亲本细胞株相比,耐药细胞株体外增殖能力明显减弱。
三、划痕实验
SW1990和SW1990-0.5细胞0 h与24 h时的划痕宽度差值分别为(387.62±30.79) μm和(451.77±33.96) μm,耐药细胞株虽大于亲本细胞株,但差异无统计学意义(t=2.43,P>0.05),表明与亲本细胞株相比,耐药细胞株的体外侵袭能力无明显变化。
四、细胞周期分布
经吉西他滨(20 μmol/L)作用48 h,SW1990和SW1990-0.5细胞的G0/G1期比率分别为(66.42±0.05)%和(61.27±0.02)%(t=1.76,P=0.15),S期比率分别为(18.26±0.10)%和(19.65±0.07)%(t=-0.20,P=0.85),G2/M期比率分别为(15.33±0.05)%和(19.09±0.05)%(t=-0.90,P=0.42),表明与亲本细胞株相比,耐药细胞株经吉西他滨作用后细胞周期无明显变化。
五、细胞凋亡情况
经吉西他滨(20 μmol/L)作用72 h,SW1990和SW1990-0.5细胞的凋亡率分别(20.50±3.66)%和(12.30±1.50)%(t=0.02,P<0.05),表明与亲本细胞株相比,耐药细胞株可拮抗由吉西他滨诱导的细胞凋亡(图3)。

表1 Real-time PCR引物序列和扩增片段长度
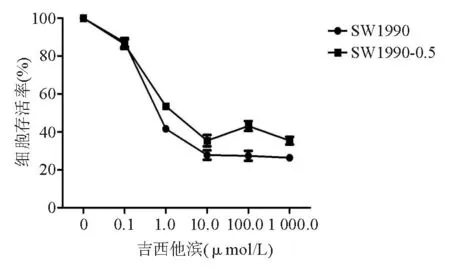
图1 SW1990和SW1990-0.5细胞剂量-存活率曲线

图2 SW1990和SW1990-0.5细胞生长曲线

图3吉西他滨处理72 h后SW1990和SW1990-0.5细胞凋亡流式细胞图
六、多药耐药相关基因和吉西他滨代谢相关酶基因表达
经吉西他滨作用48 h,相对于SW1990细胞,SW1990-0.5细胞多药耐药相关基因MDR-1、MRP-1、BRCP mRNA相对表达量分别为0.72±0.30(P>0.05)、0.60±0.19(P<0.05)和0.37±0.01(P<0.05),吉西他滨代谢相关酶基因dCK、RRM1、RRM2 mRNA相对表达量分别为0.50±0.07(P<0.05)、1.04±0.12(P>0.05)和1.30±0.66(P>0.05)。与亲本细胞株相比,耐药细胞株经吉西他滨处理后,MRP-1、BRCP、dCK mRNA表达显著降低,MDR-1、RRM1、RRM2 mRNA表达无明显变化。
讨论
胰腺癌是一种恶性程度较高的消化系统肿瘤,化疗为其主要治疗手段。吉西他滨是胰腺癌的主要化疗药物,但由于存在原发性和获得性耐药,其改善胰腺癌患者预后的作用并不明显。因此,探讨吉西他滨获得性耐药机制具有重要临床意义。人胰腺癌细胞株SW1990起源于胰腺癌转移至脾脏的细胞,常用于建立胰腺癌耐药细胞株[6-8]。建立胰腺癌耐药细胞株的方法主要包括间歇浓度递增法和持续诱导法,本研究采用持续诱导法建立人胰腺癌吉西他滨耐药细胞株,对上述问题进行了初步探讨。
国内外研究表明吉西他滨耐药可能与多药耐药相关基因表达改变有关,如MDR-1表达上调,与吉西他滨代谢酶dCK表达下调、RR表达上调等亦存在一定关联[9-13],但胰腺癌对吉西他滨的主要耐药机制仍不清楚。本研究筛选出的针对0.5 μmol/L浓度吉西他滨的人胰腺癌耐药细胞株SW1990-0.5,耐药指数并不是很高(9.32),体外侵袭能力与亲本细胞株无明显差异,仅体外增殖能力明显减弱。与亲本细胞株相比,耐药细胞株对吉西他滨诱导的细胞凋亡的拮抗能力增强,MRP-1、BRCP、dCK mRNA表达下调,提示胰腺癌对吉西他滨获得性耐药可能与拮抗细胞凋亡和dCK表达下调有关。迄今为止,众多研究均未明确吉西他滨耐药与MRP-1、BRCP表达间的关系,MDR-1、RR表达在本研究建立的耐药细胞株中则未见明显变化,与既往研究结果不符,因此胰腺癌对吉西他滨的获得性耐药机制尚需深入探讨。本研究建立的稳定人胰腺癌吉西他滨耐药细胞株,为进一步的耐药机制研究提供了有利的工具。
参考文献
1 Kleeff J, Michalski C, Friess H, et al. Pancreatic cancer: from bench to 5-year survival[J]. Pancreas, 2006, 33 (2): 111-118.
2 Edderkaoui M, Eibl G. Risk factors for pancreatic cancer: underlying mechanisms and potential targets[J]. Front Physiol, 2014, 5: 490.
3 Oettle H, Neuhaus P. Adjuvant therapy in pancreatic cancer: a critical appraisal[J]. Drugs, 2007, 67 (16): 2293-2310.
4 Long J, Zhang Y, Yu X, et al. Overcoming drug resistance in pancreatic cancer[J]. Expert Opin Ther Targets, 2011, 15 (7): 817-828.
5 El Maalouf G, Le Tourneau C, Batty GN, et al. Markers involved in resistance to cytotoxics and targeted therapeutics in pancreatic cancer[J]. Cancer Treat Rev, 2009, 35 (2): 167-174.
6 牛备战,陈革,李丽君,等. 吉西他滨诱导胰腺癌细胞株SW1990的耐药作用与硫氧还蛋白还原酶活性的改变[J]. 中国医学科学院学报, 2005, 27 (5): 606-610.
7 安勇,姚捷,卫积书,等. 吉西他滨耐药人胰腺癌细胞株的建立及其与肿瘤干细胞的相关性研究[J]. 中华外科杂志, 2010, 48 (13): 999-1003.
8 郭双双,姚俊. ERK通路参与调控胰腺癌细胞吉西他滨化疗抵抗[J]. 中国医学创新, 2010, 7 (2): 74-76.
9 Nakano Y, Tanno S, Koizumi K, et al. Gemcitabine chemoresistance and molecular markers associated with gemcitabine transport and metabolism in human pancreatic cancer cells[J]. Br J Cancer, 2007, 96 (3): 457-463.
10Bergman AM, Pinedo HM, Peters GJ. Determinants of resistance to 2’,2’-difluorodeoxycytidine (gemcitabine)[J]. Drug Resist Update, 2002, 5 (1): 19-33.
11要洁,冯奉仪,林晨,等. 吉西他滨耐药胰腺癌细胞系的耐药机制[J]. 中华肿瘤杂志, 2005, 27 (12): 721-726.
12Ohhashi S, Ohuchida K, Mizumoto K, et al. Down-regulation of deoxycytidine kinase enhances acquired resistance to gemcitabine in pancreatic cancer[J]. Anticancer Res, 2008, 28 (4B): 2205-2212.
13Jordheim LP, Dumontet C. Review of recent studies on resistance to cytotoxic deoxynucleoside analogues[J]. Biochim Biophys Acta, 2007, 76 (2): 138-159.
(2015-02-10收稿;2015-02-14修回)
·简讯·
书讯:《实用临床肝病学》(第2版)发行征订
由池肇春教授主编的《实用临床肝病学》(第2版)现已由人民军医出版社出版发行。该书为第2版,由全国20多个医疗单位、医学院校和肝病研究院(中心)的知名专家教授集体执笔撰写,在第1版的基础上作了大量的去旧添新,内容新颖实用,文字流畅,在保持第1版一流水平的基础上呈现出新的面貌和活力。全书分上、下两卷,共80万字,上卷为总论,共17章,介绍了肝病诊治基础、现状和进展,下卷为各论,共16章,分别介绍了各种肝病的病因、发病机制、鉴别诊断、治疗和预防,可供消化科、感染科、肿瘤科、影像科等相关学科医师学习参考。欲了解当代肝病的诊治、进展和现状,请阅读本书。每册定价19元,全国新华书店发行,也可直接从人民军医出版社发行部邮购,联系电话:13810020390,网址http://www.pmmp.com.cn/bookshop/where_buy.htm
Establishment of Gemcitabine-resistant Human Pancreatic Cancer Cell Subclone and Preliminary Exploration of the Resistance MechanismNIEJiajia,XIONGGuangsu,WUShuming.DepartmentofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity;ShanghaiInstituteofDigestiveDisease,Shanghai(200001)
Correspondence to: WU Shuming, Email: wushuming@vip.sina.com
Background: Gemcitabine is the first-line drug for chemotherapy of pancreatic cancer. However, owing to the inherent and acquired resistance, gemcitabine does not change obviously the prognosis of patients with pancreatic cancer. Exploration of the mechanism of acquired resistance to gemcitabine is of great clinical importance. Aims: To establish a gemcitabine-resistant human pancreatic cancer cell subclone and to explore preliminarily the resistance mechanism. Methods: Human pancreatic cancer cell line SW1990 was stimulated continuously with 0.5 μmol/L gemcitabineinvitroto establish the gemcitabine-resistant subclone SW1990-0.5. The resistance index of SW1990-0.5 cells was counted by CCK-8 assay. Proliferation and invasion of SW1990 and SW1990-0.5 cells were detected by cell doubling time assay and scratch wound healing assayinvitro; cell cycle and cell apoptosis were detected by flow cytometry; expressions of multidrug-resistance related genes (MDR-1, MRP-1, and BRCP) and gemcitabine metabolic enzyme related genes (dCK, RRM1, and RRM2) were determined by real-time PCR. Results: The resistance index of SW1990-0.5 cells was 9.32. Compared with the parental SW1990 cells, the proliferation capacity but not the invasion capacity of SW1990-0.5 cellsinvitrowas reduced. When treated with gemcitabine, the cell cycle of SW1990-0.5 cells was similar to that of parental cells, whereas the cell apoptosis was significantly inhibited; expressions of MRP-1, BRCP and dCK mRNA were down-regulated, while expressions of MDR-1, RRM1 and RRM2 mRNA did not change. Conclusions: A stable gemcitabine-resistant human pancreatic cancer cell subclone SW1990-0.5 was successfully established. Inhibition of cell apoptosis and down-regulation of dCK expression might contribute to the acquired resistance to gemcitabine of pancreatic cancer.
Key wordsPancreatic Neoplasms;Gemcitabine;Drug Resistance, Neoplasm;Apoptosis
通信作者#本文,Email: wushuming@vip.sina.com
DOI:10.3969/j.issn.1008-7125.2015.06.004
