Faecalibacterium prausnitzii治疗大鼠TNBS结肠炎的机制研究*
2015-02-22汤爱荣,曹萍,张涛等
Faecalibacteriumprausnitzii治疗大鼠TNBS结肠炎的机制研究*
汤爱荣1#曹萍2张涛1于成功1,3&
南京大学医学院附属鼓楼医院消化科1(210008)
南京医科大学鼓楼临床医学院消化科2南京鼓楼医院集团仪征医院消化科3

*基金项目:国家自然科学基金面上项目(81170359, 81470819)
#Email: tangairongno1@163.com
背景:NLRP3炎症小体在炎症性肠病中的作用受到广泛关注。Faecalibacteriumprausnitzii(Fp)是一种具有抗炎作用的共生菌,研究显示其对大鼠结肠炎具有防治作用。目的:探讨Fp治疗大鼠实验性结肠炎的可能机制。方法:50只大鼠随机分为对照组(n=10)和模型组(n=40),模型组以5% TNBS和无水乙醇灌肠诱导结肠炎,造模24 h 后随机分为PBS组、介质组、Fp活菌组和Fp上清组,每天予相应成分1 mL灌胃,连续7 d。第8天处死动物,评估结肠炎症程度,以蛋白质印迹法和real-time PCR检测NLRP3炎症小体组分NLRP3、ASC、caspase-1表达;分别以real-time PCR和ELISA法检测结肠和血浆NLRP3炎症小体下游效应分子IL-1β、IL-18水平。结果:模型组大鼠存在不同程度的体质量减轻、结肠缩短和结肠炎症损伤,Fp活菌组和Fp上清组上述表现较PBS组和介质组明显减轻。PBS组和介质组结肠组织NLRP3、ASC、caspase-1蛋白和mRNA表达显著高于对照组(P<0.05),结肠和血浆IL-1β水平增高(P<0.05),IL-18水平降低(P<0.05)。Fp活菌组和Fp上清组IL-18水平较PBS组和介质组进一步降低(P<0.05),其余参数增高趋势均明显改善(P<0.05)。结论:NLRP3炎症小体参与介导TNBS大鼠结肠炎发生,而Fp可通过抑制NLRP3炎症小体及其下游效应分子而减轻结肠炎症。
关键词结肠炎;NLRP3炎症小体;Faecalibacterium prausnitzii;白细胞介素1β;白细胞介素18
炎症性肠病(inflammatory bowel disease, IBD)的病因和发病机制复杂,目前主要观点认为IBD是由肠道菌群与黏膜免疫之间失衡,导致肠道炎症过度激活所致[1]。炎症小体(inflammasomes)是由多种蛋白组成的功能复合物,参与多种遗传性疾病和自身免疫性疾病的发生、发展[2],目前研究最为深入的是由NLRP3(NACHT, LRR and PYD domains-containing protein 3)、衔接蛋白ASC和pro-caspase-1组成的NLRP3炎症小体,NLRP3通过与ASC相互作用,激活炎症小体中的caspase-1而发挥功能。关于NLRP3炎症小体在IBD中的作用,目前观点不一。Zaki等[3]的研究通过敲除小鼠NLRP3、ASC、caspase-1基因表达,证实NLRP3炎症小体及其下游效应分子白细胞介素-1β(IL-1β)、IL-18对葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎具有保护作用,其中起关键作用的是表达于结肠上皮细胞的NLRP3炎症小体。而Bauer等[4]却发现NLRP3炎症小体可增加小鼠对DSS结肠炎的易感性。因此,其确切作用有待进一步研究。
Faecalibacteriumprausnitzii(F.prausnitzii, Fp)是从克罗恩病(CD)患者肠道菌群中鉴定得到的一种具有抗炎作用的共生菌[5],前期研究显示Fp活菌及其培养上清液对三硝基苯磺酸(TNBS)诱导的大鼠结肠炎具有防治作用,且上清液的作用优于活菌[6]。本研究旨在探讨NLRP3炎症小体在结肠炎发生、发展中的作用,以及Fp活菌及其上清液治疗大鼠实验性结肠炎的可能机制。
材料与方法
一、实验动物、菌株和主要试剂
SPF级雄性6~8周龄Sprague-Dawley大鼠50只,体质量160~200 g,由南京大学医学院附属鼓楼医院实验动物中心提供,饲养于二级动物房。Fp(ATCC 27766,美国模式菌种保藏中心),TNBS(Sigma-Aldrich Co.),兔抗大鼠NLRP3抗体(Novus Biologicals, Inc),兔抗大鼠ASC抗体、小鼠抗大鼠caspase-1抗体(Santa Cruz Biotechnology, Inc.),TRIzol®试剂(Thermo Fisher Scientific Inc.), PrimeScriptTM逆转录试剂盒(Perfect Real Time)、SYBR®Premix Ex Taq Ⅱ(Perfect Real Time)(TAKARA BIO INC.),大鼠IL-1β、IL-18 ELISA试剂盒(Abnova Corporation.)。
二、方法
1. 细菌培养和灌胃液制备:将Fp活菌冻干粉解冻,于厌氧箱中将混悬液接种至LYHBHI培养基,37 ℃培养。取生长至对数期末的菌液离心,将上清液冻干,每100 mL上清液可制成3.7 g冻干粉,-80 ℃保存备用。使用时取3.7 g冻干粉加去离子水20 mL溶解,离心后PBS重悬2次,以PBS调整浓度至1×109CFU/mL,作为灌胃液。
2. 动物模型制备:50只大鼠随机分为对照组(n=10)和模型组(n=40)。动物禁食、不禁水24 h,模型组以5% TNBS 100 mg/kg和无水乙醇(体积比1∶1)灌肠诱导结肠炎[7],对照组予等体积0.9% NaCl溶液灌肠。造模24 h后,将模型组随机分为模型对照组(PBS组)、培养基治疗组(介质组)、Fp活菌治疗组(Fp活菌组)和Fp上清液治疗组(Fp上清组),每组10只,每天予相应成分1 mL灌胃,对照组予PBS灌胃,连续7 d。实验过程中每天记录大鼠体质量、粪便性状、便血情况、精神状态和活动、进食情况。第8天以氯胺酮和地西泮麻醉大鼠,腹主动脉取血后处死,取回盲部至肛门口段全结肠,测量长度后沿纵轴剪开,擦净粪便,取炎症明显部位用于组织学评分,其余部分-80 ℃保存待测。
3. 粪便性状评分:参照Wirtz等[8]采用的评分标准:粪便成形计0分;半成形但未黏附肛门计1分;半成形但黏附肛门计2分;稀便且黏附肛门计3分。
4. 结肠炎症大体评分:参照Butzner等[9]采用的评分标准:无损伤计0分;局部充血、无溃疡计1分;1处溃疡,不伴充血或肠壁增厚计2分;1处溃疡伴有炎症计3分;≥2处溃疡伴有炎症计4分;有一处损伤范围≥1 cm计5分;损伤范围≥2 cm,每增加1 cm评分增加1分(6~10分)。黏连评分:不黏连周围组织计0分;少量黏连、可以分离计1分;大面积黏连计2分。总分为两项评分之和。
5. 结肠炎症组织学评分:参照Dashdorj等[10]采用的评分标准。炎症细胞浸润评分:固有层未见炎症细胞数量增加计0分;固有层炎症细胞数量增加计1分;炎症细胞浸润黏膜下层计2分;炎症细胞浸润全层计3分。组织损伤程度评分:黏膜未见损伤计0分;散在淋巴上皮损伤计1分;黏膜糜烂计2分;广泛黏膜损坏或肠壁全层损坏计3分。总分为两项评分之和。
6. 蛋白质印迹法:取冻存结肠组织约100 mg,RIPA裂解液提取总蛋白,BSA法测定蛋白浓度。取总蛋白上样,行SDS-PAGE电泳,湿法转膜,5%脱脂奶粉封闭,加入NLRP3、ASC或caspase-1抗体孵育16 h,洗涤后加入抗兔或抗小鼠二抗孵育2 h,洗涤后曝光,ImageJ软件分析条带灰度值,目的蛋白相对表达量以其条带灰度值与内参条带灰度值的比值表示。
7. Real-time PCR:TRIzol®试剂抽提结肠组织总RNA,逆转录合成cDNA,以之为模板行real-time PCR。NLRP3引物:F 5’-GCT AAG AAG GAC CAG CCA GA-3’, R 5’-CCA GCA AAC CTA TCC ACT CC-3’;ASC引物:F 5’-TTG CTG GAT GCT CTG TAT GG-3’, R 5’-CCA AGT AGG GCT GTG TTT GC-3’;caspase-1引物:F 5’-TGA AAG ACA AGC CCA AGG TT-3’, R 5’-GGT GTT GAA GAG CAG AAA GCA -3’;IL-1β引物:F 5’-GCC AAC AAG TGG TAT TCT CCA-3’, R 5’-TGC CGT CTT TCA TCA CAC AG-3’;IL-18引物:F 5’-ATA TCG ACC GAA CAG CCA AC-3’, R 5’-CAT CCT TCC ATC CTT CAC AGA-3’;内参β-actin引物:F 5’-TGT CAC CAA CTG GGA CGA TA-3’, R 5’- GGG GTG TTG AAG GTC TCA AA -3’。PCR反应体系:cDNA 2 μL、SYBR®Premix Ex Taq Ⅱ 10 μL、上下游引物各0.4 μL、ROX Reference Dye Ⅱ 0.4 μL和去离子水6.8 μL,共20 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。2-△△Ct法计算目的基因mRNA相对表达量。
8. 血浆IL-1β、IL-18水平测定:参照相应大鼠IL-1β、IL-18 ELISA试剂盒说明书进行操作。
三、统计学分析
结果
一、一般情况
造模24 h后,对照组大鼠未见明显异常,模型组大鼠出现血便、稀水样便,精神状态差,活动、进食减少,体质量减轻。第4天起,Fp活菌组和Fp上清组大鼠体质量较PBS组和介质组明显增加,精神状态好转,活动、进食增加,粪便性状逐渐转为糊状、不成形便,上清组体质量改善优于活菌组(P<0.05)(表1)。
二、结肠长度
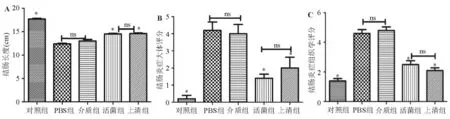
四组模型组大鼠结肠长度均较对照组显著缩短(P<0.05),Fp活菌组和Fp上清组缩短程度较PBS组和介质组明显改善(P<0.05)(图1A)。
三、结肠炎症大体和组织学评分
四组模型组大鼠结肠肉眼可见不同程度的充血、糜烂或溃疡形成,且与周围组织有不同程度的黏连,光学显微镜下炎症细胞浸润和组织损伤明显,Fp活菌组和Fp上清组上述表现较PBS组和介质组明显减轻(P<0.05)(图1B、1C)。
表1 各组大鼠体质量变化和粪便性状评分比较(±s)
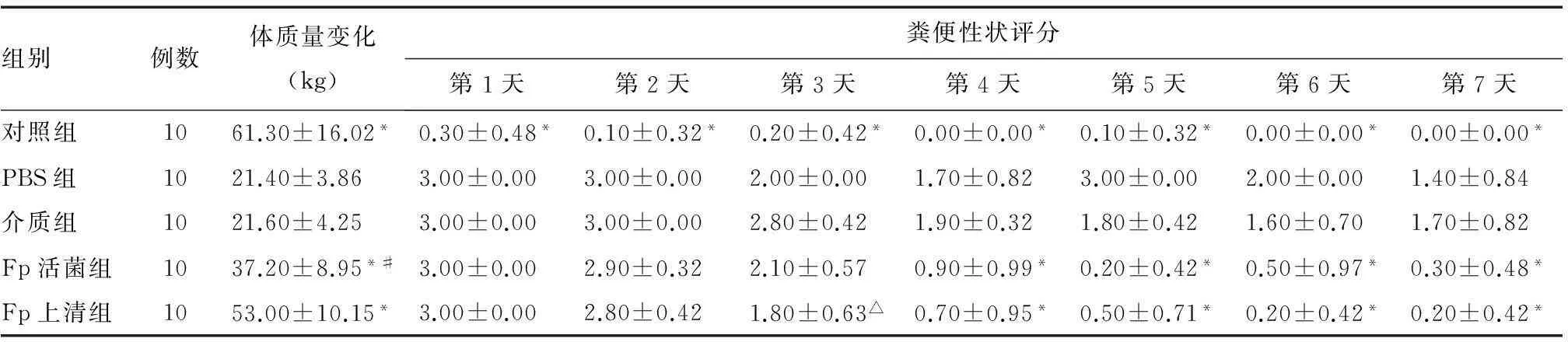
表1 各组大鼠体质量变化和粪便性状评分比较(±s)
组别例数体质量变化(kg)粪便性状评分第1天第2天第3天第4天第5天第6天第7天对照组1061.30±16.02*0.30±0.48*0.10±0.32*0.20±0.42*0.00±0.00*0.10±0.32*0.00±0.00*0.00±0.00*PBS组1021.40±3.863.00±0.003.00±0.002.00±0.001.70±0.823.00±0.002.00±0.001.40±0.84介质组1021.60±4.253.00±0.003.00±0.002.80±0.421.90±0.321.80±0.421.60±0.701.70±0.82Fp活菌组1037.20±8.95*#3.00±0.002.90±0.322.10±0.570.90±0.99*0.20±0.42*0.50±0.97*0.30±0.48*Fp上清组1053.00±10.15*3.00±0.002.80±0.421.80±0.63△0.70±0.95*0.50±0.71*0.20±0.42*0.20±0.42*
体质量变化=最后1 d体质量-初期体质量
*与PBS组和介质组比较,P<0.05;△与介质组比较,P<0.05;#与Fp上清组比较,P<0.05
四、结肠组织NLRP3、ASC、caspase-1蛋白表达
PBS组和介质组结肠组织中的NLRP3、ASC、caspase-1蛋白相对表达量显著高于对照组(P<0.05),Fp活菌组和Fp上清组此种增高趋势明显改善(P<0.05)(图2)。
五、结肠组织NLRP3、ASC、caspase-1、IL-1β、IL-18 mRNA表达
PBS组和介质组结肠组织中的NLRP3、ASC、caspase-1、IL-1β mRNA相对表达量显著高于对照组(P<0.05),Fp活菌组和Fp上清组此种增高趋势明显改善(P<0.05),上清组IL-1β表达降低更为明显(P<0.05);PBS组和介质组IL-18 mRNA相对表达量显著低于对照组(P<0.05),Fp活菌组和Fp上清组较PBS组和介质组进一步降低(P<0.05)(图3)。
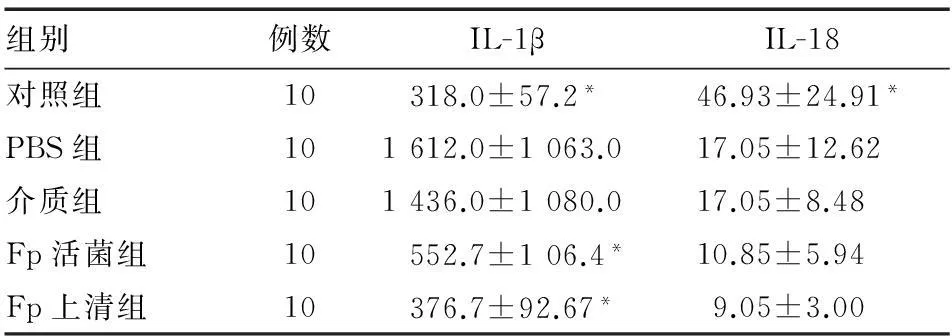
六、血浆IL-1β、IL-18水平
各组血浆IL-1β、IL-18水平与结肠组织中的IL-1β、IL-18 mRNA表达水平基本一致。PBS组和介质组IL-1β水平显著高于对照组(P<0.05),Fp活菌组和Fp上清组此种增高趋势明显改善(P<0.05);PBS组和介质组IL-18水平显著低于对照组(P<0.05),Fp活菌组和Fp上清组较PBS组和介质组进一步降低,但组间差异无统计学意义(P>0.05)(表2)。
*与PBS组和介质组比较,P<0.05;ns:P>0.05
图1各组大鼠结肠长度(A)以及结肠炎症大体(B)和组织学(C)评分
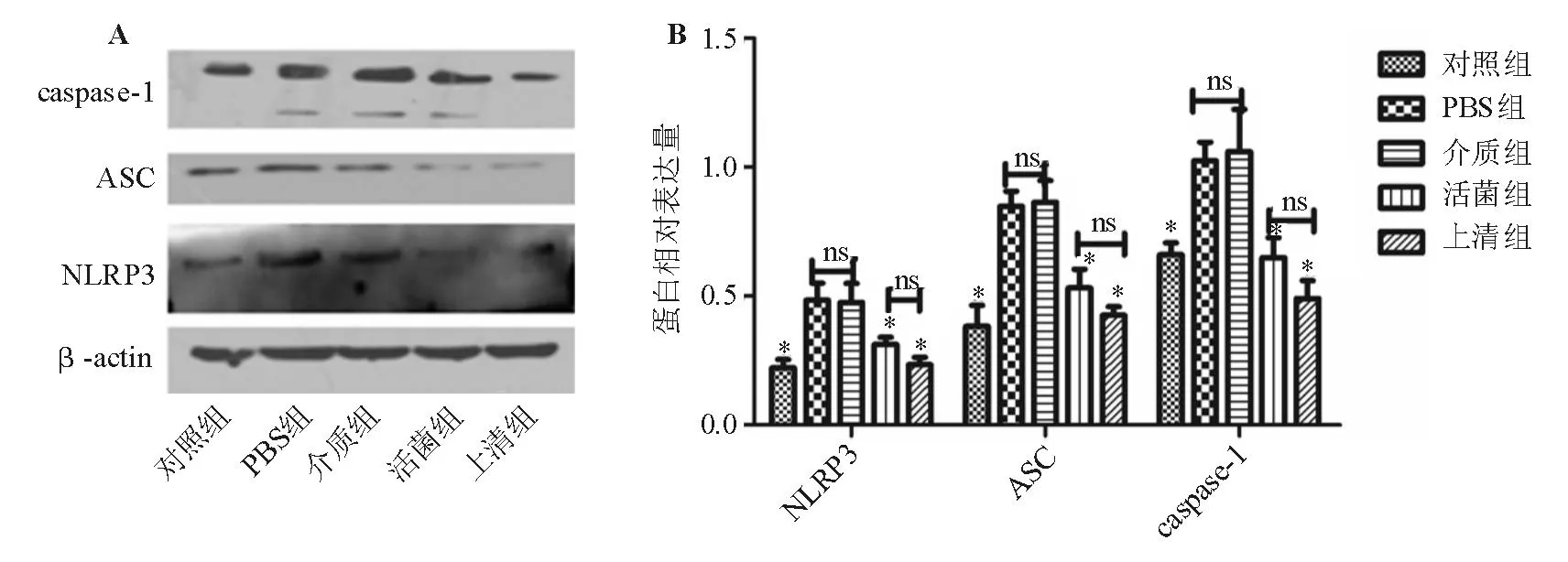
*与PBS组和介质组比较,P<0.05;ns:P>0.05
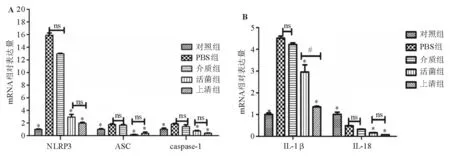
*与PBS组和介质组比较,P<0.05;#Fp活菌组与Fp上清组比较,P<0.05;ns:P>0.05
组别例数IL-1βIL-18对照组10318.0±57.2*46.93±24.91*PBS组101612.0±1063.017.05±12.62介质组101436.0±1080.017.05±8.48Fp活菌组10552.7±106.4*10.85±5.94Fp上清组10376.7±92.67*9.05±3.00
*与PBS组和介质组比较,P<0.05
讨论
近年来,随着IBD发病率的不断增高,其病因和发病机制的研究逐渐深入,并发现调节性T细胞(Treg)/Th17失衡在IBD的发生、发展中起重要作用。在免疫学发病机制方面,NLRP3炎症小体在IBD中的作用受到广泛关注,其作为炎症调节的中心,通过激活pro-caspase-1成为caspase-1,继而促进下游效应分子IL-1β、IL-18成熟和分泌,发挥炎症调节作用[11]。目前观点认为NLRP3炎症小体在IBD中的作用具有两面性,原因在于其下游效应分子的功能。IL-1β的主要功能是促进炎症细胞分化并向炎症部位聚集,同时促进炎症因子分泌而参与机体防御。研究显示IL-1β参与了结肠炎时肠上皮细胞的修复和上皮屏障的重建,IL-1β-/-小鼠对DSS结肠炎的易感性增加[12],而IBD患者的肠上皮细胞和黏膜固有层IL-1β表达又明显高于对照者[13]。pro-IL-1β只有在受到相关刺激后才能产生并活化[14],表明IL-1β水平稳定在结肠稳态中起关键作用。另一NLRP3炎症小体效应分子IL-18又称干扰素-γ诱导因子(IGIF),可由Kupffer细胞、单核细胞、树突细胞、巨噬细胞、肠上皮细胞等多种细胞分泌,能与其他因子协同调节T细胞分化,促进细胞因子分泌,激活NF-κB、MAPK等多种炎症调节通路,发挥炎症调节作用。正常生物体内存在完善的IL-18自身调节系统[15],IL-18过度激活或抑制与炎症性和自身免疫性疾病的发生密切相关[16]。关于IL-18在肠道病变中的作用,有研究显示IL-18-/-或NLRP3炎症小体组分缺失致IL-18表达下调的小鼠对DSS结肠炎的易感性增加,结肠炎症重于野生型小鼠,死亡率高[3,17];然而另有研究发现IBD患者结肠炎症组织IL-18表达上调,提示其参与了炎症的启动和维持[18]。体内IL-1β和IL-18均以非活性前体形式存在,需经转化酶或caspase-1裂解才能转化为活性形式,但正常人和大鼠体内存在IL-18储备,能促进肠上皮细胞再生,维持肠黏膜屏障的完整性,此种具有保护功能的IL-18主要由肠上皮细胞内的NLRP3炎症小体产生[14]。
本实验中TNBS结肠炎模型大鼠结肠组织中的NLRP3炎症小体组分NLRP3、ASC、caspase-1蛋白和mRNA表达水平均显著高于对照组,结肠组织IL-1β mRNA表达和血浆IL-1β水平同步升高,与之前报道的结肠炎组织NLRP3炎症小体水平升高相一致[19],因此可以认为NLRP3炎症小体参与介导了结肠炎的形成。然而,本实验发现结肠炎模型大鼠结肠组织IL-18 mRNA表达和血浆IL-18水平均低于对照组,与Zaki等[3]发现的DSS小鼠结肠炎模型结肠组织和血浆IL-18水平升高不符。在结肠炎动物模型中,IL-1β水平与疾病活动度和病情进展密切相关[13];上皮源性IL-18在结肠炎早期阶段起保护作用,而固有层单核细胞源性IL-18则与慢性结肠炎症有关,IL-18拮抗剂可缓解结肠炎症[20]。Lopetuso等[21]的研究显示,非活动性CD患者结肠上皮中IL-18呈高表达,随着疾病的进展,其表达逐渐降低,但该研究并未在溃疡性结肠炎患者中观察到类似现象,由此推测IL-18在结肠炎中的作用和表达水平在某种程度上取决于疾病阶段及其严重程度。综上推断,本实验中结肠炎模型大鼠结肠组织和血浆IL-18水平降低可能是由于模型动物疾病处于早期和活动期,肠上皮细胞大量损伤,故肠上皮细胞源性IL-18产生极少,血源性IL-18则可能尚未完全启动,最终导致结肠 组织和血浆IL-18低于正常水平。因此,关于NLRP3炎症小体及其下游效应分子在IBD中的具体作用机制,尚待进一步研究。
Fp已被证实是一种具有抗炎作用的共生菌,对大鼠结肠炎具有防治作用[5-6],前期研究发现Fp活菌及其上清液能通过抑制炎症因子IL-17、IL-23等以及调节Treg/Th17比例缓解TNBS诱导的大鼠结肠炎,且上清液的作用优于活菌,可能与上清液中含有以丁酸盐为主的细菌产物有关。上述结果表明Fp活菌及其上清液能通过调节免疫系统发挥抗炎作用。本实验中Fp活菌组和Fp上清组大鼠体质量变化、粪便性状、结肠长度以及结肠炎症大体和组织学评分均较PBS组和介质组明显改善,证实Fp活菌及其上清液能缓解大鼠结肠炎症,在改善体质量方面,上清液的作用优于活菌。此外,Fp活菌及其上清液处理还能明显抑制结肠炎模型大鼠结肠 组织中的NLRP3炎症小体组分NLRP3、ASC、caspase-1表达上调,同时降低结肠组织和血浆中的IL-1β、IL-18水平,其中上清液降低结肠组织IL-1β水平的作用优于活菌,表明Fp活菌及其上清液可能通过抑制NLRP3炎症小体及其下游效应分子缓解TNBS诱导的大鼠结肠炎。
综上所述,NLRP3炎症小体作为固有免疫的调节平台,参与介导TNBS大鼠结肠炎发生,而Fp活菌及其上清液可通过抑制NLRP3炎症小体形成及其下游效应分子的激活而减轻结肠炎症。抑制NLRP3炎症小体激活有望成为IBD新的治疗靶点,而Fp则可能成为IBD治疗领域的新成员。关于Fp作用于炎症小体的具体机制,仍有待进一步研究。
参考文献
1 Ahmed J, Reddy BS, Mølbak L, et al. Impact of probiotics on colonic microflora in patients with colitis: a prospective double blind randomised crossover study[J]. Int J Surg, 2013, 11 (10): 1131-1136.
2 Shaw PJ, McDermott MF, Kanneganti TD. Inflammasomes and autoimmunity[J]. Trends Mol Med, 2011, 17 (2): 57-64.
3 Zaki MH, Boyd KL, Vogel P, et al. The NLRP3 inflammasome protects against loss of epithelial integrity and mortality during experimental colitis[J]. Immunity, 2010, 32 (3): 379-391.
4 Bauer C, Duewell P, Mayer C, et al. Colitis induced in mice with dextran sulfate sodium (DSS) is mediated by the NLRP3 inflammasome[J]. Gut, 2010, 59 (9): 1192-1199.
5 Sokol H, Pigneur B, Watterlot L, et al.Faecalibacteriumprausnitziiis an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients[J]. Proc Natl Acad Sci U S A, 2008, 105 (43): 16731-16736.
6 Qiu X, Zhang M, Yang X, et al.Faecalibacteriumprausnitziiupregulates regulatory T cells and anti-inflammatory cytokines in treating TNBS-induced colitis[J]. J Crohns Colitis, 2013, 7 (11): e558-e568.
7 Foligné B, Nutten S, Steidler L, et al. Recommendations for improved use of the murine TNBS-induced colitis model in evaluating anti-inflammatory properties of lactic acid bacteria: technical and microbiological aspects[J]. Dig Dis Sci, 2006, 51 (2): 390-400.
8 Wirtz S, Neufert C, Weigmann B, et al. Chemically induced mouse models of intestinal inflammation[J]. Nat Protoc, 2007, 2 (3): 541-546.
9 Butzner JD, Parmar R, Bell CJ, et al. Butyrate enema therapy stimulates mucosal repair in experimental colitis in the rat[J]. Gut, 1996, 38 (4): 568-573.
10Dashdorj A, Jyothi KR, Lim S, et al. Mitochondria-targeted antioxidant MitoQ ameliorates experimental mouse colitis by suppressing NLRP3 inflammasome-mediated inflammatory cytokines[J]. BMC Med, 2013, 11: 178.
11Zaki MH, Lamkanfi M, Kanneganti TD. The Nlrp3 inflammasome: contributions to intestinal homeostasis[J]. Trends Immunol, 2011, 32 (4): 171-179.
12Bersudsky M, Luski L, Fishman D, et al. Non-redundant properties of IL-1α and IL-1β during acute colon inflammation in mice[J]. Gut, 2014, 63 (4): 598-609.
13Aguilera M, Darby T, Melgar S. The complex role of inflammasomes in the pathogenesis of Inflammatory Bowel Diseases - lessons learned from experimental models[J]. Cytokine Growth Factor Rev, 2014, 25 (6): 715-730.
14Jin C, Flavell RA. Molecular mechanism of NLRP3 inflammasome activation[J]. J Clin Immunol, 2010, 30 (5): 628-631.
15Monteleone G, Trapasso F, Parrello T, et al. Bioactive IL-18 expression is up-regulated in Crohn’s disease[J]. J Immunol, 1999, 163 (1): 143-147.
16Sedimbi SK, Hägglöf T, Karlsson MC. IL-18 in inflammatory and autoimmune disease[J]. Cell Mol Life Sci, 2013, 70 (24): 4795-4808.
17Takagi H, Kanai T, Okazawa A, et al. Contrasting action of IL-12 and IL-18 in the development of dextran sodium sulphate colitis in mice[J]. Scand J Gastroenterol, 2003, 38 (8): 837-844.
18Lochner M, Förster I. Anti-interleukin-18 therapy in murine models of inflammatory bowel disease[J]. Pathobiology, 2002-2003, 70 (3): 164-169.
19Villani AC, Lemire M, Fortin G, et al. Common variants in the NLRP3 region contribute to Crohn’s disease susceptibility[J]. Nat Genet, 2009, 41 (1): 71-76.
20Bamias G, Corridoni D, Pizarro TT, et al. New insights into the dichotomous role of innate cytokines in gut homeostasis and inflammation[J]. Cytokine, 2012, 59 (3): 451-459.
21Lopetuso LR, Chowdhry S, Pizarro TT. Opposing functions of classic and novel il-1 family members in gut health and disease[J]. Front Immunol, 2013, 4: 181.
(2015-02-12收稿;2015-03-09修回)
Mechanism ofFaecalibacteriumprausnitziiin Treating TNBS-induced Colitis in RatsTANGAirong1,CAOPing2,ZHANGTao1,YUChenggong1,3.1DepartmentofGastroenterology,theAffiliatedDrumTowerHospitalofNanjingUniversityMedicalSchool,Nanjing(210008);2DepartmentofGastroenterology,theDrumTowerClinicalMedicalCollegeofNanjingMedicalUniversity,Nanjing;3DepartmentofGastroenterology,YizhengHospital,DrumTowerHospitalGroupofNanjing,Nanjing
Correspondence to: YU Chenggong, Email: chenggong_yu@nju.edu.cn
Background: NLRP3 inflammasome attracts widespread attention in study of inflammatory bowel disease.Faecalibacteriumprausnitzii(Fp) is an anti-inflammatory commensal bacterium that has preventive and therapeutic effects on rat colitis. Aims: To explore the underlying mechanism of Fp in treating experimental colitis in rats. Methods: Fifty rats were randomly divided into two groups, 10 in control group and 40 in model group. Rats in model group were administered intrarectally with 5% TNBS and dehydrated alcohol to induce experimental colitis. Twenty-four hours afterwards, the model rats were further divided into four groups and administered intragastrically with PBS, culture medium, live Fp and Fp supernatant 1 mL per day, respectively, for 7 days. On day 8, all the rats were sacrificed for evaluation of colonic inflammation. Expressions of the constituents of NLRP3 inflammasome (NLRP3, ASC, and caspase-1) were assessed by Western blotting and real-time PCR; levels of IL-1β and IL-18, the downstream effectors of NLRP3 inflammasome, in colon and plasma were measured by real-time PCR and ELISA, respectively. Results: Weight loss, reduced colon length and colonic inflammatory injury were observed in model rats. These manifestations were ameliorated in live Fp and Fp supernatant groups than those in PBS and culture medium groups. In PBS and culture medium groups, expressions of NLRP3, ASC, and caspase-1 protein and mRNA in colonic tissue were significantly higher than those in control group (P<0.05), the colonic and plasma levels of IL-1β were increased (P<0.05), and IL-18 levels were decreased (P<0.05). In live Fp and Fp supernatant groups, IL-18 level showed a further reduction as compared with PBS and culture medium groups (P<0.05), but the increasing trend for other parameters was reduced (P<0.05). Conclusions: NLRP3 inflammasome participates in the development of TNBS-induced colitis in rats. Fp might alleviate colonic inflammation by inhibiting NLRP3 inflammasome and its downstream effectors.
Key wordsColitis;NLRP3 Inflammasome;Faecalibacterium prausnitzii;Interleukin-1beta;Interleukin-18
通信作者&本文,Email: chenggongyu@nju.edu.cn
DOI:10.3969/j.issn.1008-7125.2015.06.003
