孕期营养影响子代肥胖发生模型的建立研究
2015-02-22袁静泊黄先玫郑绪阳李小莉
袁静泊,黄先玫,郑绪阳,韩 勇,李小莉
·膳食与营养·
孕期营养影响子代肥胖发生模型的建立研究
袁静泊,黄先玫,郑绪阳,韩 勇,李小莉
目的 建立一种能够研究营养性肥胖妊娠妇女对子代肥胖影响的孕鼠肥胖模型。方法 选取SPF级SD成年大鼠,将成功受孕孕鼠40只采用随机数字表法分为对照组(妊娠期间喂养基础饲料),全孕期高能饮食组(妊娠期间喂养高能模型饲料),孕早期高能饮食组(妊娠后前10 d喂养高能模型饲料,之后喂养基础饲料)和高能饮食组(妊娠开始喂养基础饲料,后10 d喂养高能模型饲料),每组各10只。在子代鼠出生后第4、9周,停止喂食12 h后,称取子代鼠体质量,量取体长,计算Lee′s指数;在子代鼠股动脉采集0.5 ml血液标本,采用放射免疫分析法检测血糖、血脂、血胰岛素等指标,并计算胰岛素敏感指数(ISI);取子代鼠肾周和睾周脂肪组织,计算脂体比。采用不同的标准判断各组致肥率:(1)以超过对照组体质量20%为标准进行判断;(2)以超过对照组脂肪垫重量2倍标准差为标准进行判断;(3)以超过对照组Lee′s指数2倍标准差为标准进行判断。结果 出生后第9周,4组体质量、体脂肪、脂体比和Lee′s指数比较,差异均有统计学意义(P<0.05);其中全孕期高能饮食组和孕早期高能饮食组体质量、体脂肪、脂体比和Lee′s指数均高于对照组(P<0.05)。以标准(1)进行判断,孕早期高能饮食组在子代鼠出生后第4周和第9周致肥率均为60%;全孕期高能饮食组在子代鼠出生后第4周和第9周致肥率均为70%;以标准(2)进行判断,孕早期高能饮食组在子代鼠出生后第4周和第9周致肥率均为70%;全孕期高能饮食组在子代鼠出生后第4周和第9周致肥率均为80%;以标准(3)进行判断,孕早期高能饮食组在子代鼠出生后第4周和第9周致肥率均为80%;全孕期高能饮食组在子代鼠出生后第4周和第9周致肥率均为90%。出生后第4周,各组血糖、血脂比较,差异无统计学意义(P>0.05);各组血胰岛素、ISI比较,差异均有统计学意义(P<0.05);其中全孕期高能饮食组和孕早期高能饮食组血胰岛素和ISI与对照组比较,差异均有统计学意义(P<0.05)。出生后第9周,各组血胰岛素、ISI和血脂比较,差异均有统计学意义(P<0.05),其中全孕期高能饮食组和孕早期高能饮食组血胰岛素、ISI和血脂与对照组比较,差异均有统计学意义(P<0.05)。出生后第9周,各组肝脏、脂肪组织重量比较,差异均有统计学意义(P<0.05);其中全孕期高能饮食组和孕早期高能饮食组肝脏和脂肪组织重量较对照组增加(P<0.05)。结论 通过调整孕鼠饮食数量及时间,出生后第4周可诱导建立营养性肥胖孕鼠对子代鼠肥胖影响模型,出生后第9周可建立营养性孕鼠对子代鼠肥胖和代谢综合征影响模型。
产前营养生理学现象;肥胖症;模型,动物
袁静泊,黄先玫,郑绪阳,等.孕期营养影响子代肥胖发生模型的建立研究[J].中国全科医学,2015,18(20):2475-2478.[www.chinagp.net]
Yuan JB,Huang XM,Zheng XY,et al.Establishment of a model of pregnancy nutrition-induced offspring obesity[J].Chinese General Practice,2015,18(20):2475-2478.
目前巨大儿的出生日益增多,而肥胖儿童甚至肥胖成年人也呈增多趋势。有研究发现,除了遗传因素外,孕期营养摄入也是影响胎儿体质量及新生儿出生体质量的重要因素[1]。Victora等[2]指出,成人期阶段的疾病与早期发育过程存在着密切联系,特别是营养在生命早期(孕期)对子代肥胖的影响。因此,孕期营养性肥胖模型的建立,对于研究母亲孕期营养对子代儿童期甚至成人期的肥胖影响有重要的意义。
1 材料与方法
1.1 材料 实验动物为SPF级SD成年大鼠,由中国人民解放军军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2007-004。其中雌性50只,雄性25只,平均体质量为(250±30)g。实验中操作和流程均遵守《实验动物管理条例》,在实验过程中保证动物可以自由进水和进食。
1.2 方法
1.2.1 造模 成年雌雄大鼠适应性喂养1周后,按照雌雄2∶1搭配,17点时雌雄合笼,第二天早晨取雌性大鼠阴道分泌物涂片,显微镜观察,发现精子之日定为第0天。孕鼠单独喂养。
1.2.2 处理方法 将成功受孕孕鼠40只采用随机数字表法分为对照组(妊娠期间喂养基础饲料,南通特罗菲饲料科技有限公司采用GB 14924.3-2001标准生产,批号:LAD1000G20120901201907),全孕期高能饮食组(妊娠期间喂养高能模型饲料,高能饲料组成:基础饲料80.0%、猪油10.0%、胆固醇1.5%、蔗糖8.0%、胆酸钠0.5%;南通特罗菲饲料科技有限公司,批号:LAD1000P20120711101521),孕早期高能饮食组(妊娠后前10 d喂养高能模型饲料,之后喂养基础饲料)和孕晚期高能饮食组(妊娠开始喂养基础饲料,后10 d喂养高能模型饲料),每组各10只。子代鼠出生后全部母鼠改为喂养基础饲料,待子代鼠出生28 d后将其与母鼠分离,于基础饲料喂养4、9周后从每只母鼠所生子代随机选取雄鼠1只进行检测。在18~22 ℃,相对湿度为50%~60%,自然光照,自由饮水摄食的生活环境下饲养。每天定时观察每只子代鼠的粪便质地和量,记录饮食量,每周测定体质量。
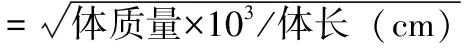
在每只子代鼠股动脉采集0.5 ml血液标本,送至杭州市第一人民医院检验科检测血糖、血脂、血胰岛素(采用放射免疫分析法测定)等指标,将得到的血糖和血胰岛素值相乘后取倒数,然后取其倒数的自然对数,其结果就是胰岛素敏感指数(ISI)。
按照脂体比计算公式:脂体比=〔睾周脂肪质量(g)+肾周脂肪质量(g)〕/体质量(g)×100,取子代鼠肾周和睾周脂肪组织,先用0.9%氯化钠溶液冲洗干净,用滤纸吸干称重,将结果代入公式计算小鼠脂体比。
在子代鼠出生后第9周,于早晨进食后,处死子代鼠,解剖留取肝脏、肾脏、脂肪组织,称取重量。
1.2.4 致肥率 采用不同的标准判断各组致肥率:(1)以超过对照组体质量20%为标准进行判断;(2)以超过对照组脂肪垫重量2倍标准差为标准进行判断;(3)以超过对照组Lee′s指数2倍标准差为标准进行判断。
2 结果
实验过程中,子代鼠可以自由进水和进食,未出现营养不良体征,如生长发育迟缓或体质量下降等。
2.1 各组子代鼠脂体比和Lee′s指数比较 出生后第4周,4组体质量、体脂肪比较,差异均无统计学意义(P>0.05);4组脂体比、Lee′s指数比较,差异均有统计学意义(P<0.05),其中全孕期高能饮食组和孕早期高能饮食组Lee′s指数均高于对照组(P<0.05)。出生后第9周,4组体质量、体脂肪、脂体比和Lee′s指数比较,差异均有统计学意义(P<0.05);其中全孕期高能饮食组和孕早期高能饮食组体质量、体脂肪、脂体比和Lee′s指数均高于对照组,差异有统计学意义(P<0.05,见表1)。
2.2 不同肥胖标准的致肥率比较 以标准(1)进行判断,孕早期高能饮食组在子代鼠出生后第4周和第9周致肥数均为6只,致肥率均为60%;全孕期高能饮食组在子代鼠出生后第4周和第9周致肥数均为7只,致肥率均为70%;孕晚期高能饮食组在子代鼠出生后第4周和第9周致肥数分别为4只和5只,致肥率分别为40%和50%。以标准(2)进行判断,孕早期高能饮食组在子代鼠出生后第4周和第9周致肥数均为7只,致肥率均为70%;全孕期高能饮食组在子代鼠出生后第4周和第9周致肥数均为8只,致肥率均为80%;孕晚期高能饮食组第4周和第9周致肥数均为5只,致肥率均为50%。以标准(3)进行判断,孕早期高能饮食组在子代鼠出生后第4周和第9周致肥数均为8只,致肥率均为80%;全孕期高能饮食组在子代鼠出生后第4周和第9周致肥数均为9只,致肥率均为90%;孕晚期高能饮食组第4周和第9周致肥数分别为5只和6只,致肥率分别为50%和60%。
2.3 各组子代鼠生化指标及ISI比较 出生后第4周,各组血糖、血脂比较,差异无统计学意义(P>0.05);各组血胰岛素、ISI比较,差异均有统计学意义(P<0.05);其中全孕期高能饮食组和孕早期高能饮食组血胰岛素和ISI与对照组比较,差异均有统计学意义(P<0.05),孕晚期高能饮食组血胰岛素和ISI与对照组比较,差异无统计学意义(P>0.05)。出生后第9周,各组血胰岛素、ISI和血脂比较,差异均有统计学意义(P<0.05),其中全孕期高能饮食组和孕早期高能饮食组血胰岛素、ISI和血脂与对照组比较,差异均有统计学意义(P<0.05),孕晚期高能饮食组血胰岛素、ISI和血脂与对照组比较,差异无统计学意义(P>0.05,见表2)。
2.4 各组子代鼠肝脏、肾脏、脂肪组织重量比较 出生后第9周,各组肾脏重量比较,差异无统计学意义(P>0.5),各组肝脏、脂肪组织重量比较,差异均有统计学意义(P<0.05);其中全孕期高能饮食组和孕早期高能饮食组肝脏和脂肪组织重量较对照组增加,差异均有统计学意义(P<0.05),孕晚期高能饮食组脂肪组织重量较对照组增加,差异有统计学意义(P<0.05,见表3)。
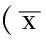
Table3Comparisonoftheweightofliver,kidneyandadiposetissueineachgroup
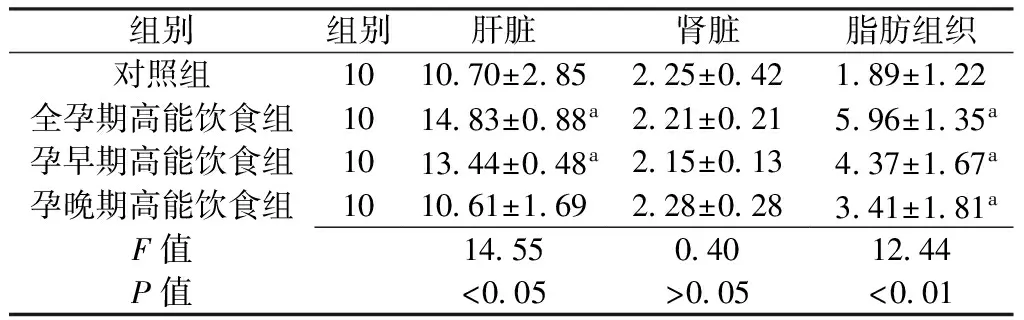
组别组别肝脏肾脏脂肪组织对照组101070±285225±042189±122全孕期高能饮食组101483±088a221±021596±135a孕早期高能饮食组101344±048a215±013437±167a孕晚期高能饮食组101061±169228±028341±181aF值14550401244P值<005>005<001
注:与对照组比较,aP<0.05
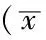
表1 各组子代鼠不同时间Lee′s指数和脂体比比较±s)
注:与对照组比较,aP<0.05
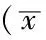
表2 各组子代鼠不同时间代谢参数比较±s)
注:与对照组比较,aP<0.05;ISI=胰岛素敏感指数
3 讨论
近年国际上由Barker等[3]提出的“印迹”或“程序化”效应,其主要含义是生命发育早期的环境及母体等因素可以在胚胎期形成“印迹”,“印迹”使得发育过程中的某些机制“程序化”,进而在出生后甚至成年时“程序化”地表现出特有的现象、行为、反应或者病理过程,从而使该子代个体表现出对某种疾病的易患性。肥胖存在明显的遗传特异性,而其中营养性肥胖模型建立是肥胖遗传特异性研究的关键。但目前,一般的营养模型多是在子代鼠或成年鼠的基础上建立,很难体现出孕鼠营养情况对胎儿期幼鼠的影响,并不适合作为妊娠妇女过度营养对子代肥胖影响研究的动物模型。本研究基于以上思路,建立营养性肥胖孕鼠模型,以利于研究营养性肥胖孕鼠对子代雄鼠肥胖及相关疾病的“程序化”影响。
本实验观察了子代鼠出生后第4周和第9周各指标的变化,在一定程度上模拟了营养性肥胖孕鼠影响子代鼠不同时期体质量模型。
通过调整各组中孕鼠喂养饲料的配比,以及不同配比饲料喂养的时间段,由过度喂养造模,本实验成功体现出孕鼠不同过度饮食对子代鼠肥胖产生的影响,将时间因素首先加入到了该类实验模型中,国内尚无报道。本研究结果显示,子代小鼠在出生后第4周,如果采用超过对照组孕鼠子代体质量20%为标准,则孕早期高能饮食喂养组所生子代鼠致肥率为60%,全孕期高能饮食喂养组所生子代鼠致肥率为70%,与郑绪阳等[4]报道营养性肥胖幼鼠在出生后60 d致肥率为58.3%相比,致肥率明显增高。相比于向建军等[5]建立的幼年肥胖模型,虽然其模型中幼鼠离乳后45 d造模成功,但一直无糖脂代谢紊乱等发生,而本模型出生后第9周已出现内脏脂肪增多并且合并脂代谢紊乱,因此,本模型更适合作为孕期过度饮食对子代肥胖影响研究模型。
本实验结果显示,在子代鼠出生后第4周,全孕期高能饮食组和孕早期高能饮食组胰岛素、ISI与对照组存在差异,而血脂、血糖无差异。在子代鼠出生后第9周,全孕期高能饮食组和孕早期高能饮食组血脂、胰岛素和ISI与对照组存在差异,说明本模型中早期及全孕期高能喂养孕鼠的子代鼠不仅出现了肥胖,而且出现了代谢综合征,与Boullu-Ciocca等[6]实验报道相符合。
孕早期与全孕期高能喂养组肥胖和代谢异常出现的原因,有报道认为可能与孕鼠早期过度喂养,造成孕鼠肥胖,孕鼠供给子代鼠更多的能量,子代鼠的下丘脑-垂体-肾上腺(HPA)轴在形成阶段受到了孕鼠的影响,从而导致子代鼠HPA轴永久性的上调,并增加了脂肪组织糖皮质激素的敏感性[7],从而出现了HPA轴调节异常,以及糖脂代谢紊乱,最终导致子代雄鼠成年后肥胖和代谢紊乱的发生。另有学者指出:孕期过度营养影响子代肥胖发生风险与表观遗传学机制有关,如肥胖与摄食相关基因的DNA超甲基化、染色质结构的异常有关[8]。高能量摄入引起母代子宫环境改变(如高血糖),这种改变直接造成胎儿各组织染色质结构和基因表达的改变[9],以致介导持久的代谢改变出现,其结果便是导致子代肥胖的发生。通过给予不同孕期的高能饮食,可以寻找改变蛋白共价修饰等表观遗传修饰导致子代肥胖的原因。
综上所述,妊娠期营养可能从数量和时间上对子代肥胖产生影响,发育表型的获得可能是两者甚至是更多因素叠加的影响。目前的一些证据已显示,孕期的过度营养将对于子代肥胖的发生有着直接的影响,并且与体内各组织器官的发育编码存在密切联系[10]。因此通过本模型的建立,结合考虑了孕期过度营养的时间和数量两个影响因素,为研究孕期营养影响子代肥胖发生的各种机制提供可能,同时也为妊娠妇女早期营养合理干预避免子代肥胖发生提供科学建议。
开拓思路:
根据“程序化”影响的理论,在本模型基础上,可考虑在孕鼠的不同孕期给予一定的药物或食物,比如儿茶素等,控制孕鼠的肥胖发生,从而减少子代肥胖的发生。另外,也可以通过进一步的实验寻找“程序化”影响理论的分子基础。
[1]Catalano PM,Ehrenberg HM.The short-and long-term implications of maternal obesity on the mother and her offspring[J].BJOG,2006,113(10):1126-1133.
[2]Victora CG,Adair L,Fall C,et al.Maternal and child undernutrition:consequences for adult health and human capital[J].Lancet,2008,371(9609):340-357.
[3]Barker DJ,Bull AR,Osmond C,et al.Fetal and placental size and risk of hypertension in adult life[J].BMJ,1990,301(6746):259-262.
[4]Zheng XY,Huang XM.Diet-induced obesity animal model of impuberism in male rat[J].Chinese Preventive Medicine,2011,2(12):145-147.(in Chinese) 郑绪阳,黄先玫.建立雄性营养性肥胖幼鼠模型的研究[J].中国预防医学杂志,2011,2(12):145-147.
[5]Xiang JJ,Wang WX,Xu RX.Diet-induced obesity animal model of impuberism female SD rat[J].Practical Preventive Medicine,2006,13(1):34-36.(in Chinese) 向建军,王文祥,许榕仙.幼年雌性SD大鼠营养性肥胖模型的建立[J].实用预防医学,2006,13(1):34-36.
[6]Boullu-Ciocca S,Dutour A,Guillaume V,et al.Postnatal diet-induced obesity in rats upregulates systemic and adipose tissue glucocorticoid metabolism during development and in adulthood:its relationship with the metabolic syndrome[J].Diabetes,2005,54(1):197-203.
[7]Malcolm J.Through the looking glass:gestational diabetes as a predictor of maternal and offspring long-term health[J].Diabetes Metab Res Rev,2012,28(4):307-311.
[8]Godfrey KM,Sheppard A,Gluckman PD,et al.Epigenetic gene promoter methylation at birth is associated with child′s later adiposity[J].Diabetes,2011,60(5):1528-1534.
[9]Funato H,Oda S,Yokofujita J,et al.Fasting and high-fat diet alter histone deacetylase expression in the medial hypothalamus[J].PLoS One,2011,6(4):e18950.
[10]Herring SJ,Rose MZ,Skouteris H,et al.Optimizing weight gain in pregnancy to prevent obesity in women and children[J].Diabets Obes Metab,2012,14(3):195-203.
(本文编辑:贾萌萌)
Establishment of A Model of Pregnancy Nutrition-induced Offspring Obesity
YUANJing-bo,HUANGXian-mei,ZHENGXu-yang,etal.
DepartmentofPediatrics,theFirstPeople′sHospitalofHangzhou,Hangzhou310003,China
Objective To establish a model of pregnant rats obesity which can be used to study the influence of pregnant women obesity over offspring obesity.Methods 40 adult SD rats of SPF level being pregnant successfully were,according to random number table,divided into control group(being fed with basic diet),high-energy diet group during whole pregnancy(being fed with high energy model diet),high-energy diet group during early pregnancy(being fed with high-energy diet 10 d after pregnancy and afterwards basic diet)and high-energy diet group in late pregnancy(being fed with basic diet and 10 d before delivery high-energy diet).Every group had 10 rats.The body weight,body length and Lee′s index of the offspring rats were measured 12 h after stopping feeding when the offspring rats age were 4 and 9 weeks;0.5 ml blood sample were collected from the femoral artery to measure blood glucose,blood lipids,insulin and other related indicators by radioimmunoassay method and calculate insulin sensitivity index(ISI);fat tissue around kidney and testicle was used to calculate the rate of fat mass.Different standards were used the judge the rate of causing fat:(1)the body mass in each group was 20% higher than that in the control group;(2)the standard difference of the fat pad in each group and that in the control group was over 2;(3)the standard difference of Lee′s index between them was over 2.Results At postnatal 9 weeks,there was statistically significant difference in body weight,body fat,Lee′s index(P<0.05),which were all higher in high-energy diet group during whole pregnancy than those in high-energy diet group during early pregnancy(P<0.05).The rates of causing fat at postnatal 4 weeks and 9 weeks were all 60% in high energy diet group during early pregnancy and 70% in high energy diet group during the whole pregnancy according to the first standard;which were 70% and 80% respectively according to the second standard and 80% and 90% respectively according to the third standard.At postnatal 4 weeks,the level of blood glucose and lipids showed no significant differences between the groups(P>0.05),however the level of insulin secretion and insulin sensitivity index between the groups was found significant difference(P<0.05)and that difference between high energy diet group during the whole pregnancy and high energy diet group during the early pregnancy was also significant(P<0.05).At postnatal 9 weeks,the level of lipids,ISI and insulin secretion showed no significant differences between the groups(P<0.05)and those differences were also significant between high energy diet group during the whole pregnancy and high energy diet group during the early pregnancy(P<0.05).At postnatal 9 weeks the weights of liver and fat tissue in each group were statistically significant(P<0.05),and the weights of liver and fat tissue in high energy diet groups during the whole pregnancy and during the early pregnancy were heavier than those in the control group(P<0.05).Conclusion By adjusting the number and the time of pregnancy rats,the obesity model of pregnancy nutrition-induced offspring obesity can be induced to establish at postnatal 4 weeks,and the obesity and metabolic syndrome rat model can be established at postnatal 9 weeks.
Prenatal nutritional physiological phenomena;Obesity;Models,animal
杭州市医药卫生科技计划项目(2012A003)
310003浙江省杭州市第一人民医院(南京医科大学杭州医院)儿科
黄先玫,310003浙江省杭州市第一人民医院(南京医科大学杭州医院)儿科;E-mail:hxianmei630715@163.com
R 332
A
10.3969/j.issn.1007-9572.2015.20.028
2014-12-28;
2015-02-01)
