钩藤碱治疗骶上脊髓损伤致逼尿肌反射亢进大鼠的实验研究
2015-02-21刘仁杰姜华茂何春秀
刘仁杰,姜华茂,何春秀
·论著·
钩藤碱治疗骶上脊髓损伤致逼尿肌反射亢进大鼠的实验研究
刘仁杰,姜华茂,何春秀
目的 探讨钩藤碱对骶上脊髓损伤(SSCI)致神经源性膀胱大鼠逼尿肌反射亢进的治疗作用及其机制。方法 将10周龄健康雌性SD大鼠30只(SPF级)按照随机数字表法分为对照组、模型组、治疗组,每组10只。对照组不做任何手术处理,模型组和治疗组采用脊髓横断法制备神经源性膀胱模型。对照组和模型组腹腔注射0.9%氯化钠溶液,治疗组注射钩藤碱(5 mg/kg)。对照组10只大鼠全部存活,模型组8只造模成功,治疗组8只造模成功。4周后,大鼠膀胱行尿动力学检测,离体逼尿肌条电生理学指标检测,膀胱病理切片HE染色观察,蛋白质印迹法检测c-kit蛋白的表达,激光共聚焦显微镜下观察Cajal间质细胞(ICC)数量变化,实时荧光PCR检测ICC中T型钙通道蛋白亚型α1G基因表达水平。结果 与模型组相比,治疗组膀胱最大容量增大(q=8.251,P<0.05),膀胱漏尿点压(q=3.764,P<0.05)和膀胱充盈压均减小(q=5.687,P<0.05),逼尿肌收缩频率降低(q=9.661,P<0.05),最小张力增大(q=5.217,P<0.05),c-kit蛋白表达降低(q=13.688,P<0.05),ICC数量减少(q=7.060,P<0.05),α1G基因表达量降低(q=8.762,P<0.05),差异均有统计学意义。病理切片下观察到治疗组逼尿肌无断裂,肌间隙增宽减少。结论 钩藤碱通过减少神经源性膀胱逼尿肌ICC数量,抑制ICC T型钙通道蛋白亚型α1G基因的表达来抑制ICC起搏兴奋活性,从而减轻逼尿肌的过度亢进,使逼尿肌兴奋性趋于正常。
逼尿肌过度活动;膀胱, 神经原性;钩藤碱;Cajal间质细胞;钙通道, T型;α1G基因
神经源性膀胱(NGB)是一类由神经病变或损害引起的膀胱和/或尿道功能障碍性疾病,严重影响患者的生活质量[1]。关于膀胱疾病的病因研究中,膀胱的肌源性研究越来越受到重视。近来研究表明,Cajal间质细胞(ICC)具有特征性的非选择性阳离子内向电流,是逼尿肌兴奋的重要起搏细胞[2]。其兴奋功能的改变可能与逼尿肌反射亢进相关。
钩藤碱主要来源于茜草科植物钩藤,现代药理学研究表明,钩藤碱可浓度依赖性地开放大鼠动脉平滑肌细胞大电导钙激活钾离子通道使平滑肌舒张,发挥其心脑血管保护作用[3]。有学者在前期的研究中证实了在骶上脊髓损伤(SSCI)导致的NGB中,钩藤碱能够改善膀胱逼尿肌的过度活动[4];后期研究发现,钩藤碱对膀胱漏尿点压、充盈压以及膀胱的最大容量均有保护作用[5],这可能与逼尿肌ICC有关。本研究进一步研究了钩藤碱是否通过作用于ICC而治疗NGB,探讨其作用机制,以期为NGB的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 主要药品与试剂 钩藤碱(上海齐奥化工科技有限公司,纯度99%);兔抗鼠c-kit多克隆抗体,兔抗鼠β-actin多克隆抗体,辣根过氧化物酶标记羊抗兔二抗(武汉博士德生物公司);DAPI细胞染色液(中国碧云天生物技术公司);多聚甲醛(北京索莱宝科技有限公司);PVDF膜(瑞士Roche公司);实时荧光定量PCR试剂盒(美国ABI公司);Krebs营养液参照规范配置。
1.1.2 仪器 四通道多功能生理信号放大器,AV1271微量灌注泵(美国3M公司);Sirius8000尿动力仪(德国WIEST公司);拉力传感器(北京航空航天研究所);台式高速冷冻离心机(德国Sigma公司);TCS SP5型激光共聚焦显微镜(德国Leica公司);ABI 7300 real-time PCR仪(美国ABI公司)。
1.1.3 实验动物 10周龄健康雌性SD大鼠30只(SPF级),购自辽宁医学院实验动物中心,动物合格证号:LY20131022,体质量200~220 g。实验期间正常光照,自由饮食、饮水。
1.2 方法
1.2.1 实验分组及大鼠NGB模型制作 将30只大鼠按照随机数字表法分为3组:对照组、模型组、治疗组,每组10只。钩藤碱根据人与大鼠临床用药剂量换算公式,用量每只每天为5 mg/kg,用pH 6.0~6.5的稀盐酸药物溶剂溶解配成所需浓度。对照组不做任何手术处理,模型组和治疗组采用赵雪燕等[6]脊髓横断法制备SSCI导致的NGB模型。对照组和模型组腹腔注射0.9%氯化钠溶液,治疗组腹腔注射钩藤碱溶液,均1次/d,共注射4周。
1.2.2 尿流动力学检测 4周后大鼠进行尿流动力学检测:10%水合氯醛3 ml/kg腹腔注射麻醉,仰卧位固定,经耻骨弓上纵行切开皮肤找到膀胱,用针头将剪有侧孔的硬膜外导管导入膀胱,然后荷包缝合将导管固定,排空膀胱后硬膜外导管与测压导管连接,然后经三通管与尿动力仪及微量灌注泵分别相连,以0.2 ml/min的速度行膀胱灌注,记录膀胱压力变化和灌注量之间的关系,有尿液连续流出时终止灌注。所有操作完毕后腹腔内注射庆大霉素2万单位。
1.2.3 离体逼尿肌条机械牵拉实验 在尿流动力学检测后第2天,猛击大鼠头部致晕,仰卧固定剪开下腹,全切膀胱,取膀胱体部纵行切成10 mm×3 mm×3 mm的肌条,立即置入4 ℃ Krebs营养液中。肌条的两端用丝线结扎,一端通过器官槽底部小挂钩和微调螺旋相连,另一端和拉力传感器感应头相连。器官槽内充满37 ℃恒温Krebs营养液,通以持续低流量的95%O2和5%CO2混合气体。设置记录软件的参数进行以下实验。
1.2.3.1 检测在固定张力下逼尿肌的收缩频率 调节微螺旋,牵拉肌条张力达到1.0g时将肌条固定,检测逼尿肌收缩频率(连续位相性收缩中舒张张力达到收缩张力最大值的三分之一以上时,计为1次单收缩,单位时间内收缩数目的均值记为收缩频率)。
1.2.3.2 检测机械牵拉导致逼尿肌收缩时的最小张力 将肌条置于完全放松无张力状态,调节微调螺旋,缓慢牵拉肌条直至其开始出现收缩,记录逼尿肌刚收缩时的张力,记为最小张力。此时最小张力反映逼尿肌对兴奋刺激的阈值。
1.2.4 膀胱逼尿肌结构改变 留取部分膀胱组织用10%多聚甲醛固定后做成蜡块,切片并行HE染色,观察各组逼尿肌形态学变化。
1.2.5 蛋白质印迹法检测平滑肌c-kit蛋白的表达 取膀胱组织200 mg,超纯水冲洗数次,去除残余的血细胞和结缔组织。用剪刀剪碎组织块加入裂解液并且匀浆,放在冰上静置10~20 min,离心机12 000 r/min,离心半径8 cm,4 ℃离心10 min。取上清液2 μl,用BCA法进行蛋白定量。每孔上样20 μl,然后SDS-PAGE电泳,转膜,摇床上封闭15 min,加入兔抗鼠c-kit抗体(1∶400),4 ℃下过夜,TBST清洗后加羊抗兔二抗,孵育1 h。ECL显影,用Scion Image软件进行条带分析,c-kit蛋白相对表达量为目的蛋白密度值与内参密度值的比值。
1.2.6 膀胱肌层撕片及细胞染色,激光共聚焦显微镜下对ICC计数 取部分膀胱组织,用5%多聚甲醛溶液浸泡固定8 h,取出后仔细撕掉浆膜层和黏膜层,保留逼尿肌层。然后在普通显微镜下,将逼尿肌层做成100~200 μm厚的组织撕片。用DAPI染色液对细胞核染色10 min,然后放在激光共聚焦显微镜下进行观察,每个标本随机选取3个视野进行ICC计数,取平均值。
1.2.7 采用实时荧光定量PCR检测α1G mRNA在膀胱中的表达 取部分膀胱组织,按照Trizol试剂盒说明书提取总RNA,将RNA用反转录试剂盒反转录成cDNA,取cDNA产物1 μl,加入上下游引物以及SYBR Green qpcr Master Mix,然后加入去离子DEPC水使整个反应体系为20 μl,进行PCR扩增:94 ℃预变性5 min,94 ℃变性30 s,51 ℃退火30 s,72 ℃延长30 s,扩增30个循环。扩增完毕后,以GAPDH为内参照基因,目的基因表达的相对定量值用如下公式计算:目的基因的相对量=2-ΔΔCt,ΔΔCt=ΔCt待测-ΔCt对照,ΔCt待测=〔Ct GI(待测样品)-Ct GAPDH(待测样品)〕,ΔCt对照=〔Ct GI(对照样品)-Ct GAPDH(对照样品)〕。Ct是热循环仪检测到反应体系中荧光信号的强度值,GI 是目的基因,对照样品是任何被选做代表1倍目的基因表达量的样品。引物由上海生工生物工程技术服务有限公司设计并合成,α1G引物:上游5′-TCAGGCGCCAGGCAGCAATAAG-3′,下游5′-CGACCCGCCCCAGAAGGATG-3′ 。GAPDH引物:上游5′-TGGGGTGATGCTGGTGCTGAGT-3′,下游5′-AGGTTTCTCCAGGCGGCATGTC-3′。
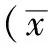
2 结果
2.1 实验动物情况 对照组10只大鼠健康状况良好,全部存活;模型组10只大鼠造模成功8只;治疗组10只大鼠造模成功8只。大鼠死因为血尿、尿漏、尿路感染、肠梗阻。
2.2 尿动力学指标比较 与对照组比较,模型组和治疗组膀胱最大容量减小,漏尿点压、膀胱充盈压均增大,差异有统计学意义(P<0.05)。与模型组比较,治疗组膀胱最大容量增大,漏尿点压、膀胱充盈压均减小,差异有统计学意义(P<0.05,见表1)。
2.3 逼尿肌电生理指标比较 与对照组比较,模型组和治疗组膀胱收缩频率升高,最小张力减小,差异有统计学意义(P<0.05)。与模型组比较,治疗组收缩频率降低,最小张力增大,差异有统计学意义(P<0.05,见表1)。

Table1Comparisonofurodynamicanddetrusorelectrophysiologicalindictorsamongthethreegroups
组别例数膀胱最大容量(ml)漏尿点压(cmH2O)膀胱充盈压(cmH2O)收缩频率(次/min)最小张力(g)对照组10212±0181726±1164855±434217±030069±004模型组8052±009a3368±690a8980±751a461±040a028±009a治疗组8105±010ab2580±286ab7324±557ab307±024ab047±008abF值3617513442211471013225675253P值<0001<0001<0001<0001<0001
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
2.4 膀胱病理切片HE染色结果 光镜下观察,对照组黏膜、黏膜下层及平滑肌层均正常,细胞呈梭形或椭圆形,细胞之间平行排列,分布均匀。模型组逼尿肌出现断裂,细胞排列紊乱,分布不均匀,细胞间隙增宽,黏膜层及黏膜下层有中性粒细胞浸润,平滑肌细胞肥大,弹性纤维减少,胶原纤维增生。治疗组膀胱肌细胞排列方向大体一致,少有逼尿肌断裂,胶原纤维增生较少,细胞间炎性细胞浸润减轻,尚有肌间隙增宽(见图1)。

注:A=对照组,B=模型组,C=治疗组
图1 3组大鼠膀胱组织病理检查(HE染色,×400)
Figure 1 Optional micrographs of rat bladder tissues
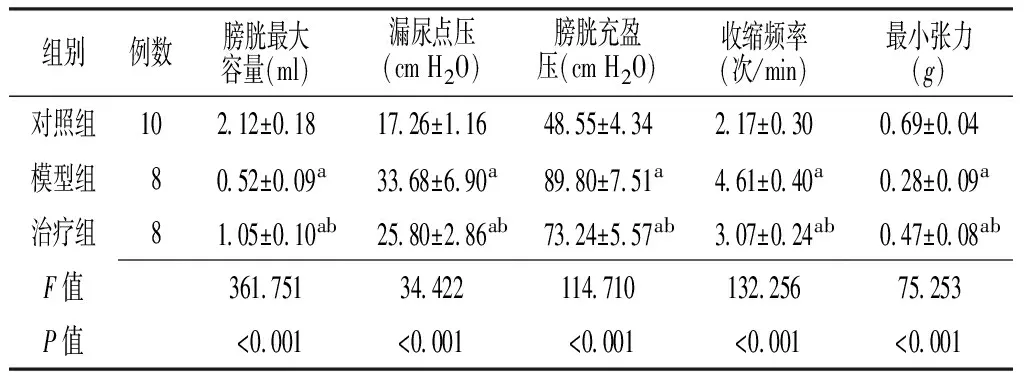
2.5 c-kit蛋白的表达 对照组c-kit蛋白相对表达量为(0.27±0.08),模型组为(1.12±0.15),治疗组为(0.58±0.13),3组间差异有统计学意义(F=262.915,P<0.05);其中,模型组较对照组c-kit蛋白相对表达量增高(q=22.849,P<0.05);治疗组较模型组c-kit蛋白相对表达量降低(q=13.688,P<0.05,见图2)。
注:A=对照组,B=模型组,C=治疗组
图2 3组大鼠c-kit蛋白表达
Figure 2 c-kit protein expression of the rats in three groups
2.6 膀胱ICC数量 ICC呈梭形,核大,有多个突起,细胞核染成蓝色。对照组膀胱ICC数量为(4.3±0.9)个,模型组为(8.0±1.2)个,治疗组为(6.0±1.2)个,3组间差异有统计学意义(F=24.925,P<0.05);其中模型组较对照组增多(q=3.659,P<0.05),治疗组较模型组减少(q=7.060,P<0.05,见图3)。

注:A=对照组,B=模型组,C=治疗组
图3 3组大鼠激光共聚焦显微镜下的ICC
Figure 3 ICC cells under confocal laser scanning microscope of the rats in three groups
2.7 实时荧光定量PCR检测α1G mRNA相对表达量 对照组α1G mRNA相对表达量为(0.28±0.03),模型组为(0.51±0.02),治疗组为(0.39±0.03),3组间差异有统计学意义(F=185.676,P<0.05);其中模型组较对照组增高(q=16.805,P<0.05),治疗组较模型组降低(q=8.762,P<0.05,见图4)。
3 讨论
NGB是指中枢或周围神经系统发生病变引起的排尿功能障碍。有研究显示,脊髓损伤的发病率为(20~>60)/100万,而NGB是其最严重的并发症之一,严重影响患者的生活质量,甚至危及生命[7]。在脊髓损伤2~3周内,无论是SSCI还是骶神经损伤,均为脊髓休克期,这一时期的逼尿肌均不会发生反射,因此本研究将相关指标的检测选在脊髓休克期之后。
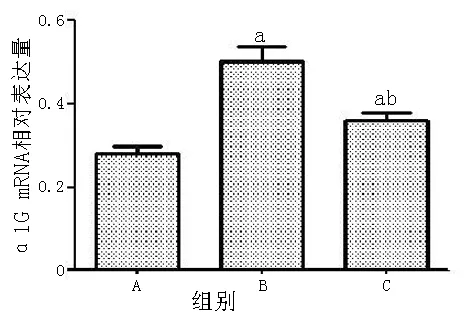
注:A=对照组,B=模型组,C=治疗组;与对照组比较,aP<0.05;与模型组比较,bP<0.05
图4 3组大鼠α1G mRNA相对表达值
Figure 4 Relative expression values of α1G mRNA of the rats in three groups
3.1 尿动力学及逼尿肌电生理指标 SSCI大鼠4周后开始表现为逼尿肌亢进,紧张性增高,膀胱始终处于一种“收缩”的状态,表现为膀胱内压的增高、膀胱最大容量减小。切取膀胱逼尿肌做成离体肌条,仍然可表现出亢进性,如在相同张力下,模型组逼尿肌条仍然能够表现出高于对照组肌条的收缩频率;产生兴奋收缩所需要的最小张力较对照组低,以上结果均表明膀胱平滑肌有一定的“肌源性”,即不受神经的支配仍然可以自主产生兴奋收缩。尿动力学反映了膀胱逼尿肌的功能,电生理学指标反映了逼尿肌的稳定性,本研究对大鼠应用钩藤碱以后,逼尿肌功能得到改善,稳定性增强,逼尿肌的过度亢进得到了明显减轻,证明钩藤碱对NGB的治疗作用明显。
3.2 膀胱病理切片HE染色 本研究病理切片下观察到对照组膀胱逼尿肌排列规整有序,大小一致,分布均匀,肌细胞之间排列紧密几乎没有间隙。模型组逼尿肌排列紊乱,肌细胞间隙增宽,部分肌纤维有损伤甚至断裂。而治疗组膀胱肌细胞排列方向大体一致,少有断裂,肌间隙不明显。说明钩藤碱作用于逼尿肌,能够减轻其向病理状态发展的程度或减缓其病变发展的速度。对于病变之后的逼尿肌,钩藤碱是否能够可逆性地使之恢复正常,本实验没有涉及,今后可以行进一步的实验研究。
3.3 ICC数量、相关蛋白表达及基因表达 有研究表明,ICC具有自律性,缺少ICC的输尿管平滑肌细胞不能形成慢波,单独纵行肌或环形肌在离体状态下也不能形成慢波[8];另有研究显示,用亚甲蓝损伤ICC后,组织中检测不到自发性的慢波[9]。近年来大量研究也证实了ICC是逼尿肌兴奋的起搏细胞。而膀胱中的酪氨酸激酶受体c-kit,除了极其少量的肥大细胞外,只在ICC表达,c-kit已成为ICC的特异标志分子[10]。c-kit受体与ICC兴奋密切相关,有研究表明ICC上的胆碱能受体M3能与c-kit结合,可兴奋T型钙通道电流[11]。c-kit抑制剂Imatinib同样能抑制T型钙通道电流,这表明ICC上的T型钙通道电流很可能依赖c-kit的活化,因此c-kit的表达变化可以作为ICC兴奋起搏活跃度的指标[12]。本研究显示,治疗组大鼠c-kit表达降低,ICC起搏兴奋被抑制。近年来多项研究揭示了ICC与钙通道之间有密切关系。有研究者在膀胱ICC上成功鉴定出T型钙通道,其在细胞启动兴奋时发挥重要作用[13-14]。T型钙通道蛋白α1G可用来作为T型钙通道表达的良好检测指标。本研究结果也验证了这一点,治疗组大鼠的α1G mRNA表达降低,提示T型钙通道中蛋白α1G活性被抑制。
3.4 钩藤碱在NGB治疗方面的应用价值及作用机制 钩藤碱不仅能对心肌产生作用,对于其他类型的平滑肌也有一定影响。已经有文献指出,钩藤碱能改善膀胱的过度活动[15]。如果钩藤碱能作用于亢进的膀胱逼尿肌使之收缩兴奋性减弱,则能够达到治疗NGB的目的。本研究通过对3组大鼠的膀胱最大容量、漏尿点压、膀胱充盈压3项尿动力学指标及离体逼尿肌条的收缩频率、最小张力2项电生理学指标进行比较,证明钩藤碱对逼尿肌的过度活动有一定治疗作用。并且通过检测ICC特异性受体c-kit蛋白的表达及逼尿肌ICC数量,证明钩藤碱的作用机制是通过阻断或抑制ICC上T型钙通道亚型α1G来减少ICC数量,从而减少了逼尿肌兴奋的启动来源,降低逼尿肌的过度兴奋,减轻膀胱的过度活动。关于钩藤碱是如何抑制ICC的数量,通过哪种方式抑制T型钙通道亚型α1G基因表达,是否也抑制T型钙通道上其他亚型的表达,还需进一步的实验研究。
本文创新点:
(1)目前国内外关于钩藤碱在NGB治疗方面的研究较少,本研究通过实验证明了钩藤碱对NGB的治疗作用,为临床NGB用药提供了新思路。(2)发现钩藤碱能够从减少NGB逼尿肌ICC数量和降低ICC起搏兴奋性两方面来降低膀胱逼尿肌的亢进,提示ICC参与了膀胱生理和病理状态下的功能调节,对膀胱兴奋性的作用机制研究、NGB的治疗以及作为多种泌尿系疾病的有效治疗靶点,均有重要意义。
[1]Burnstock G.Purinergic signalling in the lower urinary tract[J].Acta Physiol(Oxf), 2013,207(1): 40-52.
[2]He P,Deng J,Zhong X,et al.Identification of a cyclic nucleotide-gated channel and its subtypes in theurinary bladder of the rat[J].Urology,2012,79(6):1411.e7-13.
[3]Xian YF,Mao QQ,Wu JC,et al.Isorhynchophylline treatment improves the amyloid-β-induced cognitive impairment in rats via inhibition of neuronal apoptosis and tau protein hyperphosphorylation[J].Alzheimers Dis,2014,39(2):331-346.
[4]Huang H,Zhong R,Xia Z,et al.Neuroprotective effects of rhynchophylline against ischemic brain injury via regulation of the Akt/mTOR and TLRs signaling pathways[J].Molecules,2014,19(8):11196-11210.
[5]Jiang HM,Fu DW,Zang LE,et al.Effects of Rhynchophylline on relaxation and contraction of the bladder detrusor in rats[J].Eur Rev Med Pharmacol Sci,2013,17(16):2190-2197.
[6]赵雪燕,石萍,孙煜浩,等.大鼠完全脊髓横断损伤膀胱功能障碍模型的建立及评价[J].中国康复医学杂志,2012,27(2):99-102.
[7]Manack A,Motsko SP,Haag-Molkenteller C,et al.Epidemiology and healthcare utilization of neurogenic bladder patients in a US claims database[J].Neurourol Urodyn,2011,30(3):395-401.
[8]Shin KS,Rothberg BS,Yellen G.Blocker state dependence and trapping in hyperpolarization-activated cation channels:evidence for an intracellular activation gate[J].J Gen Physiol,2001,117(2):91-101.
[9]Igawa Y,Kumano S,Aizawa N,et al.Changes in the function and expression of T-type and N-type calcium channels in the rat bladder after bladder outlet obstruction[J].Urol,2014,191(4):1159-1167.
[10]Vannucchi MG.Receptors in interstitial cells of Cajal:identification a possible physiological roles[J].Microsc Res Tech,1999,47(5):325-335.
[11]Kubota Y,Kajioka S,Biers SM.Investigation of the effect of the c-kit inhibitor Glivec on isolated guinea pig detrusor prepartions[J].Auton Neurosci,2004,115(1/2):64-73.
[12]丁砺蠡,方强,封建立,等.膀胱逼尿肌细胞与Cajal间质细胞结构和功能联系的实验研究[J].中国组织工程研究与临床康复,2008,12(18):3449-3452.
[13]Matsunami M,Miki T,Nishiura K,et al.Involvement of the endogenous hydrogen sulfide/Ca(v) 3.2 T-type Ca2+channel pathway in cystitis-related bladder pain in mice[J].Br J Pharmacol,2012,167(4):917-928.
[14]Jiang X,Luttrell I,Chitaley K,et al.T- and L-type voltage-gated calciumchannels: their role in diabetic bladder dysfunction[J].Neurourol Urodyn,2014,33(1):147-152.
[15]傅德望,姜华茂.钩藤碱治疗膀胱过度活动的实验研究[J].东南大学学报:医学版,2011,30(2):328-331.
(本文编辑:赵跃翠)
Experimental Study of the Effect of Phynchophylline on Detrusor Overactivity Induced by Sacral Spinal Cord Injury in Rats
LIURen-jie,JIANGHua-mao,HEChun-xiu.
TheFirstAffiliatedHospitalofLiaoningMedicalUniversity,Jinzhou121000,China
Objective To investigate the effects of phynchophylline on detrusor overactivity induced by sacral spinal cord injury(SSCI) in rats and the underlying mechanism.Methods Using random number table method, we divided 30 10-week female healthy SD rats into control group, model group and treatment group, with 10 rats in each group.No surgical intervention was made in control group, neurogenic bladder models were made in model group and treatment group by spinal cord transaction.Control group and model group were administrated with 0.9% sodium chloride solution by intraperitoneal infection.Treatment group was administrated with phynchophylline (5 mg/kg).10 rats in control group were all alive,successful model building was made in 8 rats in model group and 8 rats in treatment group.Four weeks later, urine dynamics testing was undertaken with the bladder of rats, in vitro test of the electrophysiological indicators of detrusor was conducted, the pathological sections of bladder were observed by HE staining method, c-kit protein expression was tested by western blotting method, the change in the number of ICC was observed under laser scanning confocal microscope, and the expression level of α1G gene of subunit of T-type calcium channels in ICC was detected by real-time PCR.Results Compared with the model group, the treatment group had larger maximum capacity of bladder(q=8.251,P<0.05), lower bladder leak point pressure(q=3.764,P<0.05), lower bladder filling pressure(q=5.687,P<0.05), lower detrusor contraction frequency(q=9.661,P<0.05), higher minimum tension(q=5.217,P<0.05), lower expression level of c-kit protein(q=13.688,P<0.05), lower number of ICC(q=7.060,P<0.05) and lower α1G gene expression(q=8.762,P<0.05).Conclusion Rhynchophylline can reduce the number of ICC cells in neurogenic detrusor and inhibit the pacemaker activity of ICC cells by inhibiting the expression of α1G gene of subunit of T-type calcium channels in ICC , thereby reducing excessive detrusor hyperactivity and make the excitability of detrusor become normal.
Overactive detrusor;Urinary bladder,neurogenic;Phynchophylline;ICC;Calcium channels, T-type;α1G gene
辽宁省科技厅计划项目(2013225305)
121000辽宁省锦州市,辽宁医学院附属第一医院(刘仁杰,姜华茂);辽宁医学院(何春秀)
姜华茂,121000辽宁省锦州市,辽宁医学院附属第一医院;E-mail:lyyyjhm@163.com
R 694.5
A
10.3969/j.issn.1007-9572.2015.23.017
2015-04-10;
2015-06-25)
刘仁杰,姜华茂,何春秀.钩藤碱治疗骶上脊髓损伤致逼尿肌反射亢进大鼠的实验研究[J].中国全科医学,2015,18(23):2817-2821.[www.chinagp.net]
Liu RJ,Jiang HM,He CX.Experimental study of the effect of phynchophylline on detrusor overactivity induced by sacral spinal cord injury in rats[J].Chinese General Practice,2015,18(23):2817-2821.
