姜黄素对人早幼粒白血病细胞增殖和凋亡的影响及其机制研究
2015-02-21孟腾腾管东方吴广胜张志威齐新宇
孟腾腾,魏 虹,管东方,吴广胜,张志威,齐新宇
·论著·
姜黄素对人早幼粒白血病细胞增殖和凋亡的影响及其机制研究
孟腾腾,魏 虹,管东方,吴广胜,张志威,齐新宇
目的 研究姜黄素对人早幼粒白血病细胞HL-60细胞增殖和凋亡的影响及其可能的作用机制。方法 将HL-60细胞设立实验组、阴性对照组、空白对照组,实验组分姜黄素(0、2.5、5.0、10.0、20.0、40.0 μmol/L)单独亚组和姜黄素(0、5.0、10.0、20.0 μmol/L+30 μmol/L GANT61)联合亚组,于作用24、48 h时观察。采用CCK-8法检测HL-60细胞增殖,计算细胞增殖抑制率;并评价体外联合应用药物对细胞毒性作用是否有协同作用;采用AnnexinⅤ-FITC/PI双染检测细胞凋亡率。结果 姜黄素单独亚组和姜黄素联合亚组在24、48 h对HL-60细胞的抑制率比较,差异均有统计学意义(P<0.05);培养至24、48 h时,5.0、10.0、20.0 μmol/L姜黄素联合亚组分别与5.0、10.0、20.0 μmol/L单独亚组对HL-60增殖抑制率比较,差异均有统计学意义(P<0.05);培养至24、48 h时,10.0、20.0 μmol/L姜黄素联合亚组与0 μmol/L姜黄素联合亚组对HL-60增殖抑制率比较,差异均有统计学意义(P<0.05)。培养至24 h时,5.0 μmol/L姜黄素与30 μmol/L GANT61对HL-60细胞的增殖抑制率呈拮抗作用,培养至48 h时,呈单纯相加作用;24、48 h时,10.0、20.0 μmol/L姜黄素与30 μmol/L GANT61联合用药对HL-60细胞的增殖抑制率均呈增强作用。培养至24、48 h时,姜黄素、GANT61和姜黄素+GANT61对HL-60细胞凋亡率比较,差异均有统计学意义(P<0.05);其中,培养至24 h时,10.0、20.0 μmol/L姜黄素联合用药分别与10.0、20.0 μmol/L姜黄素单独用药对HL-60细胞凋亡率比较,差异均有统计学意义(P<0.05);培养至48 h时,5.0、10.0、20.0 μmol/L姜黄素联合用药分别与5.0、10.0、20.0 μmol/L姜黄素单独用药对HL-60细胞凋亡率比较,差异均有统计学意义(P<0.05);5.0、10.0、20.0 μmol/L姜黄素联合用药与GANT61单独用药对HL-60细胞凋亡率比较,差异均有统计学意义(P<0.05)。结论 姜黄素和GANT61联合用药对HL-60细胞增殖具有协同抑制作用,显著促进HL-60细胞凋亡,而且与浓度和时间有关,姜黄素可能通过抑制Hedgehog信号通路而起作用。
白血病,髓样,急性;姜黄素;GANT61;Hedgehog-Gli信号通路
姜黄素(curcumin)是一种从姜黄根茎中提取的天然化合物,具有抗氧化[1]、抗感染[2]、抗动脉粥样硬化[3]、抗纤维化[4]、神经保护[5]、抗肿瘤[6-7]等作用。姜黄素对人早幼粒白血病细胞HL-60细胞生长有抑制作用,并诱导细胞凋亡[8]。Hedgehog(Hh)信号通路异常活化参与多种肿瘤形成,如皮肤基底细胞癌、小脑成神经管细胞瘤、横纹肌肉瘤、胰腺癌、结肠癌、胃癌、肺癌、前列腺癌[9]。GANT61是特异性抑制Gli转录的Hh-Gli信号通路抑制剂,其可以抑制薯蓣皂苷元(diosgenin)介导的HEL细胞中巨核细胞分化[10],抑制卵巢癌细胞的侵袭和迁移[11],抑制非小细胞型肺癌上皮间质转化[12],抑制肿瘤细胞增殖、促进其凋亡[13-14]。姜黄素通过抑制Hh信号通路进而抑制胶质瘤细胞增殖及细胞集落形成,并显示出浓度和时间依赖性[7]。本实验在体外研究姜黄素单独及与GANT61联合用药对HL-60细胞增殖、凋亡的影响,为今后白血病临床用药提供部分实验依据。
1 材料与方法
1.1 药物和试剂 GANT61为Selleck公司产品;姜黄素(纯度≥94%)购于Sigma公司;RPMI 1640培养基和胎牛血清为Gibco公司产品;Cell Counting Kit-8(CCK-8试剂盒)购自日本同仁化学研究所(Dojindo);AnnexinⅤ-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司。
1.2 细胞株及培养条件 HL-60细胞购自中国科学院细胞库。细胞培养采用含10%胎牛血清,1×105U/L青霉素,含1×105U/L链霉素的RPMI 1640培养液,在37 ℃,5% CO2饱和湿度培养箱中培养,每48 h换液传代1次。取生长良好,细胞活性>95%的细胞进行实验。
1.3 方法
1.3.1 CCK-8实验分组 将HL-60细胞设立实验组、阴性对照组、空白对照组,每组设5个复孔,实验组分姜黄素(0、2.5、5.0、10.0、20.0、40.0 μmol/L)单独亚组和姜黄素(5.0、10.0、20.0 μmol/L)、GANT61(30 μmol/L)联合亚组,阴性对照组为完全培养基+DMSO+HL-60细胞,空白对照组为完全培养基+DMSO,分别作用24、48 h。
1.3.2 CCK-8法检测细胞增殖 取对数生长期HL-60细胞,调整细胞密度,按4.5×104/孔接种细胞于96孔板中,24 h后加入上述不同浓度的药物,放入培养箱中孵育到上述各相应时间,每孔加入10 μl CCK-8溶液作用2 h,用酶标仪测450 nm处各孔的吸光度(OD)值,最后按以下公式计算各实验组抑制率,抑制率(%)=〔1-(实验组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)〕×100%。
1.3.3 协同作用 评价体外联合应用药物对细胞毒性作用是否有协同作用,参照公式判断:Q=Ea+b/(Ea+Eb-Ea×Eb),其中Ea+b为联合用药抑制率,Ea和Eb分别为a药和b药的抑制率。式中分子代表“实测合并效应”,分母是“期望合并效应”。Q值0.86~1.15为单纯相加(+),Q值1.16~2.00为增强(++),Q值0.55~0.85为拮抗(-),Q值<0.55为明显拮抗(--)。
1.3.4 AnnexinⅤ-FITC/PI双染检测细胞凋亡率 收集对数生长期HL-60细胞,调整细胞浓度为3×108/L,培养24 h后,分别单独加入姜黄素(0、5.0、10.0、20.0 μmol/L)、GANT61(30 μmol/L)和姜黄素(5.0、10.0、20.0 μmol/L)、GANT61(30 μmol/L)联合应用,每个浓度均设3个复孔,分别作用24、48 h后,收获培养细胞,用冷PBS洗涤2次,离心去上清液。用Annexin结合液重悬细胞,调整细胞浓度为1×109/L,向细胞悬液加5 μl AnnexinⅤ-FITC混匀,4 ℃避光孵育15 min,加入10 μl PI,4 ℃避光孵育5 min,上流式细胞仪检测。
2 结果
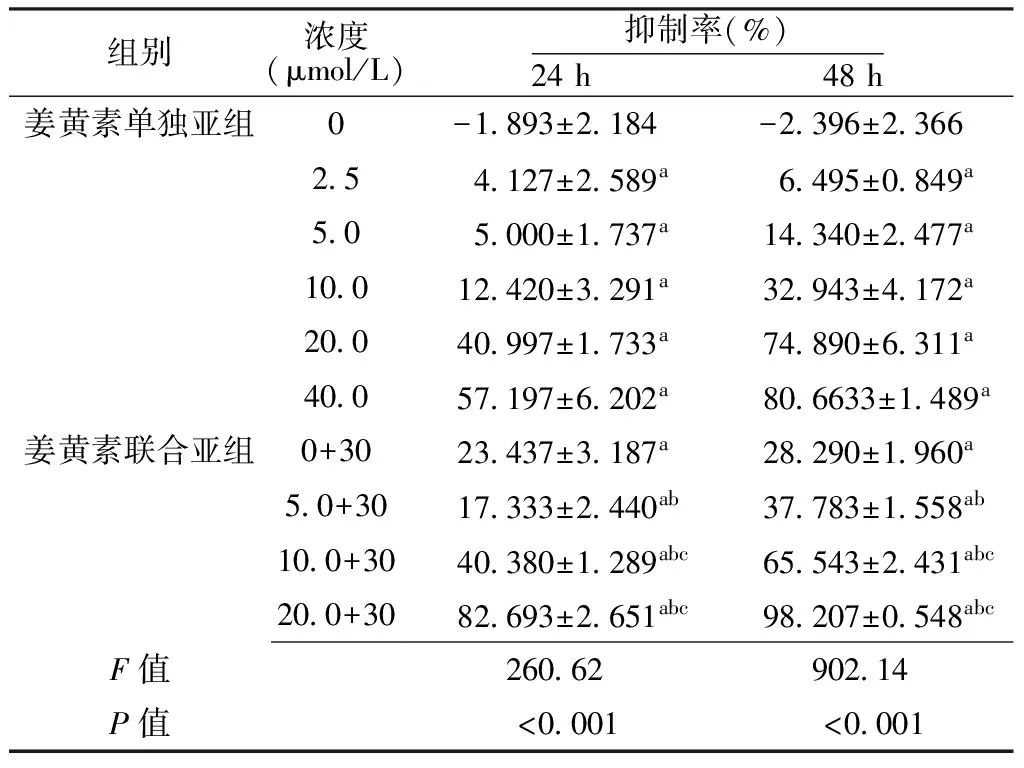
2.1 实验组对HL-60细胞的增殖抑制效应 姜黄素单独亚组和姜黄素联合亚组在24、48h对HL-60细胞的抑制率比较,差异均有统计学意义(P<0.05);其中其他各浓度与0μmol/L姜黄素单独亚组比较,差异均有统计学意义(P<0.05);培养至24、48h时,5.0、10.0、20.0μmol/L姜黄素联合亚组分别与5.0、10.0、20.0μmol/LHL-60增殖抑制率比较,差异均有统计学意义(P<0.05);培养至24、48h时,10.0、20.0μmol/L姜黄素联合亚组与0μmol/L姜黄素联合亚组对HL-60增殖抑制率比较,差异均有统计学意义(P<0.05,见表1)。

Table 1 Comparison of proliferation inhibition rate of HL-60 cells between curcumin single subgroups and curcumin combined subgroups
组别浓度(μmol/L)抑制率(%)24h 48h姜黄素单独亚组0-1893±2184-2396±2366254127±2589a6495±0849a505000±1737a14340±2477a10012420±3291a32943±4172a20040997±1733a74890±6311a40057197±6202a806633±1489a姜黄素联合亚组0+3023437±3187a28290±1960a50+3017333±2440ab37783±1558ab100+3040380±1289abc65543±2431abc200+3082693±2651abc98207±0548abcF值2606290214P值<0001<0001
注:与0 μmol/L姜黄素单独亚组比较,aP<0.05;与同一浓度水平姜黄素单独亚组比较,bP<0.05;与0 μmol/L姜黄素联合亚组比较,cP<0.05
2.2 协同作用 培养至24 h时,5.0 μmol/L姜黄素与30 μmol/L GANT61对HL-60细胞的增殖抑制率呈拮抗作用,10.0、20.0 μmol/L姜黄素与30 μmol/L GANT61联合用药对HL-60细胞的增殖抑制率呈增强作用;培养至48 h时,5.0 μmol/L姜黄素与30 μmol/L GANT61对HL-60细胞的增殖抑制率呈单纯相加作用,10.0、20.0 μmol/L姜黄素与30 μmol/L GANT61对HL-60细胞的增殖抑制率呈增强作用(见表2)。
表2 姜黄素联合GANT61对HL-60细胞协同抗肿瘤作用
Table 2 Synergistic antitumor effect of the simultaneous administration of curcumin and GANT61 on HL-60 cells

姜黄素联合GANT61(μmol/L)Q值24h 48h50+30065098100+30133126200+30151120
2.3 姜黄素和GANT61对HL-60细胞凋亡率的影响 培养至24、48 h时,姜黄素、GANT61和姜黄素+GANT61对HL-60细胞凋亡率比较,差异均有统计学意义(P<0.05);其中,培养至24 h时,20.0 μmol/L姜黄素单独用药及5.0 μmol/L、10.0 μmol/L、20.0 μmol/L姜黄素联合用药对HL-60细胞凋亡率与0 μmol/L姜黄素单独用药比较,差异均有统计学意义(P<0.05);10.0、20.0 μmol/L姜黄素联合用药分别与10.0、20.0 μmol/L姜黄素单独用药对HL-60细胞凋亡率比较,差异均有统计学意义(P<0.05);培养至48 h时,其他各浓度用药与0 μmol/L姜黄素单独用药对HL-60细胞凋亡率比较,差异均有统计学意义(P<0.05);5.0、10.0、20.0 μmol/L姜黄素联合用药分别与5.0、10.0、20.0 μmol/L姜黄素单独用药对HL-60细胞凋亡率比较,差异均有统计学意义(P<0.05);5.0、10.0、20.0 μmol/L姜黄素联合用药与GANT61单独用药对HL-60细胞凋亡率比较,差异均有统计学意义(P<0.05,见表3)。
3 讨论
急性髓系白血病(acute myeloid leukemia,AML)是一类造血干细胞恶性克隆性疾病,虽然当前诱导治疗完全缓解率近80%,但60%以上最终耐药复发[15],5年总生存率不到40%。因此,研发新的化疗药物及新的联合用药方案尤其是敏感有效、毒副作用小且经济适用的化疗方案成为当今研究的热点。
姜黄素是姜黄的主要组成部分,通常被用于香料和食品着色剂,来源广泛、价格低廉且每天应用剂量高达10 g对人体无不良反应,可通过多种不同途径发挥良好的抗肿瘤作用,目前,已有临床试验应用姜黄素治疗胰腺癌,多发性骨髓瘤和结肠直肠癌[16-17]。

Table 3 Comparison of apoptosis rate of HL-60 cells between the single application of curcumin,GANT61 and the combined application of them

组别浓度(μmol/L)凋亡率(%)24h 48h姜黄素单独用药04153±15113413±1050505497±11309787±0653a1006340±124813853±1665a20019270±1784a34187±1978aGANT61单独用药307543±128916443±0537a姜黄素+GANT61联合用药50+308710±1192a27353±0491abc100+3017000±4403abc36177±1662abc200+3040696±2143abc39643±1446abcF值10672790979P值<0001<0001
注:与0 μmol/L姜黄素单独用药比较,aP<0.05;与同一浓度水平姜黄素单独用药比较,bP<0.05;与GANT61单独用药比较,cP<0.05
本研究单独应用姜黄素作用于HL-60细胞,显示其可抑制HL-60细胞增殖、促进凋亡,且这些作用受时间和剂量影响。培养至24 h时,5.0 μmol/L和20.0 μmol/L姜黄素对HL-60细胞增殖抑制率分别约为5%和40%,与吴裕丹等[18]和闵旻等[19]研究结果一致。Hh信号通路转录因子Gli1、Gli2至少有一个持续性活化,这对肿瘤的发展非常重要[20-23]。下游Gli转录因子是Hh通路转导终末阶段,不同的通路活化路径最终通过Gli发挥作用,因此,Gli特异性抑制剂比上游特异性抑制剂具有更大的适用性[9]。HL-60细胞中Hh信号通路活化不依赖转导因子SMO,rshh和特异性SMO抑制剂cyclopamine对HL-60细胞增殖、凋亡无作用,然而30 μmol/L GANT61可抑制其增殖,促进其凋亡[24]。因此选用30 μmol/L GANT61进行实验。窦志金等[7]研究表明,姜黄素通过抑制Hh信号通路,进而抑制胶质瘤细胞增殖及细胞集落形成,并显示出浓度和时间依赖性。因此本实验通过应用GANT61阻断HL-60细胞Hh信号通路,进而验证姜黄素是否通过Hh信号通路对HL-60细胞的增殖、凋亡起作用。本研究结果显示,姜黄素和GANT61联合用药后对HL-60细胞增殖抑制作用高于单独应用姜黄素,联合用药时姜黄素浓度越高,作用时间越长,增殖抑制作用越强。在姜黄素和GANT61联合用药对HL-60细胞凋亡影响研究发现,联合用药凋亡率高于单独用药。研究发现,姜黄素通过抑制Sonic Hh信号通路,进而抑制成神经管细胞瘤细胞增殖、促进凋亡[25],因此,笔者推测姜黄素可能是通过Hh信号通路对HL-60细胞的增殖、凋亡发挥作用,但其具体作用机制仍有待进一步研究。
姜黄素抗癌机制复杂,至今未完全清楚,但其抗瘤的作用已得到大量研究证实。随着研究的不断深入,其可能在治疗白血病领域形成一个新热点。
[1]Aggarwal BB,Harikumar KB.Potential therapeutic effects of curcumin,the anti-inflammatory agent,against neurodegenerative,cardiovascular,pulmonary,metabolic,autoimmune and neoplastic diseases[J].Int J Biochem Cell Biol,2009,41(1):40-59.
[2]Yang ZS,Peng ZH,Li XL,et al.Effect of curcumin on IL-17-induced nitric oxide production and expression of iNOS in human keratinocytes[J].Chinese Journal of Cellular and Molecular Immunology,2011,27(9):959-961.
[3]Shin SK,Ha TY,McGregor RA,et al.Long-term curcumin administration protects against atherosclerosis via hepatic regulation of lipoprotein cholesterol metabolism[J].Mol Nutr Food Res,2011,55(12):1829-1840.
[4]Zheng J,Wu C,Lin Z,et al.Curcumin up-regulates phosphatase and tensin homologue deleted on chromosome 10 through microRNA-mediated control of DNA methylation——a novel mechanism suppressing liver fibrosis[J].FEBS J,2014,281(1):88-103.
[5]Ma J,Liu J,Yu H,et al.Curcumin promotes nerve regeneration and functional recovery in rat model of nerve crush injury[J].Neurosci Lett,2013,547:26-31.
[6]Fan JX,Zeng YJ,Wu JW,et al.Synergistic killing effect of arsenic trioxide combined with curcumin on KG1a cells[J].Journal of Experimental Hematology,2014,22(5):1267-1272.
[7]Dou ZJ,Du WZ,Liu X,et al.Curcumine inhibits the proliferation of glioma cells through Hedgehog signaling pathway[J].Chinese Journal of Minimally Invasive Neurosurgery,2014,19(5):228-231.(in Chinese) 窦志金,杜文众,刘幸,等.姜黄素通过Hedgehog信号通路抑制胶质瘤细胞增殖[J].中国微侵袭神经外科杂志,2014,19(5):228-231.
[8]Hu LS,Xiong WY,Yu LH,et al.Curcumin induced acute promyeloblast leukemia HL-60 cells apoptosis through up-regulating NF-κB[J].Shandong Medical Journal,2011,51(12):23-25.(in Chinese) 胡亮杉,熊文艳,余莉华,等.姜黄素上调NF-κB诱导急性早幼粒白血病HL-60细胞凋亡[J].山东医药,2011,51(12):23-25.
[9]Lauth M,Bergström A,Shimokawa T,et al.Inhibition of GLI-mediated transcription and tumor cell growth by small-molecule antagonists[J].Proc Natl Acad Sci U S A,2007,104(20):8455-8460.
[10]Ghezali L,Liagre B,Limami Y,et al.Sonic Hedgehog activation is implicated in diosgenin-induced megakaryocytic differentiation of human erythroleukemia cells[J].PLoS One,2014,9(4):e95016.
[11]Chen Q,Xu R,Zeng C,et al.Down-regulation of Gli transcription factor leads to the inhibition of migration and invasion of ovarian cancer cells via integrin β4-mediated FAK signaling[J].PLoS One,2014,9(2):e88386.
[12]Li H,Da LJ,Fan WD,et al.Transcription factor glioma-associated oncogene homolog 1 is required for transforming growth factor-β1-induced epithelial-mesenchymal transition of non-small cell lung cancer cells[J].Mol Med Rep,2015,11(5):3259-3268.
[13]Graab U,Hahn H,Fulda S.Identification of a novel synthetic lethality of combined inhibition of hedgehog and PI3K signaling in rhabdomyosarcoma[J].Oncotarget,2015,6(11):8722-8735.
[14]Wellbrock J,Latuske E,Köhler J,et al.Expression of Hedgehog pathway mediator GLI represents a negative prognostic marker in human acute myeloid leukemia and its inhibition exerts antileukemic effects[J].Clin Cancer Res,2015,21(10):2388-2398.
[15]Colado E,Paíno T,Maiso P,et al.Zalypsis has in vitro activity in acute myeloid blasts and leukemic progenitor cells through the induction of a DNA damage response[J].Haematologica,2011,96(5):687-695.
[16]Tuorkey MJ.Curcumin a potent cancer preventive agent:Mechanisms of cancer cell killing[J].Interv Med Appl Sci,2014,6(4):139-146.
[17]Rahmani AH,Al Zohairy MA,Aly SM,et al.Curcumin:a potential candidate in prevention of cancer via modulation of molecular pathways[J].Biomed Res Int,2014(2014):761608.doi:10.1155/2014/761608.
[18]吴裕丹,陈燕,陈文娟.姜黄素对急性髓性白血病细胞HL-60增殖和凋亡的影响[J].同济医科大学学报,1999,28(4):299-301.
[19]Min M,Gao QP.Effects of curcumin on PI3K/AKT signaling pathway in HL60 cells[J].Hainan Medical Journal, 2012,23(6):3-5.(in Chinese) 闵旻,高清平.姜黄素对HL60细胞PI3K/AKT信号传导通路的影响[J].海南医学,2012,23(6):3-5.
[20]Nilsson M,Undèn AB,Krause D,et al.Induction of basal cell carcinomas and trichoepitheliomas in mice overexpressing GLI-1[J].Proc Natl Acad Sci U S A,2000,97(7):3438-3443.
[21]Grachtchouk M,Mo R,Yu S,et al.Basal cell carcinomas in mice overexpressing Gli2 in skin[J].Nat Genet,2000,24(3):216-217.
[22]Sheng H,Goich S,Wang A,et al.Dissecting the oncogenic potential of Gli2:deletion of an NH(2)-terminal fragment alters skin tumor phenotype[J].Cancer Res,2002,62(18):5308-5316.
[23]Kimura H,Stephen D,Joyner A,et al.Gli1 is important for medulloblastoma formation in Ptc1+/- mice[J].Oncogene,2005,24(25):4026-4036.
[24]Pan D,Li Y,Li Z,et al.Gli inhibitor GANT61 causes apoptosis in myeloid leukemia cells and acts in synergy with rapamycin[J].Leuk Res,2012,36(6):742-748.
[25]Elamin MH,Shinwari Z,Hendrayani SF,et al.Curcumin inhibits the Sonic Hedgehog signaling pathway and triggers apoptosis in medulloblastoma cells[J].Mol Carcinog,2010,49(3):302-314.
(本文编辑:贾萌萌)
Influence of Curcumin on the Proliferation and Apoptosis of HL-60 Cells and Its Mechanism
MENGTeng-teng,WEIHong,GUANDong-fang,etal.
DepartmentofHistologyandEmbryology,CollegeofMedicine,ShiheziUniversity,Shihezi832002,China
Objective To investigate the influence of curcumin on the proliferation and apoptosis of human promyelocytic leukemia HL-60 cells and its possible mechanism.Methods We divided the included HL-60 cells into trial group,negative control group and blank control group.The trial group was further divided into single subgroups(0,2.5,5.0,10.0,20.0,40.0 μmol/L curcumin)and combined subgroups(5.0,10.0,20.0 μmol/L curcumin+30 μmol/L GANT61).Observations were conducted 24 hours and 48 hours after the trial began.CCK-8 method was used to detect the proliferation of HL-60 cells,and the proliferation inhibition rate was calculated.In vitro combined application of medicines was investigated to observe whether synergistic effect exists.AnnexinⅤ-FITC/PI double-stained method was employed to detect the apoptosis rate of cells.Results The single subgroup and combined subgroup were significantly different(P<0.05)in 24 h and 48 h inhibition rates;the 5.0,10.0 and 20.0 μmol/L combined subgroups were significantly different from 5.0,10.0 and 20.0 μmol/L single subgroups in 24 h and 48 h proliferation inhibition rates;10.0 and 20.0 μmol/L combined subgroups and 0 μmol/L combined subgroup were significantly different(P<0.05)in 24 h and 48 h inhibition rates.Antagonistic effect occurred in the combined subgroup with 5.0 μmol/L curcumin+30 μmol/L GANT61 on 24 h proliferation inhabitation rate,and pure additive effect occurred in this group on 48 h proliferation inhabitation rate;potentiation occurred in the combined subgroups with 10.0 or 20.0 μmol/L+30 μmol/L GANT61 on 24 h and 48 h proliferation inhabitation rates.Curcumin,GANT61 and curcumin+GANT61 were significantly different(P<0.05)in the effect on 24 h and 48 h apoptosis rates;the 10.0 and 20.0 μmol/L combined subgroups were significantly different(P<0.05)from 10.0 and 20.0 μmol/L single subgroups in 24 h apoptosis rate;the 5.0,10.0 and 20.0 μmol/L combined subgroups were significantly different(P<0.05)from 5.0,10.0 and 20.0 μmol/L single subgroups in 48 h apoptosis rate;the combined application of 5.0,10.0 or 20.0 μmol/L curcumin+GANT61 was significantly different(P<0.05)from the single use of GANT61 in apoptosis rate.Conclusion The combined application of curcumin and GANT61 has synergistic inhibition effect on the proliferation of HL-60 cells and obviously speeds up the apoptosis of HL-60 cells.Its efficacy has correlation with concentration and time.Curcumin may take effects by inhibiting Hedgehog signaling pathway.
Leukemia,myeloid,acute;Curcumin;GANT61;Hedgehog-Gli signaling pathway
国家自然科学基金资助项目(81460024);石河子大学优秀青年项目(2013ZRKXYQ26)
832002新疆石河子市,石河子大学医学院组织胚胎学教研室(孟腾腾,魏虹,管东方,张志威);石河子大学医学院第一附属医院血液风湿科(吴广胜);石河子大学医学院(齐新宇)
魏虹,832002新疆石河子市,石河子大学医学院组织胚胎学教研室;E-mail:weihong-2@163.com
R 733.72
A
10.3969/j.issn.1007-9572.2015.23.013
2015-04-28;
2015-06-06)
孟腾腾,魏虹,管东方,等.姜黄素对人早幼粒白血病细胞增殖和凋亡的影响及其机制研究[J].中国全科医学,2015,18(23):2800-2804.[www.chinagp.net]
Meng TT,Wei H,Guan DF,et al.Influence of curcumin on the proliferation and apoptosis of HL-60 cells and Its mechanism[J].Chinese General Practice,2015,18(23):2800-2804.
