活性维生素D3对人系膜细胞凋亡及Caspase-3表达的影响
2015-02-21陈建平张春江
张 昊,尹 璇,陈建平,马 莉,张春江,刘 春
·论著·
活性维生素D3对人系膜细胞凋亡及Caspase-3表达的影响
张 昊,尹 璇,陈建平,马 莉,张春江,刘 春
目的 探讨活性维生素D3〔1,25(OH)2D3〕对人系膜细胞凋亡的影响,并初步探究其作用机制。方法 体外培养人系膜细胞,随机分为4组:正常对照组,表皮生长因子(EGF)组,1,25(OH)2D3组,EGF联合1,25(OH)2D3组,采用流式细胞术检测各组系膜细胞的凋亡率,Western blotting检测各组半胱氨酸蛋白酶-3(Caspase-3)蛋白表达的情况。结果 与正常对照组比较,EGF组系膜细胞凋亡率降低,Caspase-3表达量降低(P<0.05),1,25(OH)2D3组系膜细胞的凋亡率升高,Caspase-3表达量升高(P<0.05);与EGF组比较,EGF联合1,25(OH)2D3组系膜细胞的凋亡率升高,Caspase-3表达量升高(P<0.05);EGF联合1,25(OH)2D3组与正常对照组系膜细胞的凋亡率和Caspase-3表达量间差异均无统计学意义(P>0.05)。结论 1,25(OH)2D3可能是通过上调Caspase-3的表达而诱导系膜细胞的凋亡。EGF可抑制人系膜细胞的凋亡,1,25(OH)2D3可逆转EGF对系膜细胞凋亡的抑制作用。
人系膜细胞;1,25(OH)2D3;细胞凋亡;Caspase-3;表皮生长因子
张昊,尹璇,陈建平,等.活性维生素D3对人系膜细胞凋亡及Caspase-3表达的影响[J].中国全科医学,2015,18(5):540-543.[www.chinagp.net]
Zhang H,Yin X,Chen JP,et al.Effect of 1,25(OH)2D3on apoptosis of human mesangial cells and Caspase-3 expression[J].Chinese General Practice,2015,18(5):540-543.
人系膜细胞是肾脏主要固有细胞之一,人系膜细胞的异常增殖和细胞外基质沉积是系膜增生性肾小球肾炎的主要病理特征[1]。在肾脏疾病炎症的修复过程中可以通过细胞凋亡来消除过度增殖的系膜细胞[2]。近期研究表明,活性维生素D3〔1,25(OH)2D3〕除具有调节机体的钙、磷代谢作用外,还具有抑制细胞增殖和诱导细胞凋亡的作用[3]。本课题组前期已经证实1,25(OH)2D3能够抑制大鼠系膜细胞增殖,诱导其凋亡[4]。本研究拟通过建立表皮生长因子(EGF)诱导系膜细胞增殖微环境,观察1,25(OH)2D3及EGF联合1,25(OH)2D3对人系膜细胞凋亡的影响及其相关凋亡蛋白的表达情况,进一步探究活性维生素D3对人系膜细胞凋亡的影响及其作用机制,为临床治疗增生性肾小球肾炎提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 细胞株 人肾小球系膜细胞株(4200)购于湘雅医学院中心实验室。
1.1.2 主要试剂 EGF(美国Peprotech公司)和1,25(OH)2D3(Sigma公司)、AnnexinV/PI双染法凋亡试剂盒(美国Biovision公司)、胰蛋白酶和低糖DMEM培养基(美国Gibco公司产品)、胎牛血清(Hyclong公司),兔抗人Caspase-3单克隆抗体(Cell Signaling公司),小鼠抗人β-actin单克隆抗体,山羊抗兔IgG二抗,山羊抗小鼠IgG二抗(北京中杉金桥生物技术有限公司)。
1.2 仪器与设备 流式细胞仪(德国Partec公司)、倒置相差显微镜(日本Olympus公司IX71)、普通光学显微镜(日本Olympus公司)。
1.3 试验方法
1.3.1 细胞培养及分组 系膜细胞复苏后用含10%胎牛血清的DMEM培养基于5%CO2、37 ℃饱和湿度条件下培养,当细胞生长至70%~80%融合时,用0.25%胰蛋白酶消化传代继续培养,细胞传代培养至第3~8代用于实验。
1.3.2 实验分组及细胞干预 收集对数期系膜细胞,计数后接种于培养板中,待细胞完全贴壁,弃完全培养基,加入无血清DMEM培养液同步化24 h,按照随机数字表法分为4组:空白对照组加含5%胎牛血清DMEM培养基;EGF组加含10 μg/L EGF的培养液(含5%胎牛血清DMEM培养基);1,25(OH)2D3组加含8~10 mol/L 1,25(OH)2D3的培养液(含5%胎牛血清DMEM培养基);EGF联合1,25(OH)2D3组加10 μg/L EGF及10-8mol/L 1,25(OH)2D3的培养液(含5%胎牛血清DMEM培养基),均作用48 h后收集细胞。
1.3.3 流式细胞术法检测系膜细胞凋亡 选择对数期细胞,用不含EDTA的胰蛋白酶消化计数后,接种6孔细胞培养板。待细胞贴壁后,用无血清DMEM培养基培养24 h,同步化于G0期,按实验分组加入不同药物处理48 h后,用磷酸盐缓冲液(PBS)洗涤细胞2次(2 000 r/min离心5 min)收集细胞;加入500 μl的1×Buffer悬浮细胞。向各离心管加入5 μl Annexin V溶液混匀后,加入10 μl PI染液混匀,室温避光反应10 min。10 min后,用流式细胞仪检测各组系膜细胞的凋亡,并采图。上述实验重复3次,并计算各组系膜细胞的凋亡率。
1.3.4 Western blotting检测系膜细胞中Caspase-3的表达 选择对数期细胞,胰蛋白酶消化计数后,接种于一次性培养瓶,24 h后细胞贴壁,用无血清DMEM培养基培养24 h,同步化于G0期,按实验分组培养48 h,收集并裂解细胞,13 000×g4 ℃离心25 min,取上清液煮沸10 min使蛋白变性,上样电泳,聚偏二氟乙烯膜(PVDF膜)转膜,5%奶粉封闭,将PVDF膜置于一抗孵育(4 ℃过夜),加入含Tween20的三羟甲基氨基甲烷缓冲液(TBST)中洗涤3×10 min,二抗孵育(室温1 h),TBST洗涤3×10 min,加化学发光底物,暗室曝光。
2 结果
2.1 干预48h后系膜细胞凋亡率的比较 干预48h后,4组系膜细胞凋亡率间差异有统计学意义(F=133.598,P<0.01);与正常对照组比较,EGF组系膜细胞凋亡率降低,1,25(OH)2D3组系膜细胞凋亡率升高(P<0.05);EGF联合1,25(OH)2D3组与正常对照组间差异无统计学意义(P>0.05);与EGF组比较,EGF联合1,25(OH)2D3组系膜细胞凋亡率升高,差异有统计学意义(P<0.05,见表1、图1)。

Table1Comparisonofapoptosisrateofmesangialcellsafter48hoursinterventionineachgroup

组别细胞凋亡率正常对照组31±10 EGF组06±03∗ 1,25(OH)2D3组64±08∗ EGF联合1,25(OH)2D3组35±10▲△
注:与正常对照组比较,*P<0.01;与EGF组比较,▲P<0.01;与正常对照组比较,△P>0.05
2.2 Western blotting检测Caspase-3蛋白表达结果 正常对照组、EGF组、1,25(OH)2D3组和EGF联合1,25(OH)2D3组Caspase-3/β-actin灰度值比值分别为(0.545±0.028)、(0.386±0.007)、(0.772±0.040)、(0.566±0.031),差异有统计学意义(F=88.380,P<0.05)。与正常对照组相比,EGF组系膜细胞Caspase-3表达量降低(P<0.05),1,25(OH)2D3组系膜细胞Caspase-3表达量增高(P<0.05),EGF联合1,25(OH)2D3组系膜细胞Caspase-3表达量与正常对照组间差异无统计学意义(P>0.05);EGF组低于EGF联合1,25(OH)2D3组系膜细胞Caspase-3表达量(P<0.05,见图2)。
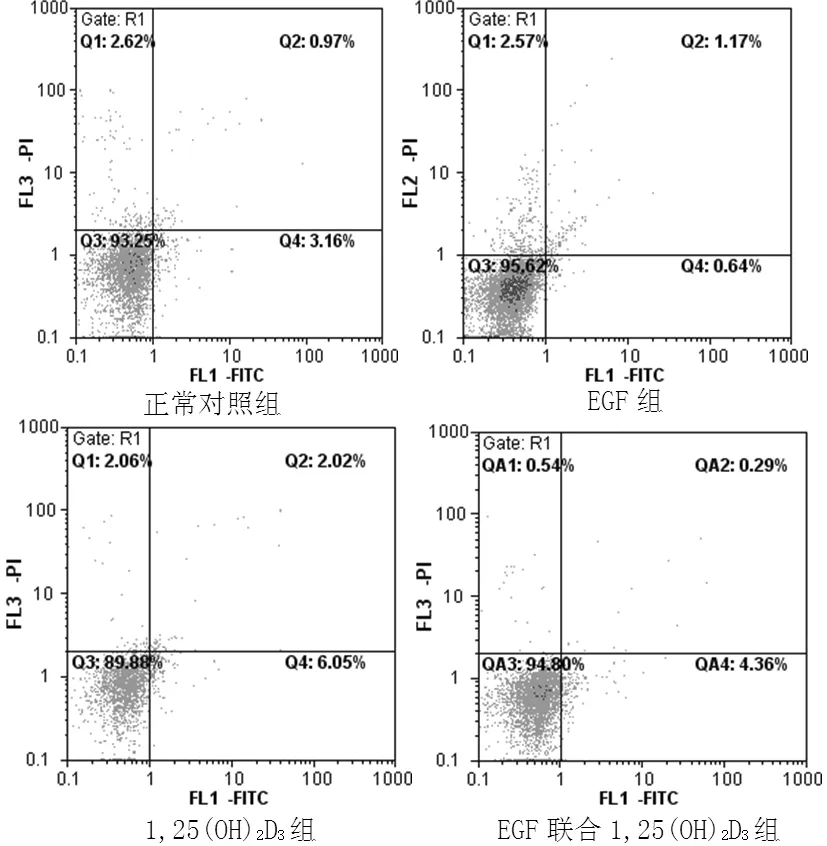
注:以FITC和PI荧光作双参数点图,细胞分为4个区,1区:机械损伤细胞(AnnexinV FITC-/PI+) ;2区:凋亡晚期或坏死细胞(AnnexinV FITC+/PI+); 3区:活细胞(Annexin V FITC-/PI-);4区:早期凋亡细胞(Annexin V FITC+/PI-);计数4区细胞比例为细胞凋亡率
图1 各组干预48 h后系膜细胞凋亡率
Figure 1 Apoptosis rate of mesangial cells after 48 hours intervention in each group
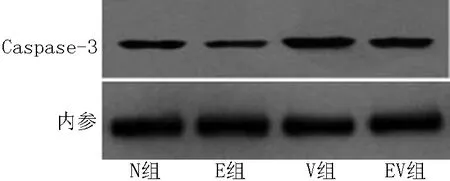
注:N组为正常对照组,E组为EGF组,V组为1,25(OH)2D3组,EV组为EGF联合1,25(OH)2D3组
图2 各组干预48 h后系膜细胞中Caspase-3蛋白的表达
Figure 2 Expression of Caspase-3 of mesangial cells after 48 hours intervention in each group
3 讨论
3.1 1,25(OH)2D3与系膜细胞凋亡 1,25(OH)2D3是一类脂溶性维生素,属于类固醇激素,其经典的生理功能是通过与骨、肠、肾等靶器官细胞内的特异性受体结合,调节机体的钙、磷代谢。近期流行病学资料和实验研究表明,1,25(OH)2D3还具有抑制细胞增殖和诱导细胞凋亡的作用[3-5]。细胞凋亡是指细胞在一定条件下的程序性死亡,细胞凋亡与细胞的增殖分化共同维持细胞群的动态平衡[6]。随着对1,25(OH)2D3研究的深入,其对凋亡的诱导作用越来越多的受到研究者的关注[7]。本课题组既往研究发现:1,25(OH)2D3可以抑制体外培养的大鼠系膜细胞的增殖,诱导系膜细胞凋亡,此作用在48 h时最明显[8]。本研究采用Annexin V/PI双染法流式细胞仪检测各实验组系膜细胞凋亡,结果显示,与正常对照组比较,1,25(OH)2D3组人肾小球系膜细胞48 h后系膜细胞凋亡率增高,提示1,25(OH)2D3可诱导人系膜细胞的凋亡,这一结果与本课题组前期研究结果一致[8]。
3.2 1,25(OH)2D3对系膜细胞中Caspase-3表达的影响 Caspases是一种具有特异天冬氨酸的半胱氨酸蛋白酶,是一组在细胞凋亡过程中发挥关键作用的酶。当细胞受凋亡信号刺激后,凋亡调控分子间的相互作用,Caspases活化,并通过级联放大反应最终诱发细胞凋亡[9]。内在和外在的凋亡途径中均有Caspase-3的表达增高,Caspase-3导致了一些结构和调节蛋白的裂解,从而引起细胞凋亡[10]。国外研究发现,1,25(OH)2D3诱导鳞状细胞癌(SCC)细胞凋亡并诱导该细胞中的Caspase-3的活化,凋亡的发生与蛋白激酶 B(Akt)磷酸化水平降低有关[11]。本研究中,1,25(OH)2D3组人肾小球系膜细胞的Caspase-3表达量较正常组升高,从蛋白水平提示1,25(OH)2D3可能是通过上调Caspase-3的表达而诱导了系膜的细胞凋亡。
3.3 EGF联合1,25(OH)2D3干预对系膜细胞凋亡和Caspase-3表达的影响 一般来说,增生性肾炎早期多表现为肾小球系膜细胞数量增加,而系膜细胞数量又受细胞增殖和细胞凋亡的双重影响。正常肾脏肾小球细胞凋亡率是很低的,但在肾小球肾炎中细胞凋亡明显增加,过度增殖的肾小球系膜细胞可以通过细胞凋亡而被清除[12]。EGF是一种多肽促生长因子,其可以刺激上皮细胞及体内多重类型组织细胞分裂和增殖[13],并且有研究表明EGF可促进系膜细胞增殖[14]。研究发现,经肝素结合表皮生长因子样生长因子前体(ProHB-EGF)转染的大鼠系膜细胞可抑制过氧化氢或氢化可的松诱导的细胞凋亡,并增加了Bcl-2的表达,降低了Caspase-3的释放,证明作为EGF家族成员之一的HB-EGF可以抑制系膜细胞凋亡[15]。本实验拟通过建立EGF诱导系膜细胞增殖微环境,探讨增殖状态下1,25(OH)2D3对系膜细胞的影响,结果显示:与正常对照组相比,EGF组系膜细胞的凋亡率显著降低,Caspase-3表达量显著降低,证明了EGF可能通过下调Caspase-3的表达而抑制了系膜细胞的凋亡;与EGF组比较,EGF联合1,25(OH)2D3组干预人肾小球系膜细胞48 h后,人肾小球系膜细胞的凋亡率显著增高,Caspase-3表达量显著增高,提示1,25(OH)2D3可逆转EGF对系膜细胞凋亡的抑制作用。
综上所述,1,25(OH)2D3可诱导系膜细胞的凋亡,并且可能通过上调Caspase-3蛋白的表达而诱导系膜的细胞凋亡;EGF可能通过下调Caspase-3的表达而抑制系膜细胞的凋亡。1,25(OH)2D3可逆转EGF对系膜细胞凋亡的抑制,但具体作用机制仍不清楚,有待于进一步的研究。
本文创新点:
(1)本文首次探讨了1,25(OH)2D3对人系膜细胞中Caspase-3表达的影响 ,并初步证明1,25(OH)2D3可能是通过上调Caspase-3蛋白的表达而诱导了人系膜细胞的凋亡。
(2)本文建立了EGF诱导人系膜细胞增殖微环境,初步探讨增殖状态下1,25(OH)2D3对人系膜细胞的影响,得出结论:EGF可能通过下调Caspase-3的表达而抑制了人系膜细胞的凋亡,1,25(OH)2D3可逆转EGF对人系膜细胞凋亡的抑制。参考文献
[1]Guan T,Gao Q,Chen P,et al.Effects of polycystin 1 N terminal fragment fusion protein on the proliferation and apoptosis of rat mesangial cells[J].Molecular Medicine Reports,2014,10(3):1626-1634.
[2]Li R,Lou Y,Zhang W,et al.Vitamin D inhibition of lung adenocarcinoma cell proliferation in vitro[J].Tumour Biology,2014,35(11):10953-10958.
[3]Cove-Smith A,Hendry BM.The regulation of mesangial cell proliferation[J].Nephron Experimental Nephrology,2008,108(4):e74-79.
[4]Yang XP,Zhang JP,Zhang CJ,et al.Effects of active vitamin D3in the expression of cell proliferation and apoptosis in mesangial proliferative glomerulonephritis in rats[J].China Pharmacist,2010,13(11):1551-1554.(in Chinese) 杨晓萍,张金平,张春江,等.活性维生素 D3对大鼠系膜增生性肾炎细胞增殖与凋亡的影响[J].中国药师,2010,13(11):1551-1554.
[5]Huang Y,Luo F,Li H,et al.Conditioned medium from alternatively activated macrophages induce mesangial cell apoptosis via the effect of fas[J].Experimental Cell Research,2013,319(19):3051-3057.
[6]Hughes J,Savill JS.Apoptosis in glomerulonephritis[J].Current Opinion in Nephrology and Hypertension,2005,14(4):389-395.
[7]Ma Y,Yu WD,Hidalgo AA,et al.Inecalcitol,an analog of 1,25(OH)2D3,displays enhanced antitumor activity through the induction of apoptosis in a squamous cell carcinoma model system[J].Cell Cycle,2013,12(5):743.
[8]Zhao D,Luo X,Zhang CJ,et al.Effect of 1,25-dihydroxyvitamin D3on the growth of rat glomerular mesangial cells[J].Journal of Clinical and Experimental Medicine,2011,10(7):486-488.(in Chinese) 赵丹,罗星,张春江,等.1,25(OH)2D3对大鼠肾小球系膜细胞凋亡的影响[J].临床和实验医学杂志,2011,10(7):486-488.
[9]MacKenzie SH,Clark AC.Death by caspase dimerization[M]//Protein dimerization and oligomerization in biology.New York:Springer,2012:55-73.
[10]Feinstein-Rotkopf Y,Arama E.Can′t live without them,can live with them:roles of caspases during vital cellular processes[J].Apoptosis,2009,14(8):980-995.
[11]Ma Y,Yu WD,Kong RX,et al.Role of nongenomic activation of phosphatidylinositol 3-kinase/Akt and mitogen-activated protein kinase/extracellular signal-regulated kinase kinase/extracellular signal-regulated kinase 1/2 pathways in 1,25(OH)2D3-mediated apoptosis in squamous cell carcinoma cells[J].Cancer Research,2006,66(16):8131-8138.
[12]Watson S,Cailhier JF,Hughes JF,et al.Apoptosis and glomerulonephritis[J].Apoptosis and Glomerulonephritis,2006,9:188-204.
[13]Master AM,Sen Gupta A.EGF receptor-targeted nanocarriers for enhanced cancer treatment[J].Nanomedicine,2012,7(12):1895-1906.
[14]Kumar D,Bhaskaran M,Alagappan L,et al.Heme oxygenase-1 modulates mesangial cell proliferation by p21waf1 upregulation[J].Renal Failure,2010,32(2):254-258.
[15]Yagi K,Takemura T,Hino S,et al.Promotion of survival and prevention of apoptosis in rat mesangial cells by a membrane-anchored form of heparin-binding EGF-like growth factor[J].Clinical and Experimental Nephrology,2001,5(3):177-185.
(本文编辑:赵跃翠)
Effect of 1,25(OH)2D3on Apoptosis of Human Mesangial Cells and Caspase-3 Expression
ZHANGHao,YINXuan,CHENJian-ping,etal.
MedicalCollegeofShiheziUniversityofXinjiang,Shihezi832000,China
Objective To investigate the effect of 1,25-dihydroxyvitamin D3〔1,25(OH)2D3〕 on apoptosis of human mesangial cells and its mechanism.Methods The mesangial cells cultured in vitro were divided randomly into groups A (normal control group),B〔epidermal growth factor(EGF)group〕,C〔1,25(OH)2D3group〕,D〔combined group of EGF and 1,25(OH)2D3〕.Flow cytometry was used to determine the apoptosis rates,the Western blotting to detect the expression of cysteine proteinase-3 (caspase-3) in 4 groups.Results As compared with group A,the apoptosis rate of mesangial cells decreased,caspase-3 expression reduced in group B(P<0.05),the apoptosis rate of mesangial cells and caspase-3 expression increased in group C(P<0.05).As compared with group B,the apoptosis rate of mesangial cells and caspase-3 expression elevated in group D(P<0.05),there was no significant difference between groups A,D(P>0.05).Conclusion 1,25(OH)2D3may induce the apoptosis of mesangial cells through up-regulating casoase-3 expression.EGF inhibits the apoptosis,1,25(OH)2D3can reverse the inhibition of EGF on mesangial cells.
Human mesangial cells;1,25(OH)2D3;Apoptosis;Caspase-3;Epidermal growth factor
国家自然科学基金资助项目(81160090)
832000新疆石河子市,石河子大学(张昊,尹璇,陈建平,马莉);石河子大学第一附属医院肾病科(张春江,刘春)
刘春,832000新疆石河子市,石河子大学第一附属医院肾病科;E-mail:liuchun1966@163.com
R 346.53
A
10.3969/j.issn.1007-9572.2015.05.013
2014-09-25;
2014-11-25)
