二斑叶螨几丁质酶基因的原核表达及多克隆抗体制备
2015-02-20张道伟张正玲曾燕玲郭玉双
张道伟,陈 静,张正玲,曾燕玲,郭玉双
(1.遵义师范学院生命科学学院/赤水河流域动物资源保护与应用研究重点实验室,贵州 遵义 563002;2.遵义医学院生化与分子生物学教研室,贵州 遵义 563009;3.贵州省烟草科学研究院,贵阳 550083)
二斑叶螨(Tetranychus urticaeKoch),属于叶螨科(Tetranychidae)叶螨属(Tetranychus),是一种分布广泛,寄主种类繁多,食性杂的世界性害螨。其主要危害苹果、柑橘、木薯和花卉等作物,是果园、花卉和温室害螨[1]。1983年在北京首次发现其危害花卉作物以来,此后在山东、河北、重庆、江苏和贵州等地区陆续发现其危害果园和其他作物,局部地区十分严重,甚至难以控制[2-3]。
二斑叶螨世代历期短、繁殖力强、用药次数多、抗药性发展极为迅速。邱立红等研究表明,常规化学农药如有机磷类和拟除虫菊酯类农药对二斑叶螨防治效果不理想[4-5]。需要新型环保治理措施。
几丁质又称甲壳素、甲壳质,是由2-乙酰氨基-2-脱氧-D-吡喃葡萄糖苷通过β-1,4-糖苷键连接形成的一种多糖类生物高分子,广泛存在于自然界的一种结构类多糖生物高分子。在进化过程中,昆虫利用几丁质的刚性和化学稳定性,形成其细胞外骨架如外表皮和中肠内壁的围食膜结构(Peritrophic membrane,PM),保护昆虫在生长、移动、呼吸和外界交流过程中免受环境中各种伤害[6]。几丁质约占昆虫蜕皮干物质的40%[7]。由于其独特结构和在昆虫生长过程中重要作用,高等动物和植物中均不含几丁质,通过干扰几丁质的合成和降解,是新型农药研究的热点。几丁质酶(EC3.2.1.14)是降解几丁质的主要酶类之一,在自然界存在范围极为广泛。在昆虫中主要功能是周期性褪去旧表皮过程中降解几丁质。蜱螨纲物种作为节肢动物的一大类群,除没有化蛹阶段,其具有和昆虫相似的生长发育历程(卵、若螨、幼螨、成螨),同样需要周期性褪去几丁质外壳并形成新表皮,但对蜱螨的蜕皮机制国内外研究比较薄弱。目前对螨类几丁质酶研究甚少,对利用几丁质酶调控农业害螨的机理研究处于空白。对二斑叶螨几丁质酶加以研究,有助于深入了解该害螨的几丁质代谢机制,为将来利用几丁质酶作为靶标基因进行二斑叶螨防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试材料
二斑叶螨(T.urticae)由贵州大学昆虫研究所金道超教授馈赠,在实验室饲养多代种群,样品收集过程参考胡展育等方法[8],采用直径为12 cm培养皿饲养二斑叶螨,在培养皿内放入约1 cm厚海棉块,上面放1张薄膜,在薄膜上放1张平展的四季豆叶片,叶背向上,四周用棉条圈住,使叶片面积约为20 cm,皿内保持浅水层以防叶片失水、干枯和幼、若螨逃逸。培养条件为温度(25±1)℃、光照16 h的人工气候箱。
1.1.2 试剂
AMV(Reverse transcriptase XL)、Oligo d(T)18、Ribonuclease Inhibitor、 DNA MarkerDL2000、pMD18-T载体、限制性内切酶BamHⅠ、XhoⅠ、T4DNA连接酶、DNA Marker DL2 000、pMD18-T载体均购自TaKaRa公司;预染Marker、His单抗、NBT-BCIP显色液购自武汉博士德公司、氨苄霉素(Ampicillin)、IPTG、牛血清白蛋白(BSA)、Ⅱ抗(IGg-AP)蛋白质、SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)所需试剂如丙烯酰胺、N,N'-甲叉双丙烯酰胺、十二烷基硫酸钠(SDS)、Tris缓冲液、TEMED(N,N,N',N'-四甲基乙二胺)、过硫酸铵(AP)等购自北京索莱宝试剂公司。PCR扩增试剂和蛋白Marker购自全式金生物公司;Tween-20购自Amresco公司;提取总RNA所用Trizol试剂购自上海Invitrogen公司。
1.2 方法
1.2.1 引物的设计与合成
根据此前克隆的二斑叶螨几丁质酶全长基因序列(GenBank序列号,AEZ36152)设计一对引物,序列如下:Tuchi-F:5'TACGGATCCTTTGTCAC TTCGGT CGTCTC 3'(BamHⅠ);
Tuchi-R:5'TCTCTCGAGGCCGCAAACACCAT TAACAT 3'(XhoⅠ)。
引物由上海英骏公司合成,在Tuchi-F和Tuchi-R中分别设计BamHⅠ和XhoⅠ酶切位点(划线部分)。
1.2.2 总RNA的提取与cDNA合成
RNA提取过程参考文献[9],取新鲜二斑叶螨置于无RNase研钵中,加入液氮,迅速进行研磨至粉末状;用移液器加入0.5 mL Trizol于研钵中,继续研磨;待研钵中的固态物融化后,将其用移液器转移至1.5 mL Eppendorf管中,用力振荡15 s,室温静置5 min;加入0.1 mL氯仿,混合后静置5 min,4℃,12 000 g离心15 min;小心取上清液移入1个新Eppendorf管中,再加入0.25 mL异丙醇,室温静置10 min,然后于4℃,12 000 g离心10 min;倒掉上清后,加入0.5 mL 75%乙醇洗涤沉淀,4℃,7 500 g离心5 min,弃掉上清液;将EP管倒置在超净工作台10~15 min,加入30 μL经过DEPC处理过的去离子水中,将所获RNA用凝胶电泳和分光光度计检测浓度和纯度。在总体积为25 μL的Eppendorf管中依次加入 1 μg二斑叶螨总RNA,2 μL Oligo d(T)18,5 μL的5×AMV buffer,2 μL dNTP(10 mmol· L-1),0.5 μL的AMV RNase,补充DEPC处理水到25 μL,在42℃水浴中保温1.5 h后,95℃放置10 min灭活AMV RNase,即获得cDNA。
1.2.3基因克隆及表达载体构建
以反转录合成的cDNA为模板,以Tuchi-F和Tuchi-R为引物进行扩增。PCR反应体系为25 μL:10×Buffer 2.5 μL,dNTP(各2.5 mmol·L-1)1 μL,上下游引物各 1 μL,cDNA 1 μL,TaqDNA 聚合酶0.2 μL,补充双灭菌蒸馏水至25 μL。PCR扩增按如下条件进行:94℃预变性5 min,94℃变性30 s,55℃复性30 s,72℃延伸60 s,35个循环,最后72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳,割胶回收、纯化按DNA回收试剂盒说明书进行。经纯化回收后的PCR产物与pMD18-T载体连接,转化大肠杆菌,通过蓝白斑筛选,挑取阳性克隆,BamHⅠ和XhoⅠ双酶切鉴定后测序。
经鉴定的阳性克隆过夜摇菌后提取质粒DNA,经BamHⅠ和XhoⅠ双酶切后回收目的基因片段,分别与用相同内切酶双酶切的pET-32a(+)表达载体连接,转化大肠杆菌BL21(DE3)感受态细胞,BamHⅠ和HindⅢ双酶切鉴定。验证正确后获得重组表达菌pET-32a-TuChi。
1.2.4 融合蛋白诱导表达条件的优化及Western Blot鉴定
将鉴定正确的表达菌转接到含有Amp抗性LB液体培养基中37℃过夜培养。过夜培养的菌液以1∶100体积比转接至新的培养基中培养,37℃,220 r·min-1培养振摇至OD600=0.5。加入IPTG使其终浓度分别为 0.4、0.6、0.8 mmol·L-1,30 ℃,220 r·min-1诱导表达2、4、6 h后分别取样,经10%SDS-PAGE电泳,考马斯亮蓝染色分析,确定最佳诱导表达时间。
以优化的条件诱导表达菌表达,菌体经10%SDS-PAGE后,半干法转印至硝酸纤维素膜,以多克隆抗体为一抗,以辣根过氧化物酶(HRP)标记的羊抗兔IgG为二抗进行Western Blot鉴定。
1.2.5 表达蛋白纯化及多克隆抗体制备
以优化的诱导条件诱导获得100 mL菌液,超声波破碎后离心,收集含有融合表达蛋白的上清。用Ni+柱纯化融合蛋白,将纯化的融合蛋白与弗氏完全佐剂按1∶1体积比充分乳化后,皮下多点注射新西兰大白兔。免疫前,从兔耳抽取血样,作为阴性对照。初次免疫后,每10 d使用弗氏不完全佐剂加强免疫1次,共3次。末次免疫后1周采血,分离血清,-70℃保存。
1.2.6 anti-Tuchi抗血清效价检测
以纯化的融合蛋白(100 g·孔-1)包被酶联板,分别以不同稀释倍数的免疫前兔血清(阴性对照)和免疫后兔血清作为一抗,用间接ELISA法测定多克隆抗体的效价。
2 结果与分析
2.1 重组表达载体的构建
以反转录的cDNA为模板,经PCR扩增得到约800 bp的条带(见图1),与目的片段长度相近。PCR产物与pMD18-T载体连接后转化大肠杆菌,挑取阳性克隆送测序,结果显示含有双酶切位点以及目的基因序列共804 bp,该序列与登录到Gen⁃Bank上二斑叶螨几丁质酶基因序列保持一致。通过BamHⅠ和XhoⅠ双酶切,将目的片段克隆至pET-32a(+)载体上,转化后获得的重组质粒经双酶切(见图2)和测序检验,序列与目的片段吻合。
2.2 诱导表达条件优化及重组蛋白纯化
以不同终浓度IPTG诱导含有重组质粒的菌株,表达2、4和6 h后分别取样,经10%SDSPAGE分析表明,含pET-32a-TuChi重组质粒的菌株大量表达分子质量约45 ku的外源蛋白,当IPTG终浓度为0.6 mmol·L-1,表达4 h后的目的条带表达量达到最高值,表达6 h后重组蛋白量并不随时间延长而增加(见图3A),因此确定最佳表达时间为4 h的重组蛋白。按照材料方法所述,将所得蛋白粗提液过Ni柱纯化。经SDS-PAGE电泳检测结果如图3B所示,咪唑洗脱液中含有大量目的蛋白,且纯度很高;随着洗脱步骤的增加,洗脱的目的蛋白含量很低。
2.3 His单克隆抗体分析纯化的重组蛋白
为进一步确认表达出来的重组蛋白是带有His标签的目的蛋白,对表达纯化出来的蛋白进行His单克隆抗体分析,Western Blot分析结果如图4所示。由图4可知,纯化出来的蛋白具有单一的结合条带,表明表达纯化出来的蛋白是所需目的重组蛋白。
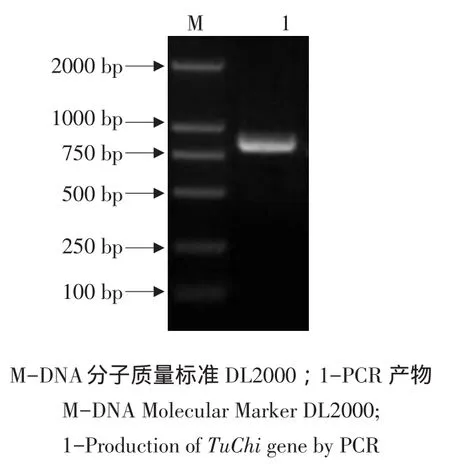
图1 二斑叶螨 TuChi基因PCR扩增结果电泳分析Fig.1 Electrophoresis of PCR products of TuChi gene
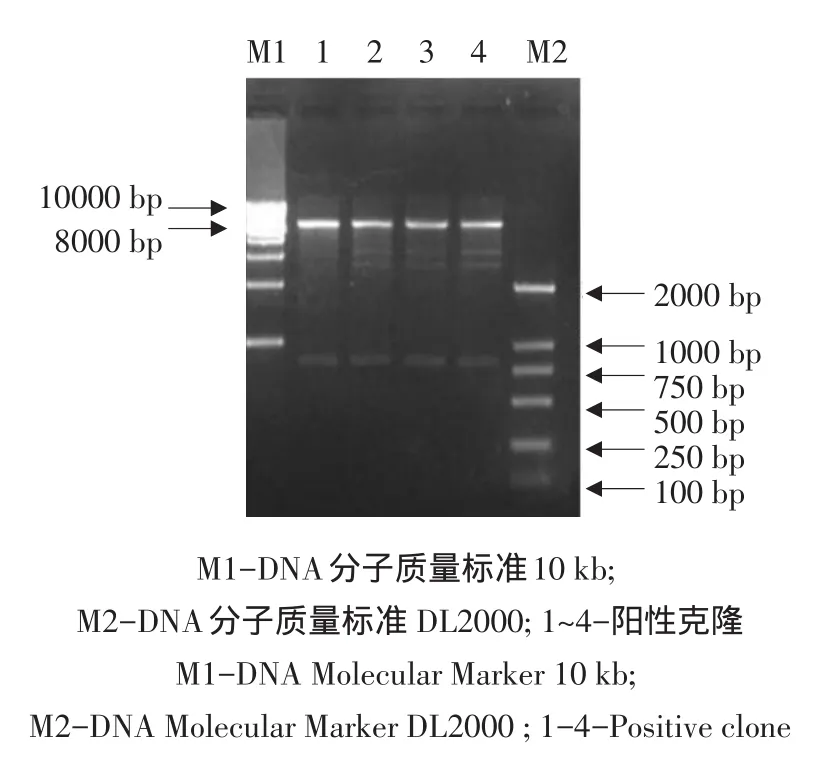
图2 Bam HⅠ、 Xho I双酶切鉴定pET-32a- TuChi Fig.2 Digestion of pET-32a- TuChi
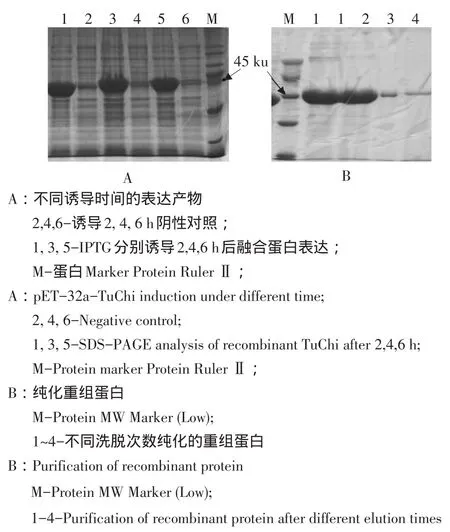
图3 pET-32a-TuChi不同诱导时间下融合蛋白表达产物和重组蛋白纯化Fig.3 pET-32a-TuChi induction under different time and purification of recombinant protein
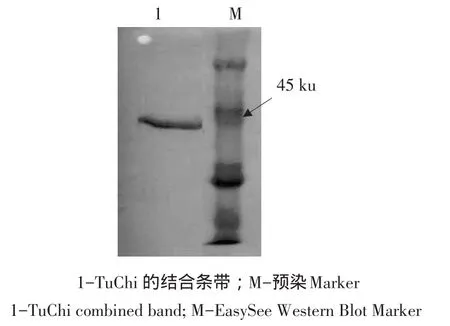
图4 His单克隆抗体分析杂交Western Blot分析Fig.4 Analysis of Western Blot by His momoclonal antibody
2.4 抗血清的效价检测及特异性分析
将重组蛋白TuChi作为抗原,用间接ELISA法测定多抗效价。多克隆抗体第1次稀释1 000倍,以后采用倍比稀释法,当稀释到80 000倍时,待检血清OD值明显大于阴性对照OD值的2倍,而且阴性对照无明显梯度。表明MBP-TuChi蛋白对anti-TuChi多克隆抗体具有很好的免疫原性,抗体效价anti-Tuchi>80 000。
对抗体的特异性分析采用Western Blot方法,将纯化后的抗体按1:1 000稀释分别检测二斑叶螨总蛋白和含pET-32a空载体的细菌总蛋白。结果如图5所示,获得的anti-Tuchi多克隆抗体能够特异性识别二斑叶螨总蛋白中的几丁质酶,而对照蛋白(细菌)不能与其结合显色。
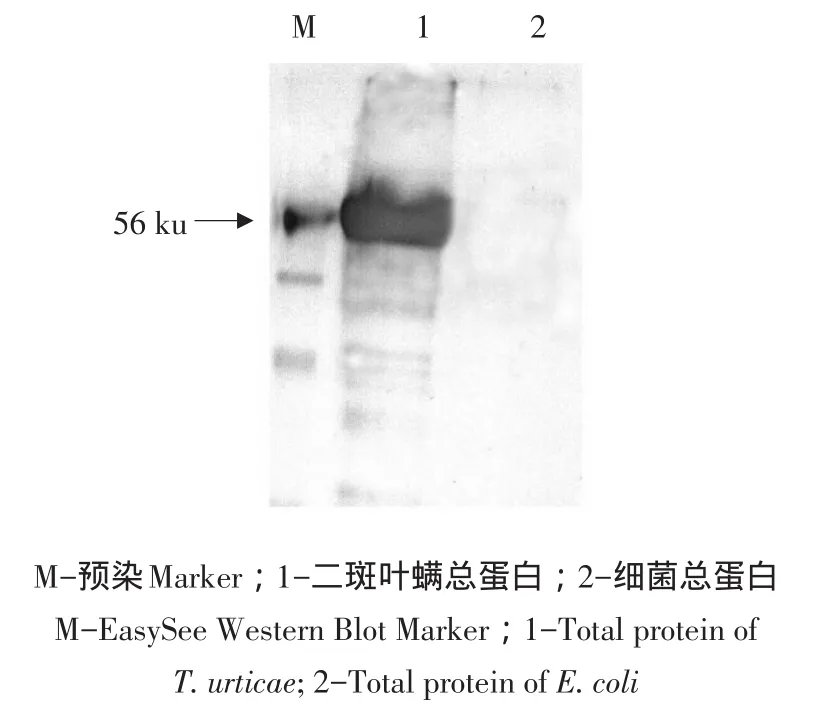
图5 Western Blot分析二斑叶螨几丁质酶抗体的特异性Fig.5 Western Blot analysis of the specificity of the Tuchi antibody
3 讨论与结论
昆虫及蜱螨类周期性蜕去旧表皮并合成新表皮,这一复杂的过程是由旧表皮和新表皮之间蜕皮液中的几丁质酶精确滴度调节[7]。在蜕皮阶段,几丁质酶表达量高,易从昆虫旧表皮和新表皮之间的蜕皮液中间纯化出来。Kramer等首次从烟草天蛾(Manduca sexta)中克隆出全长的几丁质酶基因cDNA序列,已有多个编码几丁质酶基因的cDNA序列从昆虫不同目的多个物种中被分离,如烟草天蛾(Manduca sexta)[10]、家蚕(Bombyx mori)[11]、双翅目如埃及伊蚊(Aedes aegypti)[12]、冈比亚按蚊(Anopheles gambiae)[13]鞘翅目如黄粉虫和辣根猿叶甲(Phaedon cochleariae)[14];膜翅目如甲腹茧蜂(Che⁃lonussp.)[15]。随着基因组测序技术发展,几丁质酶研究已进入基因家族功能阶段[16]。目前对螨类中几丁质酶在其生长发育过程中的研究尚处于起步阶段。
为获得特异性好且效价高的Tuchi多克隆抗体,本研究采用pET-32a载体。pET-32a载体不仅提供更多的纯化标签如His标签,Trx标签和S标签供选择;添加1个小分子的伴侣蛋白可极大提高融合蛋白的表达效率。本研究中表达的重组蛋白Tu⁃chi在IPTG诱导4 h即达到最大表达量,全部以可溶性蛋白而非包涵体形式存在,减少重组蛋白是包涵体纯化过程中的变性、复性等复杂处理步骤。为获得可溶性的融合蛋白,需选择合适载体、诱导温度、IPTG浓度以及诱导时间等以确定最适宜表达条件。Anti-Tuchi最佳诱导条件是在37℃下,0.6 mmol·L-1IPTG,诱导4 h,可使重组蛋白Tuchi在上清表达。
本研究对二斑叶螨几丁质酶基因进行高效表达,以亲和色谱纯化的融合表达蛋白免疫新西兰大白兔制备anti-TuChi多克隆抗体,抗体效价大于80 000。为保证所获anti-Tuchi抗体能够用于下一步试验,对抗体的特异性进行分析。从获得的an⁃ti-Tuchi在与二斑叶螨总蛋白Western Blot分析中,可看到明显的结合条带,但在条带下方还有一些非特异性结合条带。原因为:①总蛋白存在部分降解。二斑叶螨总蛋白提取过程中,超声破碎时间过长,温度升高导致蛋白降解;或在Western Blot转膜过程中电流过大导致温度过高致使部分蛋白降解。②多个昆虫物种基因组测序工作已完成,发现昆虫中几丁质酶是一个基因家族,其成员有16~18个成员不等[16-17]。本研究获得的anti-Tuchi抗体能否识别基因家族的其他成员尚不清楚,有待后续研究进一步证实。
总之,该多抗的制备为检测TuChi基因在二斑叶螨体内表达的时空分布和表达量提供有效手段,为深入研究二斑叶螨TuChi基因及未知几丁质酶的功能鉴定提供材料。Anti-TuChi多抗制备,为深入研究二斑叶螨蜕皮过程机理奠定基础,为未来害虫防治提供新思路。
[1]蔡双虎,程立生.二斑叶螨的研究进展[J].热带农业科学,2003(9):68-74.
[2]甘丽萍,张新虎.二斑叶螨实验种群生物学特性的研究[J].西北农业学报,2004(13):66-69.
[3]刘庆娟,于毅,刘永杰,等.二斑叶螨的发生与防治研究进展[J].山东农业科学,2011(9):99-101.
[4]邱立红,张文吉.害虫及螨对阿维菌素(Avermectins)的抗药性发展及治理策略探讨[J].中国农业大学学报,1999(4):43-48.
[5]张志刚,沈慧敏,段辛乐,等.二斑叶螨对螺螨酯抗药性及对18种杀螨剂交互抗性[J].植物保护,2011,37:82-85.
[6]Arakane Y,Muthukrishnan S.Insect chitinase and chitinase-like proteins[J].Cell Mol Life Sci,2009,67(2):201-216.
[7]Merzendorfer H,Zimoch L.Chitin metabolism in insects:struc⁃ture,function and regulation of chitin synthases and chitinases[J].J Exp Biol,2003,206:4393-4412.
[8]胡展育,郅军锐,熊继文.二斑叶螨的实验种群密度研究[J].贵州农业科学,2005,33(3):16-18.
[9]陈静,张建华,郭玉双,等.白背飞虱海藻糖酶Treh-2基因克隆及生物信息学分析[J].东北农业大学学报,2013,44(6):112-117.
[10]Kramer K J,Corpuz L,Choi,et al.Sequence of a cDNA and ex⁃pression of the gene encoding epidermal and gut chitinases ofManduca sexta[J].Insect Biochem Mol Biol,1993,23:691-701.
[11]Abdel-Banat B M,Koga D A.Genomic clone for a chitinase gene from the silkworm,Bombyx mori:Structural organization identi⁃fies functional motifs[J].Insect Biochem Mol Biol,2001,31:497-508.
[12]De La Vega H,Specht C A,Liu Y.et al.Chitinases are a multigene family inAedes,Anopheles and Drosophila[J].Insect Mol Biol,1998(7):233-239.
[13]Shen Z,Jacobs-Lorena M.Characterization of a novel gut-specif⁃ic chitinase gene from the human malaria vectorAnopheles gambi⁃ae[J].J Biol Chem,1997,272:28895-28900.
[14]Girard C,Jouanin L.Molecular cloning of a gut-specific chitinase cDNA from the beetlePhaedon cochleariae[J].Insect Biochem Mol Bio,1999,29:549-556.
[15]Krishnan A,Nair P N,Jones D.Isolation,cloning,and character⁃ization of new chitinase stored in active form in chitin-lined ven⁃om reservoir[J].J Biol Chem,1994,269:20971-20976.
[16]Zhu Q,Arakane Y,Banerjee D,et al.Domain organization and phylogenetic analysis of the chitinase-like family of proteins in three species of insects[J].Insect Biochem Mol Biol,2008,38:452-466.
[17]Zhu Q,Arakane Y,Beeman R W,et al.Characterization of recom⁃binant chitinase-like proteins ofDrosophilamelanogaster andTri⁃boliumcastaneum[J].Insect Biochem Mol Biol,2008,38:467-477.
