局部注射淫羊藿苷对大鼠正畸致炎性牙根吸收的影响
2015-02-18周艳妮袁学顺岳子琪曹宝成
周艳妮,袁学顺,岳子琪,曹宝成
(1.兰州大学口腔医学院正畸科,甘肃兰州 730000;2.武警甘肃总队医院口腔科,甘肃兰州 730050)
正畸致炎性牙根吸收[1](orthodontically induced inflammatory root resorption,OIIRR)是由于正畸力对牙骨质的作用超过了其自身修复能力,多核破牙骨质细胞侵袭牙根表面,形成吸收陷窝所致。研究认为破牙骨质细胞在形态和功能上与破骨细胞相似[2]。淫羊藿作为补肾中药之一,可抑制破骨细胞的分化和成熟[3-4]。因此,本研究选择淫羊藿苷,观察其对大鼠正畸致牙根吸收是否存在治疗作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 28只8周龄雄性SD大鼠(甘肃省中医学院动物实验中心提供),体质量(200±10)g,动物合格证号:SYXK(甘)2011-0001号。
1.1.2 实验药物 淫羊藿苷购自中国药品生物制品检定所,批号:110737-200415(纯度>99%)。
1.1.3 主要试剂和仪器 TRAP试剂盒购自美国Sigma公司。恒温箱(北京福意联责任有限公司);场发射扫描电子显微镜(日本日立公司);离子溅射仪(美国EMS公司);Mimics图像分析软件10.0(比利时Materialise公司);切片机、自动脱水机、石蜡包埋机(德国徕卡公司);双目光学显微镜(宁波舜宇公司);照相系统(重庆奥特公司)。
1.2 方法
1.2.1 造模方法 参照LEIKER等[5]方法建立模型(图1)。在28只大鼠的双侧上前牙唇、舌、远中三面和右侧第一磨牙近远中面,用低速打磨机磨出0.2mm深凹槽。用结扎丝将镍钛拉簧固定在上颌右侧第一磨牙的近中颊侧,使用正畸测力计测定50g的拉力,将拉簧的另一端固定于上切牙凹槽内,后用牙釉质粘结剂粘结切牙牙面和结扎丝,表面打磨抛光。
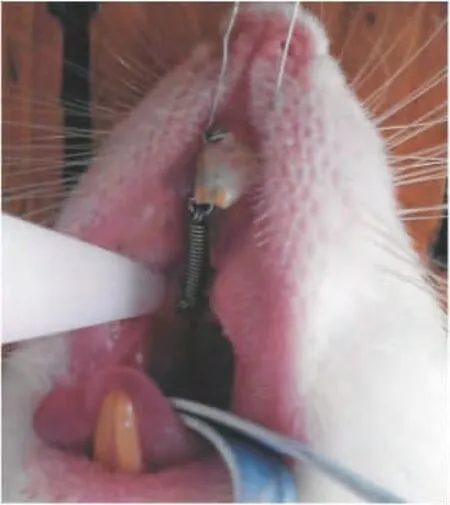
图1 大鼠正畸牙移动模型Fig.1 Rat models of orthodontic root movement
1.2.2 动物分组和给药方法 将28只大鼠按随机原则分为3组。淫羊藿苷组:14只大鼠右侧上颌放置矫治器,并于当天开始,每隔3d于右侧上颌第一磨牙颊侧按200mg/kg注射淫羊藿苷0.05mL;阳性对照组:14只大鼠右侧上颌放置矫治器,每隔3d于右侧上颌第一磨牙颊侧注射等量生理盐水0.05mL;阴性对照组:所有大鼠的左侧上颌磨牙与上颌切牙间,既不安放矫治器也不注射任何药物。
1.2.3 观察牙根表面吸收陷窝 实验第14天,淫羊藿苷组和阳性对照组随机取7只大鼠,断颈处死,分离双侧上颌第一磨牙。将标本自然风干24h。钯金喷涂样品(厚度50nm),场发射扫描电子显微镜观察各组第一磨牙近中根的近中面。按照牙根吸收陷窝分为的3种分类[5]:孤立的小陷窝;广而浅的陷窝;深及牙本质的陷窝。用Mimics图像软件计算各组吸收陷窝面积及吸收陷窝率。牙根吸收陷窝率=3类陷窝面积总和/牙根面积×100%。
1.2.4 牙周组织形态观察 淫羊藿苷组和阳性对照组取另7只大鼠,在实验第14天,通过中性甲醛心脏灌注后,取双侧上颌第一磨牙及其周围牙槽骨的组织块,固定24h,100g/L乙二胺四乙酸(EDTA)脱钙10周,脱水、包埋。沿牙体长轴,按近远中方向连续切片5张,每张切片厚度4μm,进行苏木精-伊红(HE)染色和抗酒石酸酸性磷酸酶(TRAP)染色。100倍镜下观察上颌第一磨牙近中根受压侧的牙周组织变化;400倍镜下观察牙周组织内多核破骨和破牙骨质细胞。TRAP阳性细胞计数:在400倍镜下,于上颌第一磨牙近中根近中侧根中1/3牙周组织内,随机选择5个视野,进行TRAP阳性细胞计数。
1.3 统计学分析 采用SPSS 17.0统计分析软件,对各组吸收陷窝率用进行χ2检验;对TRAP阳性细胞数进行组间单因素方差分析(ANOVA)检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 大鼠上颌第一磨牙近中根SEM观察 阴性对照组:牙根表面光滑均匀;阳性对照组:牙根表面吸收陷窝多为广而浅的陷窝和深及牙本质的陷窝,且吸收陷窝面积大;淫羊藿苷组:牙根表面吸收陷窝多为孤立的小陷窝,吸收陷窝少于阳性对照组(图2)。

图2 各组大鼠上颌第一磨牙的SEM图像Fig.2 The SEM image of rat maxillary first molar in the three groups
Mimics 10.0测量牙根吸收陷窝率,阴性对照组为0.07%,阳性对照组为24.03%,淫羊藿苷组为2.51%。阴-阳性组间和阳-淫羊藿苷组间有统计学差异(P<0.05),阴-淫羊藿苷组间没有统计学差异(P>0.05,表1)。
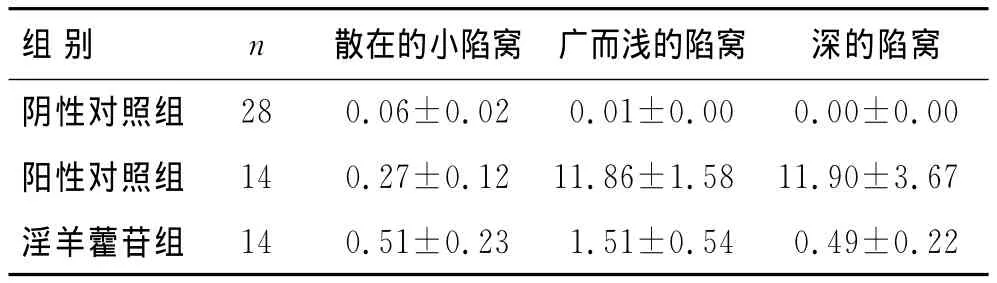
表1 3组各类吸收陷窝面积的比较Tab.1 Comparison of lacuna area absorption of various types in the three groups (mm2)
2.2 大鼠上颌第一磨牙近中根的近中面HE染色100倍镜下:阴性对照组牙骨质表面少见吸收陷窝,近中侧牙周膜均匀。阳性对照组牙骨质层连续性破坏,吸收陷窝较多,且多在受压侧根中1/3处;受压侧牙周膜变窄,出现透明区,牙槽骨吸收呈不规则形态。淫羊藿苷组:牙骨质和牙槽骨的吸收陷窝少于阳性对照组;牙周膜少见透明区。400倍镜下:阴性对照组的牙周组织内罕见多核细胞。阳性对照组牙根表面的吸收陷窝和浅掘性吸收陷窝内,有一定数量的多核破牙骨质细胞,牙槽骨内有大量的多核破骨细胞。淫羊藿苷组牙周组织内多核细胞数量少于阳性对照组(图3)。
2.3 TRAP染色大鼠上颌第一磨牙近中根的近中面TRAP染色用于确定破骨细胞和破牙骨质细胞,受压侧牙根表面的破牙骨质细胞和牙槽骨内的破骨细胞均为TRAP阳性细胞。400倍镜:阴性对照组鲜见TRAP染色阳性细胞;淫羊藿苷组和阳性对照组的牙槽骨内TRAP阳性明显多于牙根表面。淫羊藿苷组的TRAP阳性细胞数显著少于阳性对照组(图4)。各组间TRAP阳性细胞数:阴性对照组为0.6±0.3,阳性对照组为8.0±3.8,淫羊藿苷组为4.2±3.2,各组间均有统计学差异(P<0.05)。

图3 各组上颌第一磨牙近中根HE染色的病理学改变Fig.3 Pathological changes of maxillary first molar root HE staining in the three groups

图4 各组上颌第一磨牙近中根TRAP染色的病理学改变Fig.4 Pathological changes of maxillary first molar root TRAP staining in the three groups(×400)
3 讨 论
OIIRR是正畸治疗常见的并发症之一,其较高的发生率以及对正畸疗效的不良影响引起了学者们的广泛关注。OIIRR发生机制为在矫治力作用下,压力侧局部组织发生变性、坏死。正畸牙移动造成无菌性炎症,这些无菌性坏死组织产生的信号会激活坏死区的清除活动。最先的是透明区外周的组织,在清除透明区时,表面覆盖着类牙骨质的牙骨质细胞层受损,使牙根表面下矿化牙骨质暴露。
以往针对中药作用的动物实验多采用的是灌胃法[7]。本研究考虑到在口腔治疗中,局部注射法局部血药浓度高且较为便捷,因此根据大鼠灌胃剂量[8],确定本实验剂量为200mg/kg。
目前在OIIRR的治疗方面,研究的药物多为西药,其中以治疗骨质疏松药物双磷酸盐类居多[9-11]。该药可和骨质羟基磷灰石紧密结合,抑制骨吸收;可激活钙化组织,选择性的内化参与骨吸收的破骨细胞[12],破骨细胞失去骨吸收能力,出现细胞凋亡,从而抑制OIIRR。淫羊藿也是一种治疗骨质疏松的常用中药,对骨髓系统的作用有以下几方面:①可上调BMP-2(骨形成蛋白-2)、BMP-4(骨形成蛋白-4)和Cbfα1(成骨细胞核心结合因子α1)基因的表达从而促进成骨细胞分化[13-14];②可使破骨细胞β-肌动蛋白mRNA的表达量明显下调,抑制破骨细胞β-肌动蛋白的产生,进而干扰破骨细胞细胞骨架的形成和移动、粘附等功能,抑制破骨细胞的生成及骨吸收功能[15];③ 可明显抑制 RANKmRNA 的表达,下调RANK的表达,作用于RANK介导的核因子-κB信号转导通路,抑制破骨细胞分化成熟及骨吸收功能[4];④可使破骨细胞生成数量均明显减少,破骨细胞的凋亡率增加,骨吸收陷窝数目、面积均有减少,并具有剂量依赖性[16];⑤可下调体外培养破骨细胞MMP-9mRNA的表达,而MMP-9是参与破骨细胞骨吸收的重要蛋白酶[17]。基于以上依据,本实验通过局部注射淫羊藿苷,探讨其对正畸致炎性牙根吸收的影响。
在OIIRR动物实验中,用SEM观察离体牙仍然是客观而可靠的。OIIRR的吸收陷窝分为3类[6]:①散在的小陷窝,可能是单个细胞活动造成,或是单核细胞向巨噬细胞和/或纤维细胞聚集的结果[6],正常牙根表面的小吸收陷窝,是近牙槽骨骨皮质的牙周膜和牙根表面间歇性受损引起的[18];②广而浅的陷窝;③深及牙本质的陷窝,是巨噬细胞样细胞吸收牙根表面,通过分泌破骨细胞活化因子和前列腺素等物质,吸引和激活具有较高的吞噬能力的碎屑细胞。碎屑细胞会很快侵犯暴露的矿化牙齿组织。虽然SEM可以清楚地观察牙根表面的吸收情况,但在吸收深度上只能观察牙骨质最多到牙本质层,而且样品在做SEM前,要去除牙根周围的软组织,为判明牙周软组织和吸收陷窝内的细胞类型,还需用组织切片染色法。坏死组织的清除、邻近的牙根表层组织的吸收或是机械力直接损伤牙根表层,使其下方高度矿化的牙骨质暴露[19]。同时,破牙骨质细胞以胞吐方式排出酸性水解酶,降解胶原性和非胶原性有机质,已被破坏的根面将吸引更多的破牙骨质细胞进行根吸收活动。至此牙骨质的矿物质和有机质降解,形成吸收陷窝[20]。淫羊藿苷组HE染色示,牙根表面吸收陷窝较阳性对照组少,牙周组织的透明变性区也较少,说明淫羊藿苷减缓了牙根吸收的进程。TRAP是破骨细胞的特异性标志酶,可形成不溶性红色沉淀于破骨细胞的细胞浆内,有助于了解生理和病理条件下的骨代谢状况。本实验结果显示,TRAP阳性细胞在牙槽骨处多于牙根表面,表明牙槽骨吸收较牙根更快。阴性对照组TRAP阳性细胞很少,说明在生理状态下,大鼠上颌第一磨牙内可见少量破骨细胞活动,但罕见破牙骨质细胞。这可能与牙骨质表面覆盖类牙骨质层,该层可不断沉积,很少被破牙骨质细胞吸收并可延迟吸收进程。淫羊藿苷组TRAP阳性细胞数明显少于阳性对照组,说明淫羊藿苷减少了受压侧牙周组织内的破骨和破牙骨质细胞,这与HE染色观察结果相一致。
本实验结果表明,局部注射淫羊藿苷有利于抑制正畸致炎性牙根吸收的发生,但同时淫羊藿苷与其他具有相同作用的药物一样,也会轻度减少正畸牙齿的移动量[9,19]。同时面对正畸诊疗主体的青少年,淫羊藿是否会影响其正常发育,相关研究较少。因此,如何克服淫羊藿对牙齿正常移动量的不利影响以及是否存在安全性的问题还需要进一步探讨。
[1]KILLIANY DM.Root resorption caused by orthodontic treatment:An evidence-based review[J].Semin Orthod,1999,5:128-133.
[2]OSHIRO T,SHIBASAKI Y,MARTIN TJ,et al.Immunolocalization of vacuolar-type H+-ATPase,cathepsin K,matrix metalloproteinase-9,and receptor activator of NF kappaB ligand in odontoclasts during physiological root resorption of human deciduous teeth[J].Anat Rec,2001,264(3):305-311.
[3]张秀珍,杨黎娟.淫羊藿苷对大鼠成骨细胞护骨素、RANKL表达的影响[J].中华内分泌与代谢杂志,2006,22(3):222-225.
[4]仙灵骨葆胶囊预防激素性股骨头坏死43例[J].郑州大学学报:医学版,2011,46(2):289-291.
[5]LEIKER BJ,NANDA RS,CURRIER GF,et al.The effects of exogenous prostaglandins on orthodontic tooth movement in rats[J].Am J Orthod Dentofacial Orthop,1995,108(4):380-388.
[6]MAVRAGANI M,AMUNDSEN OC,SELLISETH NJ,et al.Early root alterations after orthodontic force application studied by light and scanning electron microscopy[J].Eur J Orthod,2004,26:119-128.
[7]WU JF,DU J,XU CQ,et al.Icariin attenuates socialdefeatinduced down-regulation of glucocorticoid receptor in mice[J].Pharmacol Biochem Behav,2011,98:273-278.
[8]谢瑾玉,董竞成,崔焱.淫羊藿对哮喘大鼠肺组织RANTES及MCP-3表达的影响[J].中国中西医结合杂志,2008,28(3):238-243.
[9]FUJIMURA YJ,KITAURA H,YOSHIMATSU M,et al.Influence of bisphosphonates on orthodontic tooth movement in mice[J].Eur J Orthod,2009,31:572-577.
[10]CHOI J,BAEK SH,LEE JI,et al.Effects of clodronate on early alveolar bone remodeling and root resorption related to orthodontic forces:A histomorphometric analysis[J].Am J Orthod,2010,138:548.e1-e8.
[11]PUTRANTO R,OBA Y,KANEKO K,et al.Effects of bisphosphonates on root resorption and cytokine expression during experimental tooth movement in rats[J].Orthodontic Waves,2008,69:141-149.
[12]FRITH JC,MONKKONEN J,Auriola S,et al.The molecular mechanism of action of the antiresorptive and antiinflammatory drug clodronate:evidence for the formation in vivo of a metabolite that inhibits bone resorption and causes osteoclast and macrophage apoptosis[J].Arthritis and Rheumatism,2001,44:2201-2210.
[13]何伟,李自力,崔元璐,等.淫羊藿苷对大鼠成骨细胞核结合因子α1、骨形成蛋白-2、骨形成蛋白-4 mRNA表达的影响[J].北京大学学报:医学版,2009,41(6):669-673.
[14]钱卫庆,尹宏,孙海涛.不同浓度淫羊藿苷对大鼠成骨细胞增殖、分化的影响[J].中国医药导报,2011,36(8):23-25.
[15]张大威,程岩,张金超,等.淫羊藿苷对破骨细胞的分化及骨吸收功能的影响[J].中国药理学通报,2007,23(4):463-467.
[16]李晶晶,于世凤,李铁军,等.淫羊藿对口腔各矿化组织破骨细胞性骨吸收的体外实验研究[J].中华口腔医学杂志,2002,37(5):391-395.
[17]刘兴炎,吕明坡,葛宝丰,等.淫羊藿苷对小鼠破骨细胞β-肌动蛋白、抗酒石酸酸性磷酸酶、核因子-κB受体活化因子mRNA表达的影响[J].中华实验外科杂志,2007,24(8):996-998.
[18]HELLSING E,HAMMARSTRÖM L.The hyaline zone and associated root surface changes in experimental orthodontics in rats:a light and scanning electron microscope study[J].Eur J Orthod,1996,18:11-18.
[19]ABASS SK,HARTSFIELD JK.Orthodontics and external apical root resorption[J].Semin Orthod,2007,13:246-256.
[20]OWNLAN-MOLL P,KUROL J.The early reparative process of orthodontica induced root resorption in adolescents-location and type of tissue[J].Eur J Orthod,1998,20(6):727-732.
