闭胸式猪急性心肌梗死后心肌病理切片的观察
2015-02-18段娜娜王宏运王丽平王绍欣董平栓汪砚雨李转珍魏丽娟陈士芳孟雅丽刘向勇程建新
段娜娜,王宏运,2,王丽平,王绍欣,董平栓,汪砚雨,王 可,李转珍,魏丽娟,陈士芳,孟雅丽,闫 鹏,刘向勇,程建新
(河南科技大学:1.第一附属医院心血管内科;2.护理学院;3.第一附属医院麻醉科,河南洛阳 471003)
急性心肌梗死(acute myocardial infarction,AMI)是一种发病迅速、死亡率和致残率极高的心脏疾病,经皮冠状动脉内支架植入术(percutaneous coronary artery stent implantation,PCI)可有效救治濒死心肌,明显改善患者预后。但由于医疗条件的限制和不平衡,基层医院往往不具备开展急诊PCI术的条件。错过PCI术最佳窗口期后,何时进行血运重建可最大程度减轻再灌注损伤是医学领域普遍关注的的重要问题,目前国内外尚未定论。通过建立AMI动物模型,观察AMI后不同时期的梗死心肌病理变化,是解决该问题的实验基础。中华小型猪因其心脏在解剖结构、心脏血管分布和心脏体质/量等方面与人类心脏相仿[1],使得堵闭其冠脉形成的缺血性心脏病发病过程与人类存在高度相似性,一直是人类心血管疾病模型制备研究的优选动物。本研究使用明胶海绵封堵钝缘支(OM支)建立中华小型猪AMI模型,直观、连续、动态地观察AMI后梗死心肌的病理变化,为何时血运重建提供最直接的实验依据。
1 对象与方法
1.1 研究对象 中华小型猪5只,由泰州泰和生物科技有限公司提供,体质量(15±2.5)kg,全部经防疫检验健康合格,检疫证号3205197447,许可证号SCXK(苏)2011-0002,同种同窝,雄性。排除标准:体质不佳、进食不良、心电图不合格或近期患病的猪。
1.2 实验材料 ①麻醉药品:地西泮注射液(哈药集团三精制药股份有限公司),氯胺酮(江苏恒润医药股份有限公司),利多卡因(江苏药业集团新郑股份有限公司);②造影剂:碘普罗胺(拜耳医药保健有限公司广州分公司);③HE染色试剂:二甲苯(天津市永大化学试剂有限公司),无水乙醇(天津市永大化学试剂有限公司),甲醛(上海如吉生物科技发展有限公司),伊红(天津科密欧化学试剂开发中心),苏木素(上海山浦化工有限公司);④血管封堵材料:明胶海绵(广州市彦达贸易有限公司);⑤除颤仪(日本光电工业株式会社TEC-5521C);⑥DSA(PHLIPS MML19);⑦心电监护仪(Philips Medizin Systeme Boebligen Gmbh German M8001A);⑧吸痰机(鱼跃医疗TE-A);⑨电热恒温干燥箱(天津市泰斯特仪器有限公司202-1型),载玻片(海伦,规格:25mm×7.5mm 厚度:1~1.2mm),盖玻片(盐城市信泰医疗器械厂,0.13~0.17mm);⑩包埋机(LEIKE 湖北襄樊徕克电子仪器厂,PPDB/21);○11冷台机(LEIKE湖北襄樊徕克电子仪器厂,PPDB/21)及切片机(LEICA,RM2235);○12数码电子显微镜(NIKON ECLIPSE 80i);○13造影介入材料:6F动脉鞘管、6FJR、微导管、指引导丝、J型导丝等(临床使用过的废旧材料,均经环氧乙烷消毒);○14备用药品:肝素(山东鲁抗辰欣药业有限公司),肾上腺素(天津药业集团),多巴胺(上海禾丰制药有限公司),尼可刹米(天津药业集团),阿托品(福仁药业集团信阳有限公司),氯化钾(北京益民药业有限公司),硝酸甘油(北京益民药业有限公司),地塞米松针(开封制药集团有限公司)。
1.3 急性心肌梗死模型的建立方法
1.3.1 麻醉 小型猪禁食12h、禁水8h,肌肉注射氯胺酮10mg/kg诱导麻醉,将小型猪清洗干净后四肢固定于特制木板上,然后放置于导管床上,以3L/min流量给氧,胸部及四肢备皮,心电持续监护,用套管针在小型猪耳缘大静脉建立静脉通道,静脉缓慢推注1mL安定以及10mg氯胺酮,术中一直保持麻醉状态,除颤仪及吸痰机备用。
1.3.2 采用Seldinger's法穿刺右股动脉建立动物模型 具体步骤:①碘伏常规消毒铺无菌巾;②触及右侧股动脉搏动最强处,利多卡因局部麻醉后,Seldinger法穿刺右股动脉,穿刺成功后可见鲜红动脉血自针尾喷出,送入导引导丝,沿导引导丝送入6F动脉鞘管,随即弹丸式注入肝素10 000U,手术过程中每半小时可追加肝素2 000U;③在J形导丝引导下将Guiding导管送入升主动脉根部,行左右冠状动脉多体位造影,心电监护示:窦性心律,160~200次/min,血压160/130 mmHg,将Runthrough导丝送入钝缘支(OM)远端,微导管送入OM支近端,撤出导丝,将明胶海绵混悬液(明胶海绵溶于造影剂碘普罗胺内)经微导管推入,造影显示OM支远端血流消失,撤出微导管,监测中华小型猪各项生命体征及氧饱和度。④术毕,拔出6F动脉鞘管,置入人用锁骨下静脉套管,封闭股动脉创口,肝素封管后,将其固定于术区,贴膜覆盖。实验结束后,送回动物中心,单猪饲养,避免感染。
1.4 梗死心肌病理切片的制作 分别取 AMI后1、3、5、7、10d中华小型猪整体心脏,经40mL/L甲醛固定后,于左室侧壁分别切取3块梗死心肌组织及1块正常心肌组织,进行脱水、包埋、切片、脱蜡,行HE染色后封片,梗死心肌病理切片制作完备,于40倍电子数码显微镜下观察并摄片。
2 结 果
2.1 中华小型猪AMI前后冠脉造影情况 5头中华小型猪均成功进行了冠脉造影术及明胶海绵堵闭术。中华小型猪冠脉走形与人类冠脉相似,明胶海绵堵闭OM支后显示远端血流消失,AMI模型复制成功(图1)。
2.2 中华小型猪梗死心肌的病理学变化
2.2.1 大体标本观察 AMI后1d,中华小型猪梗死心肌灶呈灰黄色,水肿明显,质地松软(图2A);AMI后10d,梗死心肌灶呈灰白色,表面下陷,质地坚韧,瘢痕组织形成(图2B)。
2.2.2 组织病理观察 为进一步研究AMI后不同时期梗死心肌的病理变化,对中华小型猪AMI后1、3、5、7、10d的梗死心肌病理切片进行观察。结果可见,正常心肌细胞排列整齐,细胞核呈椭圆形,位于心肌细胞中央,胞质均匀(图3A);AMI后1d坏死心肌细胞核呈长杆状,胞质嗜酸性增强,部分胞质呈粗颗粒状(图3B);AMI后3d坏死心肌细胞轮廓模糊,边缘大量炎性细胞侵润(图3C);AMI后5d坏死心肌细胞核逐渐碎裂,部分溶解,边缘出现空泡变,可见少量炎性细胞(图3D);AMI后7d坏死心肌细胞核渐消失,边缘大量肉芽组织生成(图3E);AMI后10d坏死心肌边缘可见少量肉芽组织,大量纤维瘢痕组织形成取代肉芽组织(图3F)。
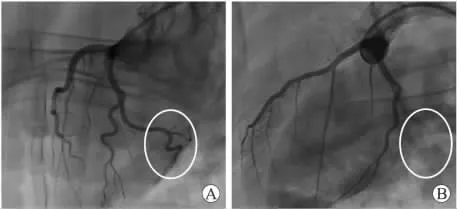
图1 AMI前后中华小型猪冠脉造影情况Fig.1 Coronary angiography of Chinese mini-swine before and after AMI
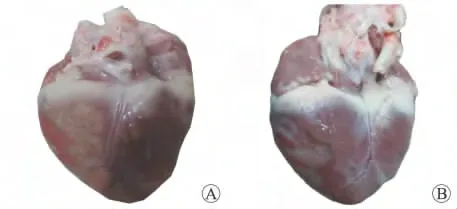
图2 AMI后1d(A)、10d(B)时中华小型猪的心脏Fig.2 Heart of Chinese mini-swine at 1d(A)and 10d(B)after AMI
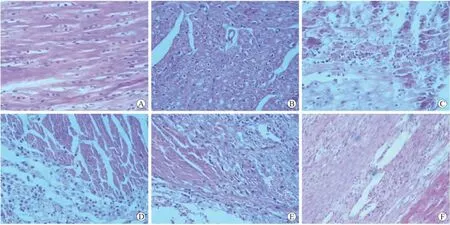
图3 AMI后心肌组织的病理观察Fig.3 Pathological observation of myocardial sections after AMI(×40)
3 讨 论
AMI严重危害人类健康,病情凶险、预后较差。AMI后直接行PCI术可迅速有效地恢复心肌再灌注,是治疗ST段抬高型急性心肌梗死(STEMI)的首选疗法。然而梗死相关血管(IRA)开通后,缺血再灌注损[2-3]、心肌顿抑、慢血流、无复流等因素易引起心律失常、心肌收缩功能减退甚至严重血流动力学障碍。临床实践表明,不合时宜的血运重建不仅不能使患者从中获益,相反会使病情加重。选择最佳血运重建时机可减轻再灌注损伤是临床医师关注的核心问题。中国及美国PCI指南[4-6]、欧洲心肌血运重建指南[7]均建议,发病超过12h的AMI患者应于发病7~10d后行再灌注治疗。究竟何时进行血运重建才能使患者更有利、有用、有效,目前尚无定论。
多数学者认为,AMI后血运重建时间应考虑到梗死心肌病理变化及修复过程。AMI后不同时期梗死心肌呈现何种病理表现及变化,现国内外鲜有报道。通过建立AMI动物模型,观察AMI后不同时期的梗死心肌病理变化,是解决该问题的基础。传统的AMI模型大多通过开胸结扎冠脉完成,易破坏胸腔的正常解剖结构,对心肺功能影响大,且手术造成的损伤和炎症对动物的创伤大、死亡率高,不利于术后连续观测[8-9]。采用介入技术,经皮冠状动脉内明胶海绵堵闭术制作AMI模型可避免对心肺功能影响,手术造成创伤小,且术后可直观、连续、动态观测,有利于研究。中华小型猪的心脏在解剖结构、心脏血管分布和心脏体质/量等方面与人类相仿,且股动脉直径较粗、可容纳6F动脉鞘管[10],堵闭猪冠状动脉分支后形成的AMI模型与人心肌梗死病变有较大相似性。借助介入手段,建立中华小型猪AMI模型,研究AMI后梗死心肌的病理变化及修复过程对选择最佳血运重建时机有重要指导意义。
本实验动态观察了不同时期梗死心肌的病理变化,AMI后1~3d梗死心肌病灶成灰黄色、水肿明显,镜下观坏死心肌细胞轮廓尚存在,胞质嗜酸性增强,心肌细胞间毛细血管内充血明显,坏死心肌边缘大量炎症细胞浸润;此时炎症细胞释放大量炎性介质,使坏死心肌细胞溶解,易致心脏破裂。AMI后3~5d梗死心肌病灶水肿减轻,镜下观出现大片坏死心肌,部分坏死心肌细胞胞质均质红染,细胞核肿胀,坏死心肌边缘出现明显充血带,伴空泡变;此时梗死区心肌细胞彻底坏死,修复不明显,此时血运重建风险较大。AMI后5~7d坏死病灶表面略下陷,镜下观坏死心肌轮廓模糊,细胞核碎裂,坏死心肌细胞间及边缘大量肉芽组织增生,其抗拉力较弱,血运重建有一定风险。AMI后7~10d坏死病灶呈灰白色表面明显下陷,质地变坚实,镜下坏死心肌轮廓消失,胞质均质红染,细胞核碎裂、溶解,出现空泡变,坏死心肌范围逐渐减少,肉芽组织逐渐被大量增生的条索状纤维组织及瘢痕组织替代,此时梗死心肌相对越稳定,抗拉力逐渐恢复,并发症可能较少,开通冠脉相对安全。AMI 10后坏死心肌修复更完全,心电活动更稳定,此后血运重建更安全。但由于社会、经济等原因,多数患者都在AMI后7~10d行血运重建,更长时间的血运重建对心肌细胞有何影响,目前缺乏此方面研究。
临床上血运重建需考虑到多方面因素,如患者的年龄、心功能状况、梗死面积的大小、有无高危因素以及经济社会因素等。本实验动物数量较少,未能进行连续长期梗死心肌的病理观察及修复过程,有待进一步进行大样本长期观察。
[1]KIM W,JEONG MH,SIM DS,et al.A porcine model of ischemic heart failure produced by intracoronary injection of ethyl alcohol[J].Heart Vessels,2011,26(3):342-348.
[2]ARASZKIEWICZ A,GRYGIER M,LESIAK M,et al.The impact of ischemia-reperfusion injury on the effectiveness of primary angioplasty in ST-segment elevation myocardial infarction[J].Postepy Kardiol Interwencyjnej,2013,9(3):275-281.
[3]KLONER RA,HALE SL,DAI W,et al.Reduction of ischemia/reperfusion injury with bendavia,a mitochondria-targeting cytoprotective peptide[J].J Am Heart Assoc,2012,1(3):e001644.
[4]LEVINE GN,BATES ER,BLANKENSHIP JC,et al.2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions[J].Circulation,2011,124(23):e574-651.
[5]LEVINE GN,BATES ER,BLANKENSHIP JC,et al.2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention:executive summary:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions[J].Circulation,2011,124(23):2574-2609.
[6]PATEL MR,DEHMER GJ,HIRSHFELD JW,et al.ACCF/SCAI/STS/AATS/AHA/AS NC2009 Appropriateness Criteria for Coronary Revascularization:A Report of the American College of Cardiology Foundation Appropriateness Criteria Task Force,Society for Cardiovascular Angiography and Interventions,Society of Thoracic Surgeons,American Association for Thoracic Surgery,American Heart Association,and the A-merican Society of Nuclear Cardiology:Endorsed by the American Society of Echocardiography,the Heart Failure Society of America,and the Society of Cardiovascular Computed Tomography[J].Circulation,2009,119(9):1330-1352.
[7]KOLH P,WIJNS W,DANCHIN N,et al.Guidelines on myocardial revascularization Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC)and the European Association for Cardio-Thoracic Surgery(EACTS)[J].Eur J Cardio-Thoracic Surg,2010,38(Suppl):S1-S52.
[8]HONG SJ,HOU D,BRINTON TJ,et al.Intracoronary and retrograde coronary venous myocardial delivery of adipose-derived stem cells in swine infarction lead to transient myocardial trapping with predominant pulmonary redistribution[J].Catheter Cardiovasc Interv,2014,83(1):E17-25.
[9]SONG L,YANG YJ,DONG QT,et al.Atorvastatin enhance efficacy of mesenchymal stem cells treatment for swine myocardial infarction via activation of nitric oxide synthase[J].PloS One,2013,8(5):e65702.
[10]GAHREMANPOUR A,VELA D,ZHENG Y,et al.Xenotransplantation of human unrestricted somatic stem cells in a pig model of acute myocardial infarction[J].Xenotransplantation,2013,20(2):110-122.
