口虾蛄假溞状幼体和仔虾消化酶活力的变化
2015-02-17刘海映周元雪邢坤陈雷
刘海映,周元雪,邢坤,陈雷
(1.大连海洋大学辽宁省海洋牧场工程技术研究中心,辽宁大连116023;2.大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
口虾蛄Oratosquilla oratoria隶属于节肢动物门Arthropoda、甲壳纲Crustacea、软甲亚纲Malacostraca、口足目Stomatopoda、虾蛄科Squillidae、口虾蛄属Oratosquilla[1],是一种掠食性动物,具有营养丰富、肉质鲜美等特点,经济价值较高。口虾蛄作为沿海经济虾类,国内外对其生物学特性及养殖过程的研究较多[2-6],而有关其幼体消化酶的研究尚未见报道。
目前,有关甲壳动物各发育期幼体消化酶的研究,国内外已有一些报道:国外学者研究了罗氏沼虾 Macrobrachium rosenbergii[7]、红岩龙虾 Jasus edwardsii[8]、智利王蟹 Lithodes santolla[9]等幼体发育过程中消化酶活力的变化规律;国内学者研究了中国对虾Penaeus chinensis[10]、南美白对虾 Penaeus vannamei[11]、凡 纳 滨 对 虾 Litopenaeus vannamei[12]等幼体的消化酶活力。对口足类动物的消化生理特征的研究较少,国内仅见钱云霞等[13]对黑斑口虾蛄Oratosquilla kempi幼体的消化酶活力进行了研究。本研究中,通过测定口虾蛄Ⅲ到Ⅺ幼体及仔虾的消化酶活力,分析了幼体发育过程中消化酶活力的变化规律及消化生理特征,这不仅为合理投饵、提高苗种产量与质量提供科学参考,同时也为口虾蛄幼体消化酶活力的调节机制提供理论依据。
1 材料与方法
1.1 材料
口虾蛄各期幼体取自盘锦光合蟹业有限公司的育苗池塘 (海水盐度为22.3±0.5),各期分类方法见文献 [1]。
口虾蛄幼体在Ⅲ期、Ⅴ期、Ⅶ期、Ⅸ期、Ⅺ期、仔虾期的体长分别为 (3.56±0.14)、 (5.42±0.19)、 (9.95±0.39)、 (15.8±0.41)、 (20.42±1.52)、(16.30±0.74)mm。
1.2 方法
将各期幼体用滤纸吸干水分,立即放入封口袋冷藏 (-4℃),运回实验室后用预冷的生理盐水冲洗干净,于超低温 (-80℃)下保存待用。
准确称量各期幼体质量 (g),加入10倍体积(mL)预冷的生理盐水,置于冰浴中匀浆,将匀浆液以2500 r/min冷冻离心10 min,取上清液进行酶活力测定。采用DNS纤维素酶法测定纤维素酶活力[14]。采用南京建成生物工程研究所试剂盒测定胃蛋白酶、胰蛋白酶、脂肪酶、淀粉酶活力和酶液蛋白含量。测定设4个重复,取其平均值。酶活力以比活力表示,单位为U/mg,其中脂肪酶活力单位为U/g。
1.3 数据处理
根据测定数据,利用Excel软件分析并计算平均值、标准误差,所得数据经SPSS 17.0软件进行统计分析,显著性水平设为0.05。
2 结果与分析
从图1可见:随着口虾蛄幼体的发育,淀粉酶活力呈先增大后减小的趋势,在Ⅴ期时活力达到最高,为1.273 U/mg,显著高于其他期 (P<0.05),Ⅲ期和Ⅶ期酶活力显著高于Ⅸ期、Ⅺ期和仔虾期(P<0.05),仔虾期最低,显著低于其他各期 (P<0.05);随着口虾蛄幼体的发育,纤维素酶活力则呈逐渐减小的趋势,Ⅲ期、Ⅴ期、Ⅶ期酶活力之间无显著性差异 (P>0.05),但均显著高于其他期(P<0.05);淀粉酶活力约为纤维素酶活力的1.5~2.5倍。

图1 不同发育期口虾蛄淀粉酶和纤维素酶活力的变化Fig.1 Changes in amylase and cellulase activities in different developmental stages of mantis shrimp Oratosquilla oratoria
从图2可见:随着口虾蛄幼体的发育,胃蛋白酶和胰蛋白酶活力均呈逐渐上升的趋势,均在仔虾期时酶活力达到最高,分别为 1.104、1.699 U/mg;Ⅸ期和Ⅺ期胰蛋白酶活力显著高于Ⅴ期和Ⅶ期 (P<0.05),Ⅲ期的胰蛋白酶活力最低,显著低于其他期 (P<0.05);除Ⅲ期和Ⅴ期胃蛋白酶活力无显著性差异 (P>0.05)外,其余不同时期的酶活力均有显著性差异 (P<0.05);胰蛋白酶活力约为胃蛋白酶活力的1.5~3.0倍。
从图3可见:随着口虾蛄幼体的发育,脂肪酶活力呈逐渐增大的趋势,在仔虾期达到最高;仔虾期活力大于Ⅺ期,但无显著性差异 (P>0.05);其余各期的酶活力从高到低依次为Ⅸ期、Ⅶ期、Ⅴ期、Ⅲ期,但无显著性差异 (P>0.05)。脂肪酶活力相对较弱。
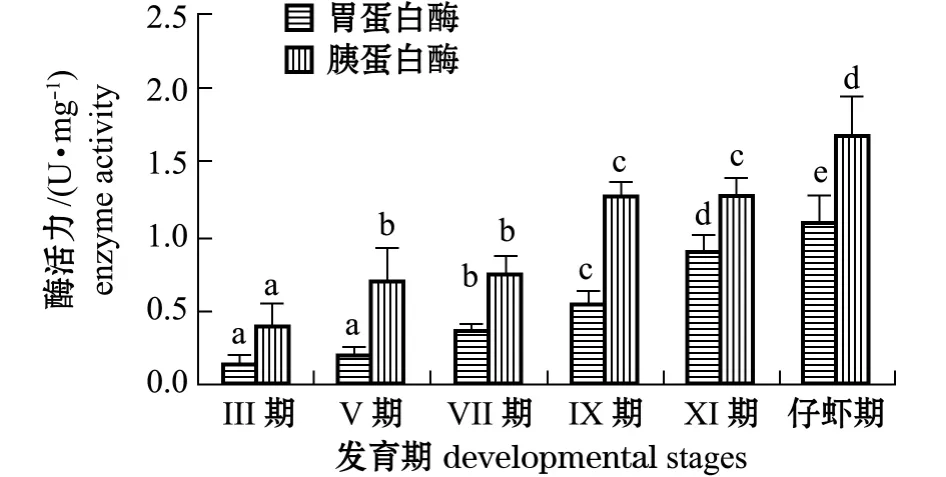
图2 不同发育期口虾蛄胃蛋白酶和胰蛋白酶活力的变化Fig.2 Changes in pepsin and trypsin activities in different developmental stages of mantis shrimp Oratosquilla oratoria
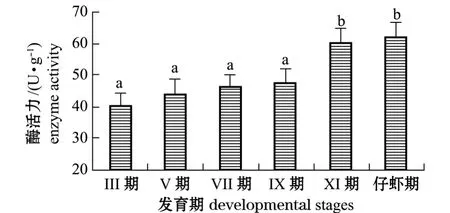
图3 不同发育期口虾蛄脂肪酶活力的变化Fig.3 Changes in lipase activity in different developmental stages of mantis shrimp Oratosquilla oratoria
从图4可见,随着口虾蛄幼体的发育,淀粉酶与胰蛋白酶活力的比值 (A/T)呈缓慢减小的趋势,直到Ⅶ期和Ⅺ期时快速降低,Ⅶ期A/T值约为Ⅸ期的2倍,Ⅺ期A/T值约为仔虾期的2.5倍。
3 讨论
3.1 口虾蛄的生长及摄食特点

图4 不同发育期口虾蛄淀粉酶与胰蛋白酶活力比值(A/T)的变化Fig.4 Changes in amylase and trypsin activities(A/T)in different developmental stages of mantis shrimp Oratosquilla oratoria
口虾蛄幼体发育需经过11个假溞状幼体期,从Ⅲ期至仔虾期共经历8次蜕皮变态,其中从Ⅹ、Ⅺ期浮游幼体转变为底栖生活[1],变态发育时间长 (历时30 d左右),而常见经济虾蟹类如南美白对虾变态发育只需要15 d左右。口虾蛄假溞状幼体Ⅰ期、Ⅱ期围绕在洞穴底层避光处,不摄食;从Ⅲ期开始离开洞穴浮游生活,并开始摄食微藻、卤虫无节幼体等饵料;Ⅴ期幼体能摄取卤虫无节幼体、小型桡足类等,若投饵不足则会出现互相残杀;Ⅶ期幼体开始摄取卤虫成体、大型桡足类等;口虾蛄幼体Ⅹ、Ⅺ期有趋地习性,聚集在光线不强的角落或向底部游窜,摄食量增大;口虾蛄仔虾生活习性完全改变,开始穴居生活,其形态、生态特性与成虾蛄相似[15]。因此,口虾蛄幼体在生长发育过程中有着独特的生长和消化生理过程。
3.2 口虾蛄幼体发育过程中消化酶的变化规律和消化生理特征
本试验中发现,口虾蛄消化酶活力在生长过程中表现出3种变化模式,其中,淀粉酶活力呈先增大后减小的变化模式,与日本对虾Penaeus japonicus[16]、锯缘青蟹 Scylla serrata[17]、红岩龙虾[18]等幼体酶活力变化模式类似;胃蛋白酶、胰蛋白酶和脂肪酶活力呈逐渐增大的变化模式,与其他学者在中国对虾[10]、南美白对虾[19-20]、凡纳滨对虾[21]中得到的结果相似;而纤维素酶活力呈逐渐减小的变化模式,则与南美白对虾[20]的纤维素酶活力变化趋势一致。这种多样的变化模式不仅说明不同的消化酶有各自不同的调节机制,还说明口虾蛄可以利用不同的饵料作为生长能源和营养来源,这种灵活多样的消化力提高了口虾蛄幼体的捕食率及存活率。
口虾蛄幼体Ⅲ期时具有较高的消化酶活力。克氏原螯虾 Procambarus clarkii[22]、斑节对虾 Penaeus monodon[23]、圣保罗对虾 Farfantepenaeus paulensis[24]等甲壳动物在溞状幼体初期也存在消化酶活力,它们在无节幼体时不摄食,仅靠卵黄供给营养进行生长发育[12]。本研究中发现,口虾蛄幼体消化系统在假溞状幼体Ⅰ期、Ⅱ期不摄取开口饵料,但Ⅲ期时口虾蛄消化器官已有了初步分化,消化腺分泌消化酶对营养进行消化吸收;幼体在Ⅲ期时开口摄食,消化器官尚未完全发育成熟,捕食和消化能力都很弱,所需维持生命活动的能量也比较少,能量主要来源于易于消化利用的糖类物质;随着幼体生长发育,消化器官进一步分化,对蛋白质等大分子的分解能力逐渐增强,且摄食量和能量需求也逐渐增大,能量主要由消耗蛋白质所提供。
试验证明,口虾蛄幼体消化酶活力不仅受消化器官发育程度和自身能量需求的影响,而且会对食性做出反应。有研究发现,多种甲壳动物幼体的发育伴随着食性的转换过程。Biesiot等[25]提出,采用淀粉酶与胰蛋白酶活力的比值 (A/T)作为判断甲壳动物幼体食性的指标:A/T值高,食性为植食性或偏植食性;A/T值低,则为肉食性或偏肉食性。本试验结果表明,口虾蛄幼体发育过程中其食性存在明显的由偏植食性向肉食性转换,口虾蛄仔虾表现出纯肉食性。A/T值在假溞状幼体Ⅶ期和Ⅸ期,Ⅺ期和仔虾期之间显著下降,同时,淀粉酶、纤维素酶、胃蛋白酶和胰蛋白酶均在这两个时期出现显著变化,由此推断,这两个时期是口虾蛄食性转换的重要时期。因此,在口虾蛄人工育苗过程中,应及时调整饵料配方,合理改进投饵方式,以提高口虾蛄对营养物质的消化吸收能力。
本试验中测得的口虾蛄幼体脂肪酶活力较低,与中国对虾[10]、锯缘青蟹[17]相似,可能是生物本身的脂肪酶活力很低。据此,在配制饵料时应注意脂类的添加量,以提高口虾蛄幼体的存活率。此外,纤维素主要存在于藻类等植物中,是重要的结构多糖,虽然不能被消化道消化,但可以促进肠道蠕动,帮助消化和吸收物质。口虾蛄幼体的纤维素酶活力较高,高于中国对虾[10]、日本对虾[16]、三疣梭子蟹Portunus trituberculatus[26]等甲壳类动物,虽然口虾蛄纤维素酶活力缓慢降低,但在后期依然能够保持较高的酶活力,说明纤维素虽然不是口虾蛄幼体生长发育主要的能量来源,但依然是构成幼体饵料的重要组成部分。
[1]王波,张锡烈,孙丕喜.口虾蛄的生物学特征及其人工苗种生产技术[J].黄渤海海洋,1998,16(2):64-73.
[2]Kodama K,Shiraishi H,Morita M,et al.Verification of lipofuscinbased crustacean ageing:seasonality of lipofuscin accumulation in the stomatopod Oratosquilla oratoria in relation to water temperature[J].Marine Biol,2006,150:131-140.
[3]Kodama K,Shiraishi H,Morita M,et al.Reproductive biology of the Japanese mantis shrimp Oratosquilla oratoria(Crustacea Stomatopoda):annual cycle of gonadal development and copulation[J].Marine Biol,2009,5(5):415-426.
[4]林月娇,刘海映,徐海龙,等.大连近海口虾蛄形态参数关系的研究[J].大连水产学院学报,2008,23(3):215-217.
[5]孙丕喜,张锡烈,汤庭耀,等.口虾蛄(Oratosquilla oratoria)人工育苗技术研究[J].黄渤海海洋,2000,18(2):41-46.
[6]刘海映,王冬雪,姜玉声,等.盐度对口虾蛄假溞状幼体存活和摄食的影响[J].大连海洋大学学报,2012,27(4):311-314.
[7]Kamarudin M S,Jones D A,Le Vay L,et al.Ontogenetic change in digestive enzyme activity during larval development of Macrobranchium rosenbergii[J].Aquaculture,1994,123:223-333.
[8]Johnston D J,Ritar A,Thomas C,et al.Digestive enzyme profiles of spiny lobster Jasus edwardsii phyllosoma larvae[J].Mar Ecol Prog Ser,2004,275:219-230.
[9]Saborowski R,Thatje S,Calcagno J A,et al.Digestive enzymes in the ontogenetic stages of the southern king crab,Lithodes santolla[J].Marine Biol,2006,149:865-873.
[10]潘鲁青,王克行.中国对虾幼体消化酶活力的实验研究[J].水产学报,1997,21(1):26-31.
[11]迟淑艳,杨奇慧,周歧存,等.南美白对虾幼体和仔虾淀粉酶和脂肪酶活力的研究[J].水产科学,2005,24(4):4-6.
[12]迟淑艳,杨奇慧,周歧存,等.凡纳滨对虾(Litopenaeus vannamei Boone)幼体淀粉酶(Amylase)和脂肪酶(Lipase)活力的研究[J].现代渔业信息,2005,20(2):20-23.
[13]钱云霞,蒋霞敏,王春琳,等.黑斑口虾蛄消化酶的初步研究[J].中国水产科学,2000,7(2):100-102.
[14]邢钊,乐涛.动物微生物及免疫技术[M].郑州:河南科学技术出版社,2006:125-136.
[15]蒋霞敏,王春琳.黑斑口虾蛄幼体的发育[J].中国水产科学,2003,10(1):19-25.
[16]潘鲁青,王伟.日本对虾幼体几种消化酶活力的研究[J].海洋湖沼通报,1997(2):15-18.
[17]汤鸿,李少菁,王桂忠,等.锯缘青蟹幼体消化酶活力[J].厦门大学学报,1995,34(1):88-93.
[18]Johnston D J.Ontogenetic changes in digestive enzyme activity of the spiny lobster,Jasus edwardsii(Decapoda:Palinuridae)[J].Marine Biol,2003,143:1071-1082.
[19]朱春华,李广丽,文海翔.南美白对虾早期幼体消化酶活力的研究[J].海洋科学,2003,27(5):54-57.
[20]王淑红,陈昌生,刘志勇,等.南美白对虾幼体消化酶活力的初步研究[J].厦门大学学报,2004,43(3):389-392.
[21]杨奇慧,周歧存,马丽莎,等.凡纳滨对虾幼体胃蛋白酶和类胰蛋白酶活力的研究[J].海洋科学,2005,29(5):6-9.
[22]Hammer H S,Bishop C D,Watts S A.Activities of three digestive enzymes during development in the crayfish Procambarus clarkii(Decapoda)[J].Crustac Biol,2000,20:614-620.
[23]Nimrat S,Tanutpongpalin P,Sritunyalucksana K,et al.Enhancement of growth performance,digestive enzyme activities and disease resistance in black tiger shrimp(Penaeus monodon)postlarvae by potential probiotics[J].Aquacult Int,2013,21:655-666.
[24]Lemos D,Hernandez-Cortes M P,Navarrete A,et al.Ontogenetic variation in digestive proteinase activity of larvae and postlarvae of the pink shrimp Farfantepenaeus paulensis(Crustacea:Decapoda:Penaeidae)[J].Marine Biol,1999,135:653-662.
[25]Biesiot P M,Capuzzo J M.Digestive protease,lipase and amylase activities in stageⅠlarvae of the American lobster,Homarus americans[J].Comp Biochem Physiol,1990,95A:47-54.
[26]丁雪燕,何中央,邱晓力,等.三疣梭子蟹不同生长阶段消化酶活性及配合饲料对其影响的研究[J].动物营养学报,2010,22(2):492-497.
