维氏气单胞菌感染对西伯利亚鲟血清指标和hsp70基因表达的影响
2015-02-17田照辉徐绍刚朱华胡红霞王巍董颖
田照辉,徐绍刚,朱华,胡红霞,王巍,董颖
(北京市水产科学研究所暨国家淡水渔业工程技术研究中心 (北京),渔业生物技术北京市重点实验室,北京100068)
热休克蛋白是机体应激产生的一组具有高度同源性的蛋白,热休克蛋白表达的提高可以减少蛋白错误折叠和变性蛋白的数量,从而增加细胞的活力[1]。HSP70不仅是分子伴侣,而且和非特异性免疫相关,可活化CD4+T细胞,产生1L-10,从而抑制Th-1细胞介导的过度炎症反应[2]。在免疫过程中,HSP可上调巨噬细胞、单核细胞分化的标记;在宿主细胞与HSP70结合时,会识别肿瘤细胞相关多肽;可修复细胞损伤和防止由于细胞内在防御系统引起的细胞自溶和凋亡[3]。病原体通过释放活性氧、阳离子抗菌肽、溶菌酶和细胞因子等物质,破坏细胞内部结构,从而改变细胞内稳态,诱导 HSP 表达[4]。
鲟鱼为古老的软骨硬鳞类,是大型水生经济动物,具有重要的科研、经济价值。西伯利亚鲟Acipernser baerii隶属于鲟形目、鲟科、鲟属,是重要的鲟鱼养殖品种,常被作为软骨硬鳞类生物学模型动物。西伯利亚鲟在野生状态下抗病力很强,生活在西伯利亚勒拿河的鲟鱼,几乎不会被各种病原微生物和寄生虫感染[5],但在人工养殖条件下,养殖户为追求产量,盲目加大养殖密度,同时缺乏科学管理,鲟鱼长期忍受低溶氧、高NH+4-N等因子胁迫,致使其抗病力下降,增加了对病原菌的易感性,病害增加,近年来鲟鱼养殖病害问题已经凸显,并造成了巨大的经济损失[5-10]。气单胞菌是西伯利亚鲟重要的条件致病菌,赵凤岐等[5]、马志宏等[6]已从患病鲟鱼中分别分离鉴定出嗜水气单胞菌 Aeromonas hydrophila和维氏气单胞菌 Aeromonas veronii。为研究西伯利亚鲟在维氏气单胞菌感染过程中的生理免疫反应,本研究中进行了维氏气单胞菌攻毒试验,测定细菌感染前后鲟鱼血清指标和hsp70基因表达的变化,旨在为鲟鱼病害研究和抗病选育提供参考。
1 材料与方法
1.1 材料
试验用西伯利亚鲟由北京市水产科学研究所国家级鲟鱼良种场提供。挑选体质健壮、规格基本一致的西伯利亚鲟100尾用于试验,体质量为(260.2±37.8)g。试验鱼首先在实验室玻璃钢循环水池中养殖两周,养殖水体为2 m3,水温为22℃,每日投喂2次,投饲量为1%。
试验用维氏气单胞菌由北京市水产科学研究所水产动物营养与病害防治研究室提供。
RNeasy Mini Kit、RNase-Free DNase Set 为Qiagen公司产品,RT-PCR试剂盒购于Invitrogen公司,实时定量试剂为 AB公司的2×Sybrgreen PCR Master Mix。
1.2 方法
1.2.1 细菌的培养 将分离到的维氏气单胞菌X-1-06909菌株活化后接种于营养琼脂斜面上,28℃下培养18 h,用无菌生理盐水(0.65%)洗下菌苔,制成菌悬液,10倍梯度稀释,用平板菌落计数法测定菌液浓度,进行预试验,确定攻毒浓度。
1.2.2 感染试验 取80尾鱼,每10尾暂养在一个盛有0.15 m3水的玻璃钢水槽中,持续充气,水温控制在22.6~24.5℃。暂养2日后进行细菌人工感染试验:其中50尾作为处理组,给每尾鱼从背部肌肉注射菌液浓度为2.0×107cfu/mL的维氏气单胞菌,注射剂量为0.1 mL/100 g(体质量);30尾作为对照组,注射等量0.65%生理盐水。暂养期间正常投喂,感染期间停止投喂,尽量减少人为干扰,观察各组鱼的活动情况。
1.2.3 样品的采集 感染后每隔1 h观察一次鱼的活动情况,注射24 h后开始记录死亡鱼的数量和时间,试验共进行10 d,计算累积死亡率。处理组在感染40 h后出现濒临死亡个体,即鱼体失去平衡,翻白漂浮在水面,呼吸微弱接近死亡,开始采样。本试验中研究细菌感染后敏感个体和正常个体在免疫、生理和hsp70表达上的变化,因为感染个体的敏感程度难以界定,因此,以“濒危”作为敏感个体取样标准,本试验中40 h时出现濒危个体,所以从40 h开始取样。处理组在40、44、53、62、93、168 h取样,每次取3尾濒临死亡鱼,分别记为40、44、62、93、168 h处理组;对照组只在有代表性的3个时间节点即试验组开始死亡时、停止死亡时和试验结束时取样,即40、93、168 h取样,分别记为40、93、168 h对照组;为了验证感染后停止死亡前,活动的正常鱼和死亡鱼在皮质醇含量和各免疫指标之间的差异,53 h取感染组活动正常鱼3尾,记为53 h处理正常鱼组。将采集的样鱼快速深度麻醉后,从尾静脉采血,血样于冰箱 (4℃)中静置2 h,4℃下以3500×g离心10 min,制备血清,将上清液于冰箱 (-20℃)中保存备用。取0.1 g左右的肝、鳃、脾、后肠在液氮中速冻后于-80℃下保存,用于分子生物学分析。
1.2.4 引物设计 根据西伯利亚鲟HSP70 cDNA全序列 (GenBank:HM348777),应用 Primer 5.0软件设计实时定量引物HSP704f、HSP704r,由北京擎科生物工程有限公司合成 (表1)。

表1 实时定量引物Tab.1 Primers of Real-time PCR
1.2.5 hsp70基因的实时定量 使用RNA试剂盒提取总RNA,用RNase-Free DNase Set柱处理基因组,用伯乐紫外分光光度计测定RNA浓度和OD值,保证OD值为1.9~2.0,并用琼脂糖凝胶电泳检测RNA的完整性。按照田照辉等[11]的方法进行实时定量,采用SYBR Green法,将待测样品cDNA经过系列稀释后作为标准品,构建相对标准曲线。具体步骤如下:每个样品取总RNA 1 μg,用 SuperScript III First—Strand Synthesis System for RT-PCR(Invitrogen)进行反转录,并进行无反转录酶 (NRT)和无RNA(NOT)对照。实时定量引物HSP704f、HSP704r的扩增片段为100 bp,预先采用普通PCR和琼脂糖凝胶电泳验证引物的特异性。实时定量时,取鱼的肝、鳃、脾、肠4种组织的cDNA等量混合,梯度稀释30~36倍为模板,假定稀释36倍的模板的copy值为1,作相对标准曲线,根据标准曲线的斜率计算扩增效率E=10-1/Slope-1,保证扩增效率在90% ~110%(R2>0.99),各组织的cDNA稀释10倍作为模板,与标准曲线同时定量分析,并与NTC(无模板阴性对照)、NRT、NOT进行对照。反应体系 (共20 μL):2 × Sybrgreen PCR Master Mix 10 μL,10 μmol/L HSP704f、HSP704r各 0.7 μL,模板 2 μL,用ddH2O补足至20 μL。反应程序:95℃下预变性10 min,95℃下变性15 s,58℃下退火15 s,72℃下延伸45 s并采集荧光信号,共进行40个循环。每个模板重复3次,实时定量结束后立即进行熔解曲线分析。
1.2.6 皮质醇含量的测定 取-20℃下保存的血清,由北方生物技术研究所使用皮质醇放射免疫分析试剂盒 (北方生物技术研究所生产,国药准字S10940097)进行测定。
1.2.7 溶菌酶 (LZM)、超氧化物歧化酶 (SOD)活力和丙二醛 (MDA)含量的测定 参照宋超等[12]的方法,以溶壁微球菌Micrococcus lysoleikticus冻干粉为底物,将底物用0.1 mol/L、pH 6.4的PBS缓冲液配成 OD540nm=0.3~0.5的悬液。取3 mL该悬液于试管内并置于冰浴中,再加入50 μL待测血清,混合,测定OD值A0,将试液移入37℃下温浴30 min,取出后立刻置于冰浴内10 min,以终止反应,测定其OD值A。根据下式计算:
溶菌酶活力=(A0-A)/A。
取-20℃下保存的血清,由北京华英生物技术研究所使用试剂盒 (南京建成生物工程研究所)测定SOD活性、MDA含量。
1.3 数据处理
使用 SPSS 11.5软件进行单因素方差分析(One-Way),方差具有齐次性时采用Duncan法进行多重比较,方差不具齐次性时采用Games-Howell法进行多重比较。试验数据均以平均值±标准误表示 (n=3)。
2 结果与分析
2.1 人工感染后鱼体的发病症状
注射维氏气单胞菌后,每隔1 h观察一次鱼体的活动情况。结果显示:对照组活动一直正常,处理组在感染40 h后出现失去平衡且呼吸微弱濒临死亡的个体,此时采集的样本鱼鳃发黑,间或发白,肝脏呈土黄至红色,有的样本肝脏带有出血点;62 h取濒死鱼样本,鳃丝中间发白,表皮已经开始溃烂,后肠有脓血,62 h取样后,处理组不再出现死鱼个体;168 h取样后,停止试验。人工感染后不同时间试验鱼的死亡率如图1所示。
2.2 血清皮质醇含量
注射维氏气单胞菌后各试验组西伯利亚鲟血清皮质醇含量如图2所示,其中40 h对照组和53 h处理正常鱼组血清皮质醇含量最低,分别为(11.9±1.2)、(11.4±3.4)ng/mL,与不再出现死亡鱼后所取样本即93 h和168 h的对照组与处理组无显著性差异 (P>0.05),与处理患病各组即40 h处理组、44 h处理组、53 h处理组和62 h处理组有显著性差异 (P<0.05)。皮质醇含量的变化显示:对照组和处理活动正常鱼组的皮质醇含量均低于50 ng/mL,而患病鱼皮质醇的平均含量急剧升高,为124~444 ng/mL。
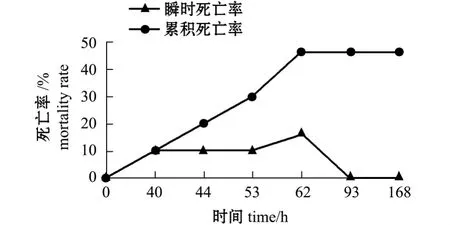
图1 注射维氏气单胞菌后西伯利亚鲟鱼的死亡率Fig.1 Mortality rate of Siberian sturgeon Acipenser baerii injected with Aeromonas veronii
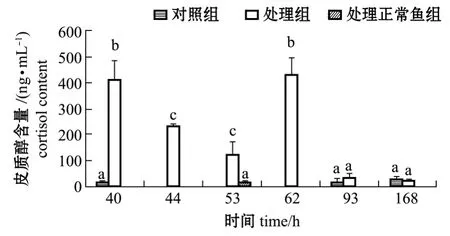
图2 注射维氏气单胞菌后西伯利亚鲟血清皮质醇含量的变化Fig.2 Changes in serum cortisol content of Siberian sturgeon Acipenser baerii injected with Aeromonas veronii
2.3 血清SOD、LZM活力和MDA含量
从图3可见:各试验组鱼血清SOD活力,62 h处理组最低,与40 h对照组、53 h处理组、53 h处理正常鱼组、93 h对照组、93 h处理组有显著性差异 (P<0.05),其他组间均无显著性差异(P>0.05);各试验组鱼血清LZM活力,处理组从44 h开始升高,直到62 h,各个处理组均显著高于40 h的处理组和对照组以及93 h和168 h的对照组和处理组 (P<0.05),其中44 h处理组、53 h处理组又显著高于53 h处理正常鱼组和62 h处理组(P<0.05);各试验组鱼血清MDA含量,93 h处理组最低,与40 h处理组、44 h处理组、53 h处理正常鱼组、62 h处理组有显著性差异 (P<0.05),其他组间均无显著性差异 (P>0.05)。
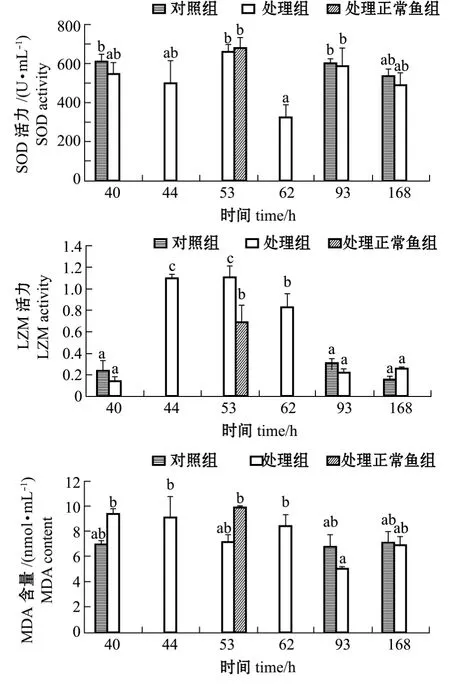
图3 注射维氏气单胞菌后西伯利亚鲟血清SOD、LZM活力MDA含量的变化Fig.3 Changes in activities of serum SOD,and LZM and serum MDA content in Siberian sturgeon Acipenser baerii injected with Aeromonas veronii
2.4 hsp70基因的组织表达
从图4可见:各处理组鱼肝脏中,hsp70基因的表达量随时间的延长呈先升高后降低的趋势;40 h对照组表达量最高,93 h对照组表达量最低;40 h对照组hsp70的表达量与93 h对照组、93 h处理组有显著性差异 (P<0.05),但与其他组无显著性差异 (P>0.05)。
各处理组鱼脾脏中,hsp70基因的表达在62 h内变化不大,93 h明显升高;40 h对照组表达量最高,40 h处理组表达量最低;40 h对照组、44 h处理组、93 h处理组表达量无显著性差异 (P>0.05),但均与40 h处理组、62 h处理组、93 h对照组有显著性差异 (P<0.05)。
各处理组鱼后肠中,hsp70基因的表达量随时间的延长呈先升高后降低再升高的趋势;40 h对照组、44 h处理组表达量较高,与93 h对照组、93 h处理组无显著性差异 (P>0.05),但与40 h处理组、62 h处理组有显著性差异 (P<0.05)。
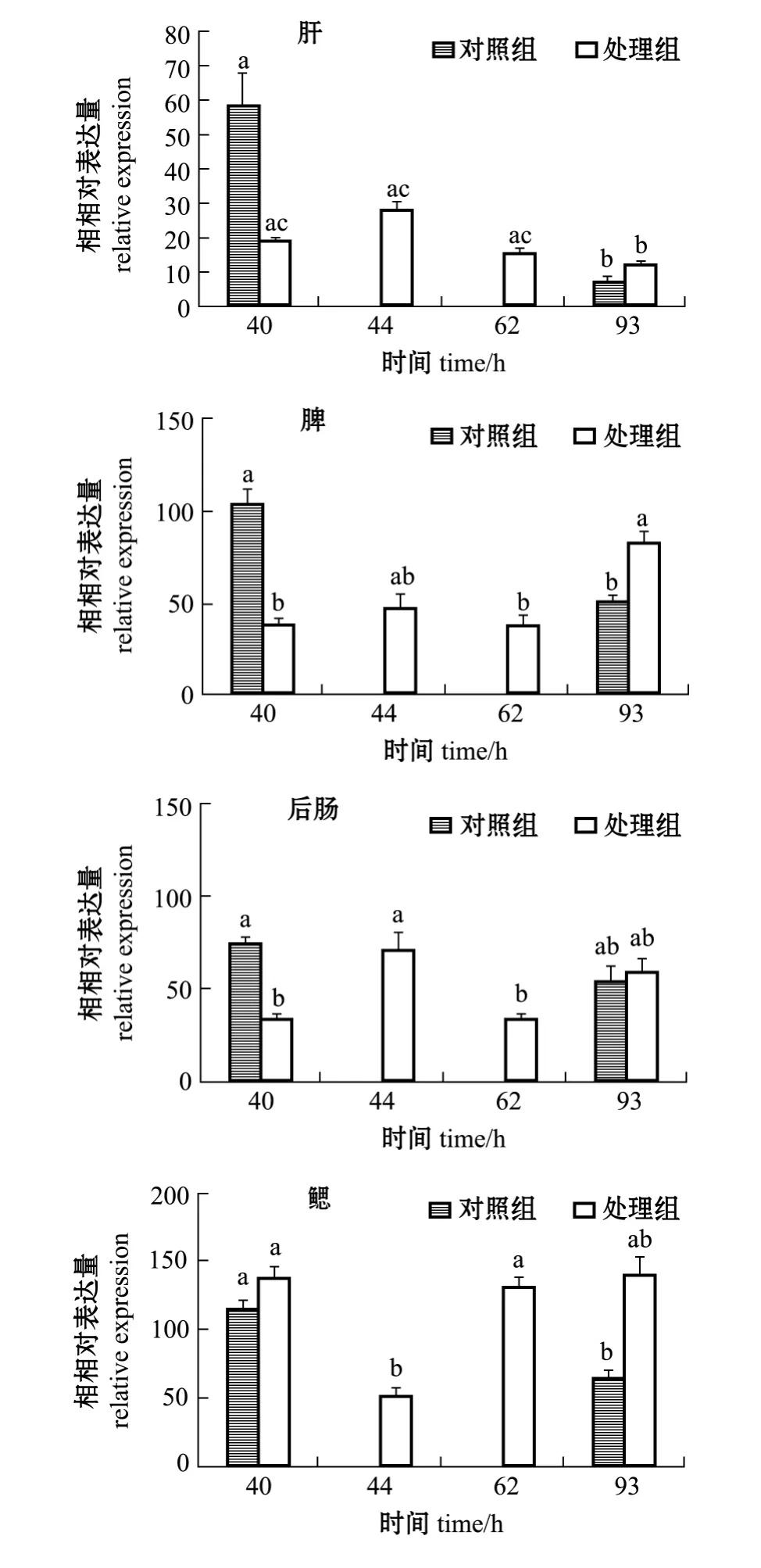
图4 注射维氏气单胞菌后西伯利亚鲟肝脏、脾、后肠、鳃中hsp70基因表达的变化Fig.4 Changes in hsp70 gene expression in live,spleen,intestine,and gill of Siberian sturgeon Acipenser baerii injected with Aeromonas veronii
各处理组鱼鳃中,hsp70基因的表达量随时间的延长呈先降低后升高的趋势;40 h对照组、40 h处理组、62 h处理组、93 h处理组表达量均较高,且组间无显著性差异 (P>0.05);44 h处理组、93 h对照组表达量较低,二者与93 h处理组无显著性差异 (P>0.05),但与其他组有显著性差异(P<0.05)。
3 讨论
3.1 西伯利亚鲟血清皮质醇含量的变化
鱼类在感染或损伤等应激情况下,体内激素如皮质醇、促肾上腺皮质激素等合成速率加快,其中一些激素可作为诱导炎症反应的介质,促进肝内急相蛋白的合成,皮质醇被认为是应激反应时蛋白合成的主要诱导剂[13]。皮质醇还具有促进葡萄糖异生作用,适度和短时增高可帮助机体对抗环境压力[14]。
鲟鱼在遭遇胁迫时最先产生的和最主要的类固醇激素是皮质醇[15]。寄生虫感染鱼体可以成为一种应激原,导致鱼体血浆皮质醇和血糖浓度的大幅度增高[16]。弧菌 Vibrio anguillarum侵染虹鳟 Oncorhynchus mykiss时,导致虹鳟血浆皮质醇水平增高[17]。细菌感染同样也造成了西伯利亚鲟血清皮质醇含量大幅升高,本研究中西伯利亚鲟40 h对照组以及53 h处理正常鱼组皮质醇含量最低,分别为 (11.9±1.2)、 (11.4±3.4)ng/mL,与停止死亡后的93 h和168 h处理组及对照组皮质醇含量无显著性差异,含量均低于50 ng/mL,93 h处理组血清皮质醇已回落到对照组水平,处理濒临死亡鱼的各组在40 h至62 h皮质醇平均含量急剧升高,为124~444 ng/mL,即患病鱼血清皮质醇含量会急剧升高。水温17.5℃时,体质量为 (155.47±19.50)g的西伯利亚鲟血清皮质醇生理水平为12.43 ng/mL,3龄1.5 kg西伯利亚鲟皮质醇生理水平为5 ng/mL[18],所以在疾病流行季节血清皮质醇异常升高有细菌感染的可能,在没有其他应激条件时,血清皮质醇异常升高可作为病害发生的指标之一。
3.2 西伯利亚鲟血清各项免疫指标的变化
溶菌酶是一种碱性蛋白,广泛存在于血细胞和血液中,能水解细胞壁而使细菌溶解,还具有激活补体和促进对细菌的吞噬作用。水生动物血清LZM活力是衡量机体免疫状态的指标之一。给西伯利亚鲟注射维氏气单胞菌后,血清LZM活力呈现出先升高后降低的趋势,这与鲫Carassius auratus和团头鲂Megalobrama amblycephala感染嗜水气单胞菌后LZM活力的变化规律一致[19-20]。这是因为鱼类感染致病菌后,引起鱼体的急性应激反应,通过大量分泌皮质醇来促进糖的合成、脂肪的降解获得能量[21-22],通过增加特定蛋白 (如溶菌酶、补体和C反应蛋白等)的水平来增强机体的免疫力[23-24],共同抵抗病原菌的侵袭。但是,当病原菌的危害超出了鱼体的防御能力,导致蛋白的合成水平下降,使LZM活性也受到抑制。斑点叉尾鮰Ictalurus punctatus在受爱德华氏菌Edwardsiella ictaluri感染时,第4天时LZM活力显著提高,且LZM活力同血液中的细菌水平呈正相关[25]。Fevolden等[26]认为,皮质醇和LZM活力的相关性取决于应激源持续的时间;Möeck等[22]认为,急性应激可提高LZM活力,持续的应激可降低LZM活力;Røed等[27]却得出相反的趋势,低水平的LZM活力在持续的应激时得到了提高。本研究中,LZM活力在44 h处理组、53 h处理组和62 h处理组表现出与皮质醇水平的正相关性,40 h处理组和53 h处理正常鱼组未表现出这种相关性。
机体在正常状态下,自由基产生和清除保持平衡,过多的自由基会造成组织损伤。SOD是最先与活性氧自由基发生作用的酶,能清除自由基,当SOD酶活性降低时,体内会出现过多自由基,免疫水平下降。MDA被认为是脂质过氧化的主要分解产物,其含量的高低不仅可以间接反映活性氧自由基含量的多少,而且还可以反映组织细胞脂质过氧化的强度或速率。本试验中,西伯利亚鲟停止死亡前各处理组SOD有下降趋势,62 h处理组较53 h处理组显著下降,说明机体抗氧化能力明显降低。停止死亡前除53 h处理组外,各处理组MDA含量均高于40 h对照组和停止死亡后各组,进一步说明随着机体抗氧化能力的下降,机体受到氧化损伤。
3.3 西伯利亚鲟组织中hsp70基因表达的变化
通常认为,热休克蛋白的大量表达有助于维持细胞内稳态,改善细胞的生存能力和提高对环境胁迫或伤害的耐受性。鱼体被细菌感染后,一般会引起体内hsp70表达水平升高,且具有组织特异性。虹鳟感染鳗弧菌后,随着病原菌的扩增,肝脏和肾脏中的hsp70基因表达量显著上升[17],当血清中皮质醇的水平达到最高值时,肝脏中hsp70基因的表达量也有峰值,而肾脏中在24 h时出现峰值。银大马哈鱼Oncorhyncus kisutch在人工感染沙门氏杆菌Salmonella enterica后,肝脏与肾脏中的hsp70水平呈逐渐上升趋势[28]。
西伯利亚鲟注射维氏气单胞菌后,处理组62 h后不再出现死亡,93 h已经没有发病症状,此时皮质醇和免疫指标已基本恢复到对照组水平,说明注射维氏气单胞菌93 h时后存活下来的个体已经能够维持自身的稳态,此时肝、鳃、脾、后肠中hsp70基因表达量除脾脏外均处于93 h对照组水平,所以93 h后的样品即168 h的表达量未进行检测。93 h对照组较低的热休克蛋白基因表达水平应该反映了正常的生理状况。肝、鳃、脾、后肠中hsp70基因表达量40 h对照组都处在较高水平,高于93 h对照组水平,推测对照组注射生理盐水40 h后诱导了西伯利亚鲟热休克蛋白基因的表达,而血清中的各生理免疫指标却没有变化,说明组织中热休克蛋白hsp70基因的诱导表达反应更灵敏。
注射维氏气单胞菌后,肝、鳃、脾、后肠4种组织中,鳃组织热休克蛋白基因最先被诱导表达。说明鳃组织可能最先被感染,这与观察到的感染过程较一致。肝脏各处理组随时间的延长呈现先升高后降低的趋势,但均低于40 h对照组,40 h对照组表达量高于93 h对照组和各处理组,可能是因为注射生理盐水引起了对照组hsp70基因的诱导表达,并且注射维氏气单胞菌使鱼体维持自身稳态的能力受到了抑制,致使处理组的表达强度低于对照组。脾脏中hsp70基因表达水平感染初期没有升高,直到93 h时反而升高,说明93 h时虽然机体各指标已达正常水平,但鱼体内仍然存在较多细菌侵染,引起脾脏的应激反应,体内细菌的清除需要较长的时间,例如大黄鱼人工感染溶藻弧菌后第11天时体内的弧菌才被清除[29]。西伯利亚鲟处理组后肠在40 h和62 h热休克蛋白基因的表达受到了抑制,44 h时维持在对照组水平。
4 结语
维氏气单胞菌感染西伯利亚鲟后,血清中皮质醇含量升高和溶菌酶活力升高可作为机体免疫状态的参考指标;注射生理盐水引起了对照组hsp70基因的诱导表达;hsp70基因在鳃组织最先有较高的诱导表达,说明鳃组织可能最先被感染。
[1]Guzhova I,Margulis B.Hsp70 chaperone as a survival factor in cell pathology[J].International Review of Cytology,2006,254:101-149.
[2]钱燕宁,韩传宝,于力,等.不同镇痛方法对子宫切除术后病人血清细胞因子和HSP70水平的影响[J].中华麻醉学杂志,2006,26(2):166-169.
[3]董云伟,董双林,纪婷婷.水生动物热休克蛋白研究进展[J].中国海洋大学学报,2008,38(1):39-44.
[4]Basu N,Todgham A E,Ackerman P A,et a1.Heat shock protein genes and their functional significance in fish[J].Gene,2002,295:173-183.
[5]赵凤岐,曹谨玲,刘青.西伯利亚鲟败血症病理学观察与病原学研究[J].水生生物学报,2009,33(2):316-323.
[6]马志宏,杨慧,李铁梁,等.西伯利亚鲟(Acipenser baerii)致病性维氏气单胞菌的分离鉴定[J].微生物学报,2006,49(10):1289-1294.
[7]储卫华,于勇.鲟鱼嗜水气单胞菌的分离与鉴定[J].淡水渔业,2003,33(2):16-17.
[8]曹海鹏,杨先乐,王玉洁,等.鲟源致病性豚鼠气单胞菌的分离及其生长特性[J].动物学杂志,2007,42(6):1-6.
[9]杨治国.嗜水气单胞菌的分离鉴定[J].淡水渔业,2001,31(5):40-41.
[10]孟彦,肖汉兵,张林,等.施氏鲟出血性败血症病原茵的分离和鉴定[J].华中农业大学学报,2007,26(6):822-826.
[11]田照辉,徐绍刚,王巍,等.西伯利亚鲟热休克蛋白HSP70 cDNA的克隆、序列分析和组织分布[J].大连海洋大学学报,2012,27(2):150-157.
[12]宋超,牛翠娟,陈欣然.壳聚糖对急性氨氮胁迫下中华鳖稚鳖非特异性免疫反应的影响[J].动物学报,2007,53(2):270-277.
[13]罗小平,刘皖君.新生儿皮质醇与急相蛋白关系的探讨[J].实用儿科杂志,1988,3(2):77-78.
[14]肖克宇.水生动物免疫与应用[M].北京:科学出版社,2007:145,182-186.
[15]Webb M A,Allert J A,Kappenman K M,et al.Identification of plasma glucocorticoids in pallid sturgeon in response to stress[J].General and Comparative Endocrinology,2007,154(1/3):98-104.
[16]Ahmed M,Chris M,Nicole F,et al.Effects of sea lice(Lepeophtheirus salmonis Kröyer,1837)infestation on macrophage functions in Atlantic salmon(Salmo salar L.)[J].Fish & Shellfish Immunology,2000,10:47-59.
[17]Paige A,Ackerman,George K,et al.Physiological and cellular stress responses of juvenile rainbow trout to Vibriosis[J].Journal of Aquatic Animal Health,2001,13:173-180.
[18]Maxime V,Nonnotte G,Peyraud C,et al.Circulatory and respiratory effects of an hypoxic stress in the Siberian sturgeon respiration physiology[J].Respiration Physiology,1995,100(3):203-212.
[19]孙峰,张煜,李立德,等.感染嗜水气单胞菌对鲫鱼非特异性免疫功能的影响[J].中国海洋大学学报,2005,35(5):815-818.
[20]明建华,谢骏,徐跑,等.大黄素、维生素C及其配伍对团头鲂感染嗜水气单胞菌后生理生化指标的影响[J].中国水产科学,2011,18(3):588-601.
[21]Bayne C J,Gerwick L.The acute phase response and innate immunity of fish[J].Dev Comp Immunol,2001,25(8/9):725-743.
[22]Möck A,Peters G.Lysozyme activity in rainbow trout,Oncorhynchus mykiss(Walbaurn),stressed by handling,transport and water pollution[J].J Fish Biology,1990,37(6):873-885.
[23]Dave G,Johansson-Sjöbeck M L,Larsson Å,et a1.Effects of cortisol on the fatty acid composition of the total blood plasma lipids in the European eel,Anguilla anguilla L.[J].Comparative Biochemistry and Physiology Part A:Physiology,1979,64(1):37-40.
[24]Viiayan M M,Leatherland J F.High stocking density affects cortisol secretion and tissue distribution in brook charr,Salvelinus fontinalis[J].Endocrinol,1990,124(2):311-318.
[25]Small B C,Bilodeau A L.Effects of cortisol and stress on channel catfish(Ictalurus punctatus)pathogen susceptibility and lysozyme activity following exposure to Edwardsiella ictaluri[J].General and Comparative Endocrinology,2005,142:256-262.
[26]Fevolden S E,Røed K H,Fjalestad K T.Selection response of cortisol and lysozyme in rainbow trout and correlation to growth[J].Aquaculture,2002,205:61-75.
[27]Røed K H,Larsen H J,Linder R D,et al.Genetic variation in lysozyme activity in rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1993,109(3/4):237-244.
[28]Kayhan F E,Duman B S.Heat shock protein genes in fish[J].Turkish JournalofFisheriesand AquaticSciences,2010,10:287-293.
[29]鄢庆枇,张俊杰,邹文政,等.人工感染溶藻弧菌对大黄鱼免疫功能的影响[J].水产学报,2007,31(2):250-256.
