基于生物协同作用的强化生态浮床对养殖水体的净化效果
2015-02-17许国晶段登选杜兴华田功太张明磊刘飞
许国晶,段登选,杜兴华,田功太,张明磊,刘飞
(山东省淡水渔业研究院,山东济南250013)
随着社会经济的高速发展,水环境污染日趋严重。各种外源性污染物及养殖自身过程,使得养殖水体富营养化加剧,生态环境质量下降,从而影响了养殖生物的品质和效益,因此,开展养殖池塘水环境质量改善的研究已成为保证中国水产养殖业健康发展的必然需求。生物浮床技术作为净化修复水体的有效手段之一,其具有成本低廉、节约能源、简便易行的优点,已被广泛运用于相关研究和实践中[1-2]。近年来,中国在浮床技术理论研究和应用方面发展迅速,并取得了良好的应用效果[3-6]。传统的生物浮床净化机理主要是通过在浮床上种植水生植物,并利用其吸收氮、磷等营养物和有机物质,达到净化养殖水体的效果。但是,浮床水生植物量的限制阻碍了净化效果的进一步提高,为优化浮床净化性能,本研究中在传统浮床基础上增加人工介质 (基质),强化微生物单元,试图通过植物吸收、基质吸附和微生物净化三者的协同作用,达到水体净化的目的[7-10]。
凤眼莲Eichhornia crassipes是一种多年生漂浮植物,因其能有效去除水中总氮 (TN)、总磷(TP)、化学耗氧量 (COD)等多种营养物质,被广泛应用于城市污水及水产养殖排放水处理中[11-17],但目前尚未见应用凤眼莲构建强化生态浮床的研究报道。为此,本研究中在传统凤眼莲浮床基础上,增加生物陶粒单元构建强化生态浮床,通过比较强化生态浮床与传统凤眼莲浮床对养殖水体的净化效果,探讨基质单元对强化生态浮床净化养殖水体效果的影响,旨在为构建适宜养殖水体净化的强化生态浮床提供基础数据。
1 材料与方法
1.1 材料
供试用水采自山东济宁浩洋生态科技有限公司养殖基地,随机选取3个鲤Cyprinus carpio混养池塘进行取水,每个池塘抽取同水层的水充分混合后作为试验用水,水质指标TN、TP、-N、-N、-N、COD的含量分别为 2.93~3.03、0.36 ~ 0.38、0.57 ~ 0.59、0.07、0.43 ~0.47、68 ~70 mg/L。
凤眼莲购自济南园林苗木市场,选取个体均匀完整、叶子较小的植株作为试验材料,大小为40~60 g/株。基质选取挂膜效率高的生物陶粒,购自山东省济宁市某陶瓷有限公司,其粒径为3~5 mm,孔隙率为46%,比表面积为3×104~5×104cm2/g,堆积密度为 0.8 ~1.1 g/cm3,表观密度为1.2 ~1.5 g/cm3。
1.2 方法
1.2.1 试验设计 试验在山东济宁浩洋生态科技有限公司养殖基地进行。试验分为强化生态浮床组、凤眼莲组、生物陶粒组和对照组,每组设3个重复。强化生态浮床组由植物单元 (覆盖率20%,200 g凤眼莲)和生物陶粒基质单元构成;凤眼莲组仅加入同等量的凤眼莲而不添加生物陶粒;生物陶粒组仅加入同等量的生物陶粒而不放置凤眼莲;对照组只加入供试水体。试验开始前,先将植株大小和质量相同的凤眼莲分别放入供试水体中进行1个月的适应性培养。生物陶粒投放前先经过灭菌处理、烘干,精确称量800 g。试验时间为2013年8月2日至2013年8月18日。试验期间,各组水温控制在25~30℃,光照强度为正常日光照。在凤眼莲及生物陶粒放置之前取一次水样作为对照(即0 d),之后每隔4 d取1次水样进行水质分析。
1.2.2 试验装置 强化生态浮床试验装置由浮床植物和基质两部分组成,选用凤眼莲为浮床植物,采用竹竿为浮床边框将其固定在塑料桶水体中,根部下放置用塑料编织袋盛放的基质 (图1)。各试验组在70 cm×50 cm×45 cm的塑料桶中进行,实际水深为40 cm。在塑料桶边设置一个功率为2.5 kW的鼓风机,每个塑料桶放置1个气石,每天19:00至次日6:00通过气石给水体增氧。
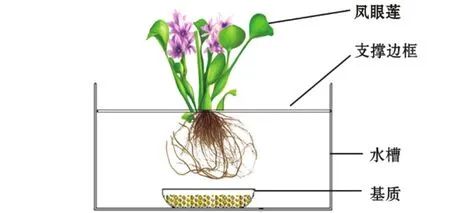
图1 强化生态浮床装置示意图Fig.1 Schematic diagram of an enhanced ecological floating bed
1.2.3 指标的测定 每次取样检测时间均为当日8:00,在水面下30 cm处采样5 L,采集的水样立即送实验室进行测定,在24 h内完成相应的分析测试。
采用便携式溶解氧仪测定溶解氧 (DO)含量;采用碱性过硫酸钾氧化紫外分光光度法测定TN含量;采用过钼酸铵分光光度法测定TP含量;采用酚二磺酸分光光度法测定-N含量;采用N-(1-萘基)-乙二胺光度法测定-N含量;采用水杨酸-次氯酸盐比色法测定-N含量;采用重铬酸钾法测定COD含量。
1.2.4 去除率计算 考虑到试验条件下水体内可能发生吸附、沉淀和降解等作用,为消除上述作用对去除效果的影响,准确评价浮床的净化效果,去除效率 (简称去除率)计算中扣除了对照组的影响[18],其计算公式为

1.3 数据处理
试验所得数据均表示为平均值,用SPSS 16.0软件进行方差分析和多重比较,显著性水平设为0.05。
2 结果与分析
2.1 强化生态浮床对TN的净化效果
由图2-A可见:试验结束时,强化生态浮床组、凤眼莲组、生物陶粒组水体中TN浓度由开始时的 3.00 mg/L 分 别 降 至 1.80、2.40、2.20 mg/L,分别下降了40%、20%、27%,而对照组从3.00 mg/L 上升到 3.50 mg/L,增加了 14.0%;试验过程中,强化生态浮床组、凤眼莲组和生物陶粒组TN水平均呈下降趋势,试验结束时均显著低于对照组 (P<0.05),同时强化生态浮床组TN含量显著低于凤眼莲组 (P<0.05),但与生物陶粒组无显著性差异 (P>0.05)。在试验后期 (8~16 d),各处理组TN水平均能达到淡水养殖废水排放一级标准 (SC/T9101—2007,下同)。从图2-B可见,试验结束时,强化生态浮床组对TN的去除率为48.57%,显著高于凤眼莲组 (31.43%)和生物陶粒组 (37.14%)(P<0.05)。
2.2 强化生态浮床对-N的净化效果
从图3-A可见:试验结束时,强化生态浮床组、凤眼莲组、生物陶粒组和对照组水体中NH+4-N浓度由开始时的 0.58 mg/L分别降至 0.17、0.33、0.26、0.54 mg/L;各处理组 NH4+-N浓度均显著低于对照组 (P<0.05),同时强化生态浮床组-N浓度显著低于凤眼莲组及生物陶粒组(P<0.05),而生物陶粒组与凤眼莲组无显著性差异 (P>0.05)。从图3-B可见,试验结束时,强化生态浮床组对-N的去除率为68.52%,显著高于凤眼莲组 (38.89%)和生物陶粒组(51.85%)(P<0.05)。
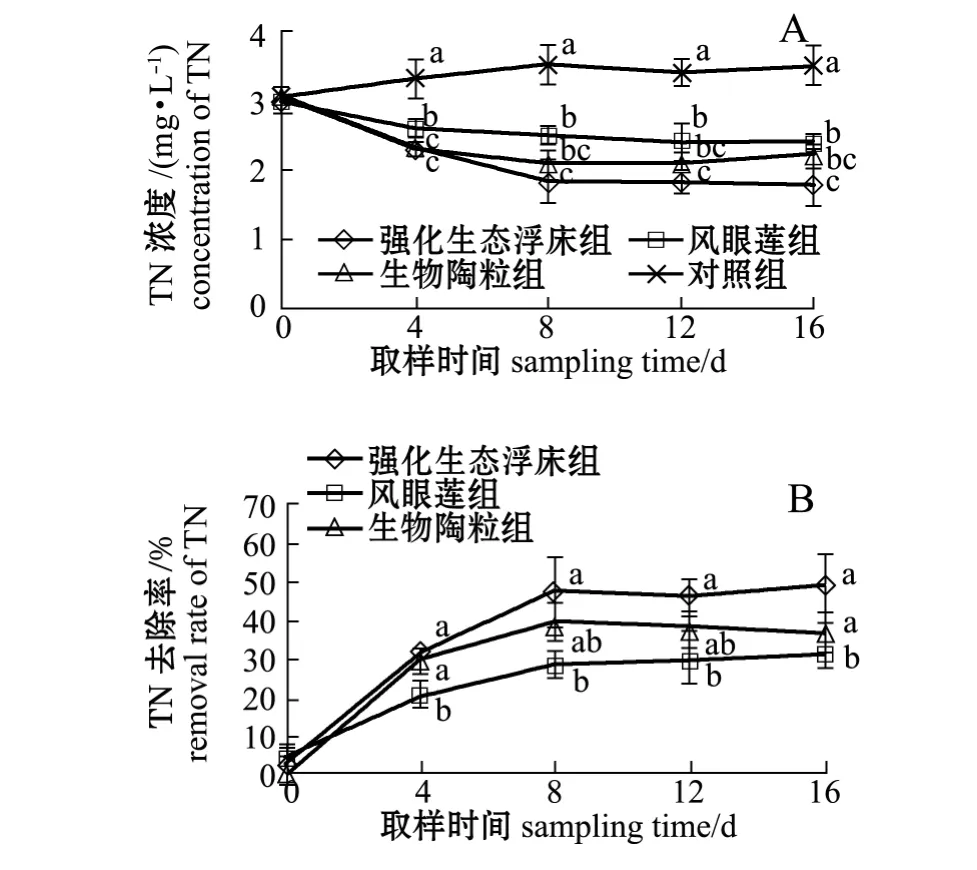
图2 各处理组TN浓度及去除率的变化Fig.2 Dynamic changes in TN concentration and removal rate in different groups
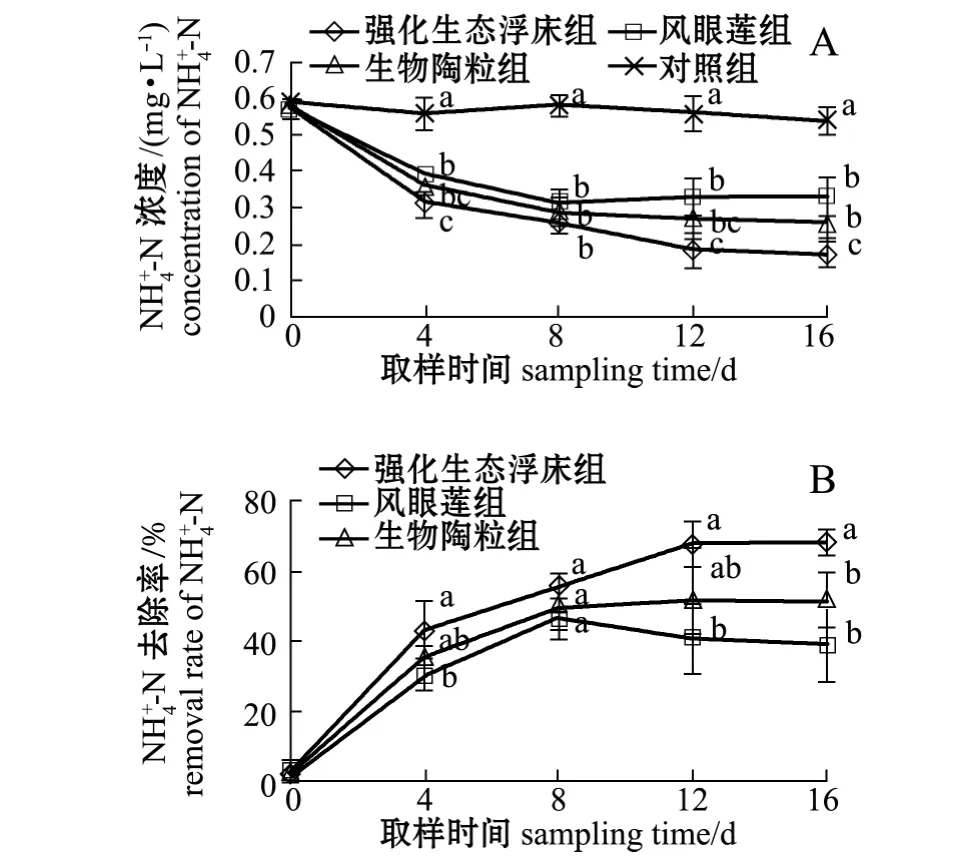
图3 各处理组-N浓度及去除率的变化Fig.3 Dynamic changes in-N concentration and removal rate in different groups
2.3 强化生态浮床对-N的净化效果
从图4-A可见:试验结束时,强化生态浮床组、凤眼莲组、生物陶粒组和对照组水体中-N浓度由开始时的 0.07 mg/L分别降至 0.01、0.03、0.03、0.06 mg/L;各处理组-N 浓度显著低于对照组 (P<0.05),同时强化生态浮床组-N浓度显著低于凤眼莲组及生物陶粒组 (P<0.05),而生物陶粒组与凤眼莲组无显著性差异(P>0.05)。从图4-B可见,试验结束时,强化生态浮床组对-N的去除率为77.05%,显著高于凤眼莲组 (52.46%)和生物陶粒组 (57.38%)(P<0.05)。
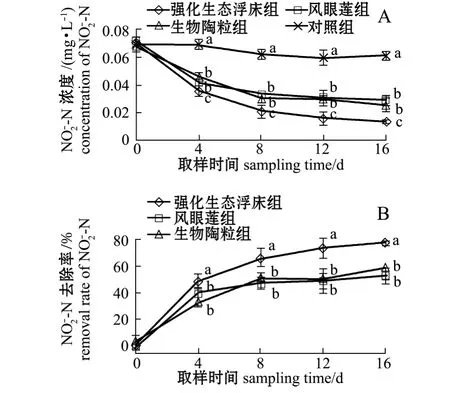
图4 各处理组-N浓度及去除率的变化Fig.4 Dynamic changes in-N concentration and removal rate in different groups
2.4 强化生态浮床对-N的净化效果
从图5可见:试验结束时,强化生态浮床组、凤眼莲组、生物陶粒组和对照组水体中-N浓度由开始时的0.43 mg/L分别升高至0.83、0.60、1.10、0.53 mg/L;强化生态浮床组、生物陶粒组-N浓度显著高于对照组 (P<0.05),凤眼莲组略高于对照组,但无显著性差异 (P>0.05)。
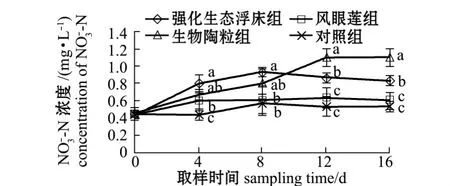
图5 各处理组-N浓度的变化Fig.5 Dynamic changes in-N concentration in different groups
2.5 强化生态浮床对TP的净化效果
从图6-A可见:试验结束时,强化生态浮床组、凤眼莲组、生物陶粒组水体中TP浓度由开始时的 0.36 mg/L 分 别 降 至 0.11、0.26、0.21 mg/L,而对照组由0.36 mg/L升高至0.37 mg/L;各处理组TP浓度显著低于对照组 (P<0.05),同时强化生态浮床组显著低于凤眼莲组及生物陶粒组(P<0.05),生物陶粒组显著低于凤眼莲组 (P<0.05)。在试验后期 (8~16 d),各处理组TP水平均能达到淡水养殖废水排放一级标准。从图6-B可见,试验结束时,强化生态浮床组对TP的去除率为71.17%,显著高于凤眼莲组(29.73%)和生物陶粒组(43.24%)(P<0.05)。
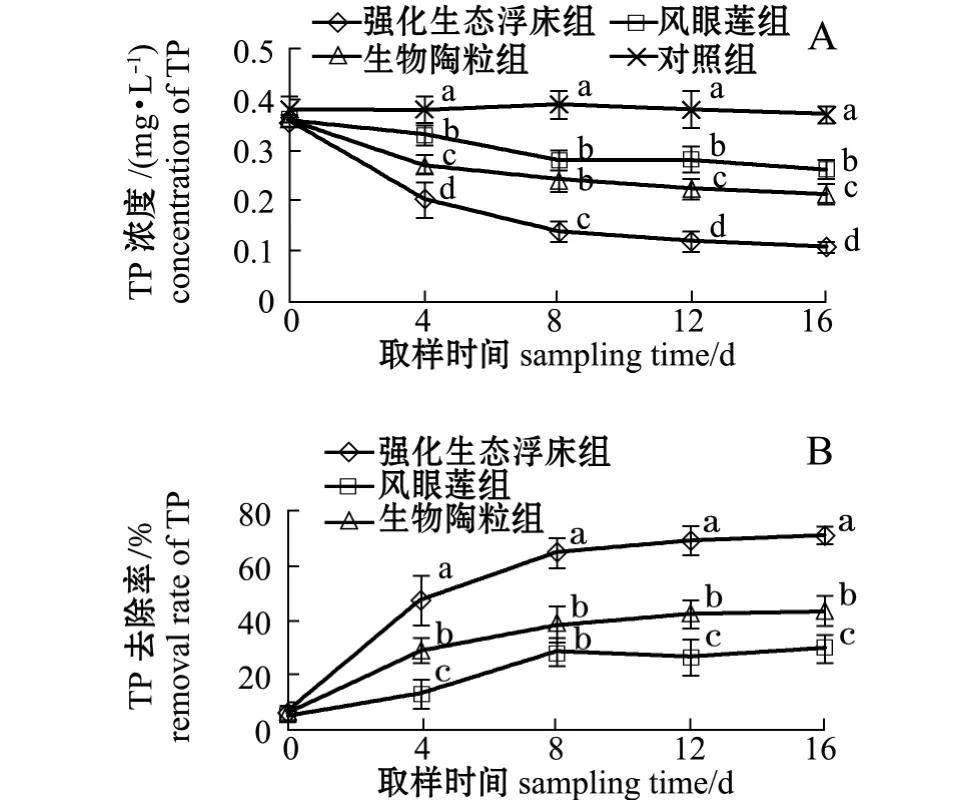
图6 各处理组TP浓度及去除率的变化Fig.6 Dynamic changes in TP concentration and removal rate in different groups
2.6 强化生态浮床对COD的净化效果
从图7-A可见:试验结束时,强化生态浮床组、凤眼莲组、生物陶粒组水体中COD浓度由开始时的69 mg/L分别下降至38、54、49 mg/L,对照组水体中COD浓度由开始时的69 mg/L升高至72 mg/L;各处理组COD浓度均显著低于对照组(P<0.05),同时强化生态浮床组COD浓度显著低于凤眼莲组及生物陶粒组 (P<0.05),而生物陶粒组与凤眼莲组无显著性差异 (P<0.05)。从图7-B可见,试验结束时,强化生态浮床组对COD的去除率为47.22%,显著高于凤眼莲组 (25.00%)和生物陶粒组 (31.94%)(P<0.05)。
2.7 强化生态浮床对DO的改善效果
从图8可见:对照组、生物陶粒组、凤眼莲组和强化生态浮床组水体中DO浓度由开始时的4.44 mg/L 分别上升至 4.49、5.91、5.73、6.76 mg/L,分别上升了 0.05、1.47、1.24、2.32 mg/L;各处理组DO浓度显著高于对照组 (P<0.05),同时强化生态浮床组DO浓度显著高于凤眼莲组及生物陶粒组 (P<0.05),而生物陶粒组与凤眼莲组无显著性差异 (P>0.05)。
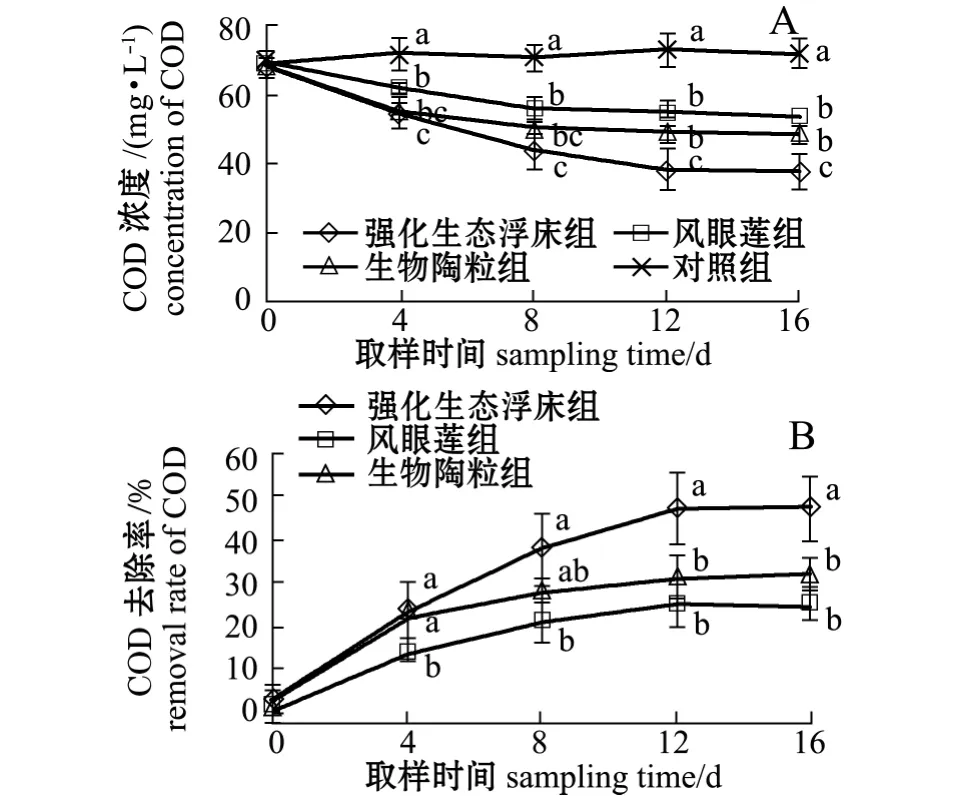
图7 各处理组COD浓度及去除率的变化Fig.7 Dynamic changes in COD concentration and removal rate in different groups
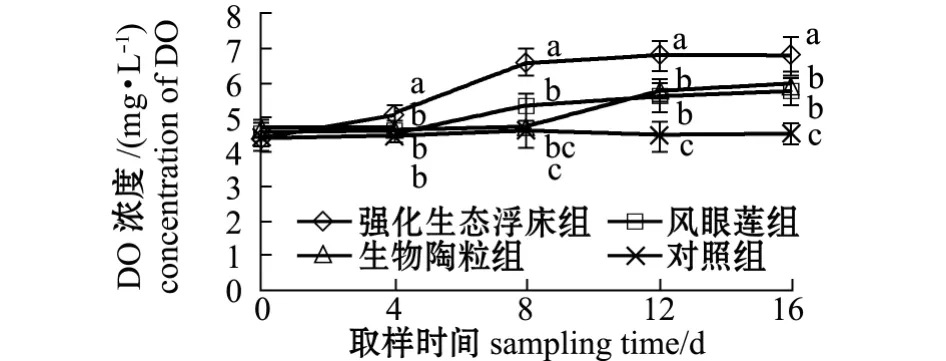
图8 各处理组DO浓度的变化Fig.8 Dynamic changes in DO concentration in different groups
3 讨论
本研究中,强化生态浮床对TP的去除率为71.17%,低于李威等[8]采用美人蕉与陶粒构建的组合浮床对TP的去除率 (95.82%),可能是因选取的水生植物不同所致。宋伟等[19]在研究几种植物净化能力的比较时发现,美人蕉除磷效果优于凤眼莲。本研究结果与张亚娟等[20]采用蕹菜-麻绳组合对TP的去除率 (71.70%)相近,高于其采用蕹菜-聚苯乙烯纤维绳组合对 TP的去除率(54.72%),推测可能是因选取的水生植物及人工介质不同所致。本试验中强化生态浮床对TP的去除率显著高于水生植物对照组、基质对照组和空白对照组,本研究结果与李威等[8]、张亚娟等[20]的研究结果一致,推测可能是强化生态浮床中除了生物陶粒吸附和凤眼莲吸收两种途径外,还与两者之间的协同作用有关。生物陶粒可以通过离子交换的方式与接触的可溶性磷发生吸附反应,在吸附接触的同时伴随着解吸的过程[21],并且在吸附和解吸过程中产生的吸附态磷及未吸附的可溶性磷可以很快变成Ca2-P,Ca2-P呈微沉淀状态,是一种最易被水生植物吸收的磷酸盐种类[22]。因此,在强化生态浮床中,生物陶粒不仅自身对TP有吸附作用,同时促进了凤眼莲对TP的吸收作用。
本研究结果表明,试验结束时,强化生态浮床对TN的去除率为48.57%,高于王国芳等[9]构建的组合型生态浮床对TN的去除率 (45.7%),与张亚娟等[20]采用蕹菜-聚苯乙烯纤维绳组合对TN的去除率 (49.46%)相近,但低于张亚娟等[20]采用蕹菜-麻绳组合对TN的去除率 (60.43%)及李威等[8]构建的组合生态浮床对 TN的去除率(64.03%),推测可能是试验条件差异所致。本研究中,经强化生态浮床净化后的水体中TN水平达到淡水养殖池塘排放水一级标准,表明本研究中构建的强化生态浮床能够对TN实现有效控制。同样强化生态浮床对-N、-N的去除率显著高于其他试验组,这与李威等[8]构建的组合生态浮床净化污水及虞中杰等[23]利用人工浮床加挂填料净化富营养河水的结果一致。推测可能是因强化生态浮床中凤眼莲、生物陶粒和微生物的相互促进作用,使该组净化效果明显优于其他试验组。凤眼莲除自身对TN有吸收作用外,发达的根系不仅扩大了微生物的附着面积[24],为微生物的生长、繁殖提供了良好的环境,同时还能分泌一些有机物质,直接或间接地促进微生物的新陈代谢[25-27],从而促进对N、P和COD等物质的去除。凤眼莲根系的泌氧作用也提高了水体中的溶氧含量,为硝化细菌提供了良好的好氧环境,吴海明等[28]研究表明,-N的去除率与水体中DO含量呈正相关关系。
4 结论
(1)利用凤眼莲与生物陶粒构建的强化生态浮床,16 d时对养殖水体中TN、-N、-N、TP、COD的去除率分别达到 48.57%、68.52%、77.05%、71.17%、47.22%,均显著高于凤眼莲组和生物陶粒组 (P<0.05)。
(2)经强化生态浮床净化后的养殖水体中,TN、TP水平分别达到淡水池塘养殖排放水一级标准,-N浓度降至0.20 mg/L以下,-N浓度降至0.01 mg/L以下,均显著低于凤眼莲组、生物陶粒组和对照组 (P<0.05)。
(3)强化生态浮床对TN、TP的去除率显著高于凤眼莲组和生物陶粒组,说明凤眼莲吸收、生物陶粒吸附和微生物的协同作用提高了生态浮床对污染物的去除效果,本研究结果可为构建适宜养殖水体净化的强化生态浮床提供基础数据。
[1]Wu Q T,Gao T,Zeng S C,et al.Plant-biofilm oxidation ditch for in situ treatment of polluted waters[J].Ecological Engineering,2006,28(2):124-130.
[2]Li W,Friedrich R.In situ removal of dissolved phosphorus in irrigation drainage water by planted floats:preliminary results from growth chamber experiment[J].Agriculture Ecosystems & Environment,2002,90(1):9-15.
[3]范洁群,邹国燕,宋祥甫,等.不同类型生态浮床对富营养河水脱氮效果及微生物菌群的影响[J].环境科学研究,2011,24(8):850-856.
[4]黎华寿,聂呈荣,方文杰,等.浮床栽培植物生长特性的研究[J].华南农业大学学报:自然科学版,2003,24(2):12-15.
[5]卢进登,帅方敏,赵丽娅,等.人工生物浮床技术治理富营养化水体的植物遴选[J].湖北大学学报:自然科学版,2005,27(4):402-404.
[6]李猛,马旭洲,王武,等.大薸对网箱养殖长吻鮠生长及氮、磷排放的影响[J].大连海洋大学学报,2012,27(5):402-406.
[7]李先宁,宋海亮,朱光灿,等.组合型浮床生态系统的构建及其改善湖泊水源地水质的效果[J].湖泊科学,2007,19(4):367-372.
[8]李威,陈晓国,方涛.组合生态浮床的水体净化效果与作用机理探讨[J].水生态学杂志,2012,33(6):76-81.
[9]王国芳,汪祥静,吴磊.组合型生态浮床中各生物单元对污染物去除的贡献及净化机理[J].水土建筑与环境工程,2012,34(4):136-141.
[10]戴栋超,黄延林,王震,等.生态组合技术净化景观水体试验研究[J].西安建筑科技大学学报:自然科学版,2006,38(6):786-789.
[11]Gersberg R M,Elkins B V,Lyon S R,et al.Role of aquatic plants in wastewater treatment by artificial wetland[J].Water Research,1986,20(3):363-368.
[12]Tchobanoglous G.Aquatic plant system for wastewater treatment:engineering considering[C]//Aquatic plants for wastewater and resource recovery.Orlando:Magnolia Publishing Inc,1987:27-29.
[13]方云英,杨肖娥,常会庆,等.利用水生植物原位修复污染水体[J].应用生态学报,2008,19(2):407-412.
[14]张金锋,施雪良,郭敏晓.凤眼莲和梭鱼草对水体净化能力的初步研究[J].安徽农业科学,2008,36(28):12167-12168.
[15]王锦旗,郑有飞,宋玉芝,等.不同盖度凤眼莲对2种水流模式下水体净化效果比较[J].生态环境学报,2012,21(1):124-129.
[16]袁桂良,刘鹰.凤眼莲对集约化甲鱼养殖污水的静态净化研究[J].农业环境保护,2001,20(5):322-325.
[17]周阳,陈有光,段登选,等.凤眼莲漂浮密度与净化能力的研究[J].渔业现代化,2008,35(4):32-35.
[18]田功太,刘飞,段登选,等.EM菌对海参养殖水体主要污染物净化效果的研究[J].山东农业大学学报,2012,43(3):381-386.
[19]宋伟,周庆,王彦玲,等.几种植物净化能力的比较及浮床应用效果研究[J].江苏农业科学,2010(5):474-477.
[20]张亚娟,刘存歧,王军霞,等.植物-生物绳组合生态浮床对富营养化水体的净化效果[J].重庆师范大学学报:自然科学版,2012,29(3):31-36.
[21]王世和.人工湿地污水处理理论与技术[M].北京:科学出版社,2007.
[22]沈仁芳,蒋柏藩.石灰性土壤无机磷的形态分布及其有效性[J].土壤学报,1992,29(1):80-86.
[23]虞中杰,王东启,陈振楼,等.人工浮床加挂填料对富营养化河水的净化效果[J].中国给水排水,2011,27(17):31-35.
[24]汪敏,郑师章.凤眼莲与其根际细菌相互作用的研究[J].应用生态学报,1994,5(3):309-313.
[25]乐毅全,郑师章,周纪伦.凤眼莲根际微生物在污水处理中的应用[J].城市环境与城市生态,1988,1(1):17-19.
[26]梁晶晶.复合微生物和水生植物联合修复富营养化水体的研究[D].宁波:宁波大学,2009:43-50.
[27]胡智勇.几种水生植物根际微生物的数量动态及其协同去污能力的初步研究[D].宁波:宁波大学,2009:26-35.
[28]吴海明,张建,李伟江,等.人工湿地植物泌氧与污染物降解耗氧关系研究[J].环境工程学报,2010,4(9):1973-1977.
[29]常会庆,李娜,徐晓峰.三种水生植物对不同形态氮素吸收动力学研究[J].生态环境,2008,17(2):511-514.
