低湿度表面的海洋附着细菌对厚壳贻贝附着的影响
2015-02-17周轩郭行磐陈芋如李家乐杨金龙
周轩,郭行磐,陈芋如,李家乐,杨金龙
(上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海高校知识服务平台上海海洋大学水产动物遗传育种中心,上海201306)
厚壳贻贝Mytilus coruscus为中国重要的贝类养殖品种和主要的筏式养殖贝类品种,其分布于黄海、渤海和东海沿岸[1],其中以浙江沿海资源量最大。近年来,因过度采捕导致厚壳贻贝自然资源逐渐减少,自然海区附苗数量和质量明显下降,厚壳贻贝养殖产业也受到严重影响。目前,厚壳贻贝规模化人工繁殖技术一直未得到很好的解决,育苗数量不稳定,导致苗种供不应求[2]。厚壳贻贝幼虫在完成浮游生活阶段后,附着变态成为稚贝,最终发育为成贝[3]。与许多其他海洋无脊椎动物不同,当环境变化时,贻贝稚贝能够自行切断足丝,开始爬行并重新选择附着基进行再次附着。
在海洋环境中,微生物被膜存在于几乎所有固体附着基质的表面[4]。海洋细菌黏附到基质表面并分泌胞外产物,从而形成细菌黏膜,是微生物被膜形成的关键阶段,在海洋无脊椎动物幼虫的附着变态发育过程中发挥重要作用。附着基质的表面湿度影响海洋细菌的附着、微生物被膜的形成和海洋无脊椎动物幼虫的附着[5-6]。然而,形成于低湿度表面的海洋细菌对稚贝附着影响的研究鲜有报道。本研究中,从硅烷化处理后的载玻片上形成的自然微生物被膜中分离和纯化海洋附着细菌,研究了单一菌株形成的微生物被膜对厚壳贻贝稚贝附着的影响,同时构建系统发育树,分析其遗传距离与贻贝附着的相互关系,查明厚壳贻贝稚贝附着行为与海洋细菌的关系,旨在为进一步研究厚壳贻贝稚贝的附着机制提供参考依据。
1 材料与方法
1.1 材料
试验用厚壳贻贝稚贝取自浙江嵊泗县东海贻贝科技创新服务有限公司,壳长为 (1.80±0.05)mm,壳高为 (1.17±0.03)mm,在实验室内暂养1周后用于试验。暂养期间,温度控制在18℃,充气培养,每天换水1次并投喂金藻。
试验用海洋细菌来源于浙江舟山嵊泗海域自然微生物被膜,利用ZoBell 2216E平板培养法分离纯化得到单株,进行试验。挂板所用载玻片经过二氯二甲基硅烷(Dichlorodimethylsilane,DMS)(Sigma公司)处理。
1.2 方法
1.2.1 海洋细菌的分离 参考 Yang等[7]的方法,使用无菌载玻片将微生物被膜从载玻片表面刮至灭菌过滤海水 (AFSW)中,形成悬浮液。经倍比稀释后,滴适量涂布于ZoBell 2216E琼脂平板上,在25℃、黑暗条件下培养48 h后,挑取菌落,在平板上反复划线分离纯化,得到纯种菌株,并在15%的甘油溶液 (用体积分数为0.9%的生理盐水配制)中保存 (-80℃)备用。
1.2.2 细菌16S rRNA基因序列的鉴定
(1)DNA提取。将海洋细菌加入到100 μL无菌蒸馏水中,用细菌基因组DNA抽提试剂盒 (上海博彩生物科技有限公司)提取。
(2)PCR扩增。采用细菌16S rDNA序列通用引物进行扩增,引物为27F(5'AGAGTTTGATCCTGGCTCAG 3')和1492R(5'GGTTACCTTGTTACGACTT 3')。扩增总体系 (共25 μL):模板DNA 2 μL,4×dNTPs(10 μmol/L)0.5 μL,Taq DNA 聚合酶(5 U/μL)0.2 μL,引物(20 pmol/μL)各 0.5 μL,10×扩增缓冲液 (含 Mg2+)2.5 μL,用ddH2O补足至25 μL。PCR反应在银制梯度PCR仪 (Eppendorf公司)上进行。PCR扩增条件:94℃下预变性5 min;94℃下变性30 s,55℃下退火30 s,每一循环递减0.5℃,72℃下延伸2 min,共进行35个循环;最后在72℃下延伸8 min,于-20℃下保存备用。PCR扩增产物用10 g/L琼脂糖凝胶电泳进行检验。PCR扩增产物经上海迈浦生物技术有限公司测序,获得的序列通过Blast 程 序 与 GENEBAN(http://www.ncbi.nlm.nih.gov/)中核酸数据进行比对,确定其菌名。
1.2.3 序列比对和系统发育分析 将得到的序列与有亲缘关系的序列在Mega 5.05软件的CLUSTALW程序上进行分析。使用Mega 5.05软件的邻接法 (NJ)、最大简约法 (MP)和最小进化分析法 (1000次重复)构建进化树。用Jukes-Cantor方法计算遗传距离。从NCBI GenBank数据库中得到Escherichia coli(序列号 AONF01000005.1)作为外群序列,用于构建细菌系统发育树。
1.2.4 微生物被膜的制备 参考Yang等[7]的方法,挑取纯种菌株到100 mL ZoBell 2216E液体培养基上,在25℃、黑暗条件下扩大培养48 h后,离心洗涤 (1600 g,15 min)浓缩到50 mL并制成悬浮液。用0.1%吖啶橙染色5 min,在1000倍荧光显微镜(奥林巴斯BX51)下随机选取10个点进行计数,确定细菌总密度。先将载玻片放入灭菌培养皿 (Φ64 mm×19 mm)中,随后添加细菌,通过无菌海水定容至20 mL,每株细菌的初始密度分别为 1×106、3×106、5×106、10×106cells/mL,18℃、黑暗条件下培养48 h后形成微生物被膜。
1.2.5 细菌密度的计数 微生物被膜被固定在体积分数为5%的福尔马林溶液中。固定后的微生物被膜经AFSW 清洗3次,用0.1%吖啶橙染色5 min后,在1000倍荧光显微镜下随机选取10个点进行计数,确定不同初始密度的细菌最终形成微生物被膜的终密度。
1.2.6 稚贝附着试验 在每个灭菌培养皿中加入20 mL AFSW,并放入1个附有微生物被膜的载玻片和10枚稚贝。在试验的12 h和24 h时,记录稚贝的附着率,即载玻片上附着的稚贝个数占该培养皿中稚贝总个数的百分比。每株细菌设置9个平行组,以空白载玻片作为对照,每次试验设置3个空白对照组,均在18℃、黑暗条件下进行试验。
1.3 数据处理
细菌诱导附着的活性用附着率表示,将百分比数据进行反正弦转化。在统计分析之前,所有的数据均进行正态性检验。如不满足正态性分布,则通过Kruskal-Wallis Test进行评估检验。同时,进行相关性检验。采用JMP 10.0.0软件进行统计分析,显著性水平设为0.05。
2 结果与分析
2.1 不同海洋细菌对厚壳贻贝稚贝附着的影响
表1为试验过程中所使用的海洋细菌。9株细菌在试验12 h和24 h时对厚壳贻贝稚贝附着的诱导结果基本相似,因此,本研究中仅列出12 h的诱导效果,其结果如图1所示。空白对照组稚贝的附着率仅为17%±3%,与空白对照组相比,所有测试菌株均显著诱导厚壳贻贝稚贝附着 (P<0.05)。从图 1可见:Bacillus sp.2的诱导活最高性,其附着率最高为68%±2%;Nautella sp.1的诱导活性最低,其附着率最高为38%±3%;其余7株细菌表现出中等程度的诱导活性。

表1 海洋细菌16S rDNA基因序列分析Tab.1 16S rDNA gene sequence analysis of the marine bacterial strains

图1 不同海洋细菌对厚壳贻贝稚贝附着的诱导作用Fig.1 Percentages of settlement of juvenile mussel Mytilus coruscus on the nine monospecific bacterial biofilms
2.2 细菌终密度对稚贝附着率的影响
不同微生物被膜终密度对稚贝附着的影响如图2所示。从图 2可见:Bacillus sp.2在 9.0×106cells/cm2低密度时呈现出最高诱导活性,而在高密度时诱导活性显著下降 (P<0.05)。同样,Alteromonas sp.1 在 1.3×107cells/cm2高密度时,其诱导的稚贝附着率显著下降 (P<0.05)。稚贝附着与细菌终密度之间的关系如表2所示。从表2可见:除Pseudoalteromonas sp.3的终密度与稚贝附着率无显著相关性外 (P>0.05),其余8株海洋细菌终密度与稚贝附着率均显著相关 (P<0.05)。
2.3 初始细菌密度对微生物被膜形成的影响
初始细菌密度对微生物被膜形成的影响如图3所示。从图 3可见:初始细菌密度为 1×106cells/mL时,Bacillus sp.2形成微生物被膜的终密度最高;初始细菌密度为3×106cells/mL时,Acinetobacter sp.1形成微生物被膜的终密度最高;初始细菌密度为5×106cells/mL时,Microbacterium sp.1形成微生物被膜的终密度最高;初始细菌密度为10×106cells/mL 时,Pseudoalteromonas sp.2形成微生物被膜的终密度最高。在4种初始密度下,Pseudoalteromonas sp.1形成微生物被膜的终密度均为最低。
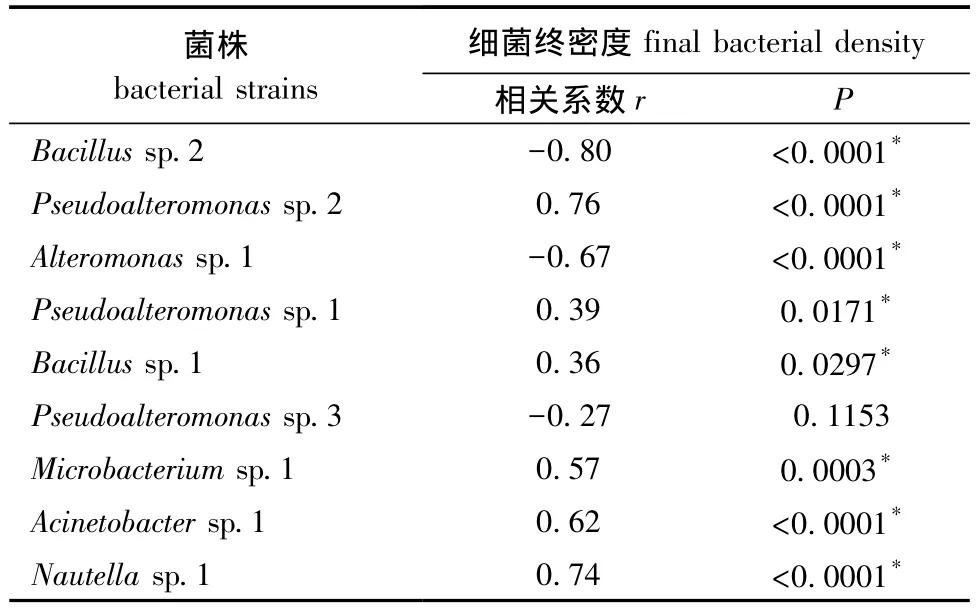
表2 细菌终密度与诱导活性的相关性分析Tab.2 Correlation analysis between the final bacterial density and inducing activity in biofilms
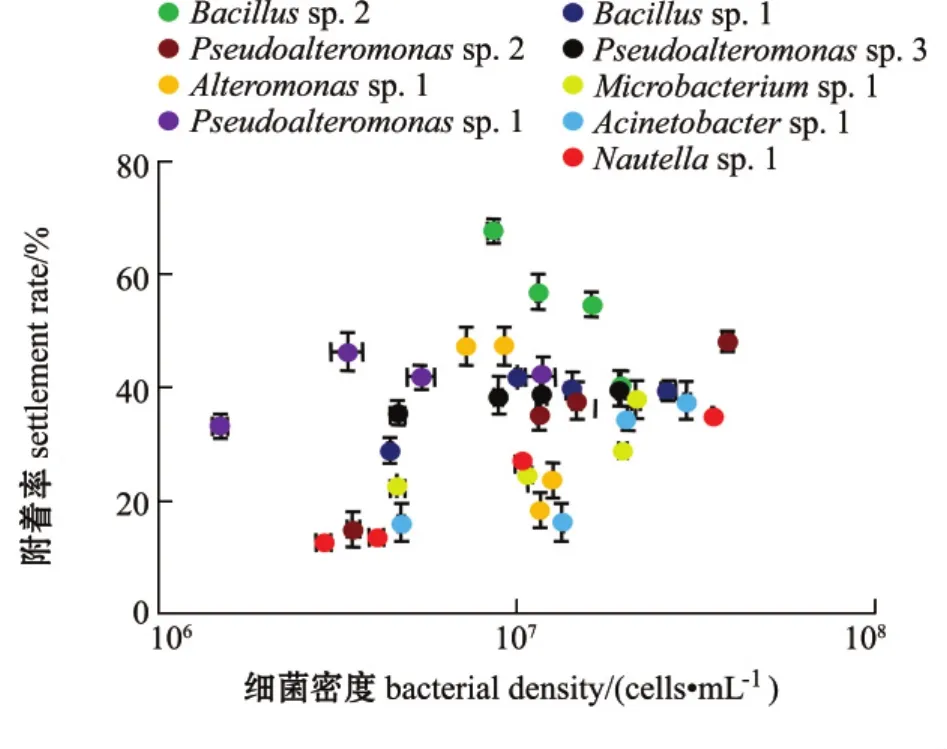
图2 单一菌株形成微生物被膜的终密度对厚壳贻贝稚贝附着的诱导作用Fig.2 Percentages of settlement of juvenile mussel Mytilus coruscus on monospecific bacterial biofilms at various densities
2.4 海洋细菌的序列比对和系统发育分析
采用不同的方法和模式进行系统发育分析,测试菌株16S rDNA序列的系统发育树如图4所示。Pseudoalteromonas sp.1 与 Alteromonas sp.1 之间的遗传距离为0.109,分属于两个不同的属,都表现出中等程度的诱导活性。相反,Bacillus sp.2和Bacillus sp.1之间的遗传距离只有0.074,同属于芽孢杆菌属,但前者的诱导活性显著高于后者 (P<0.05)。 同 时, Pseudoalteromonas sp.1、Pseudoalteromonas sp.2 和 Pseudoalteromonas sp.3 两两之间的遗传距离最大为0.004,属于假交替单胞菌属,均表现出中等程度的诱导活性,但形成微生物被膜的终密度差异较大。
3 讨论
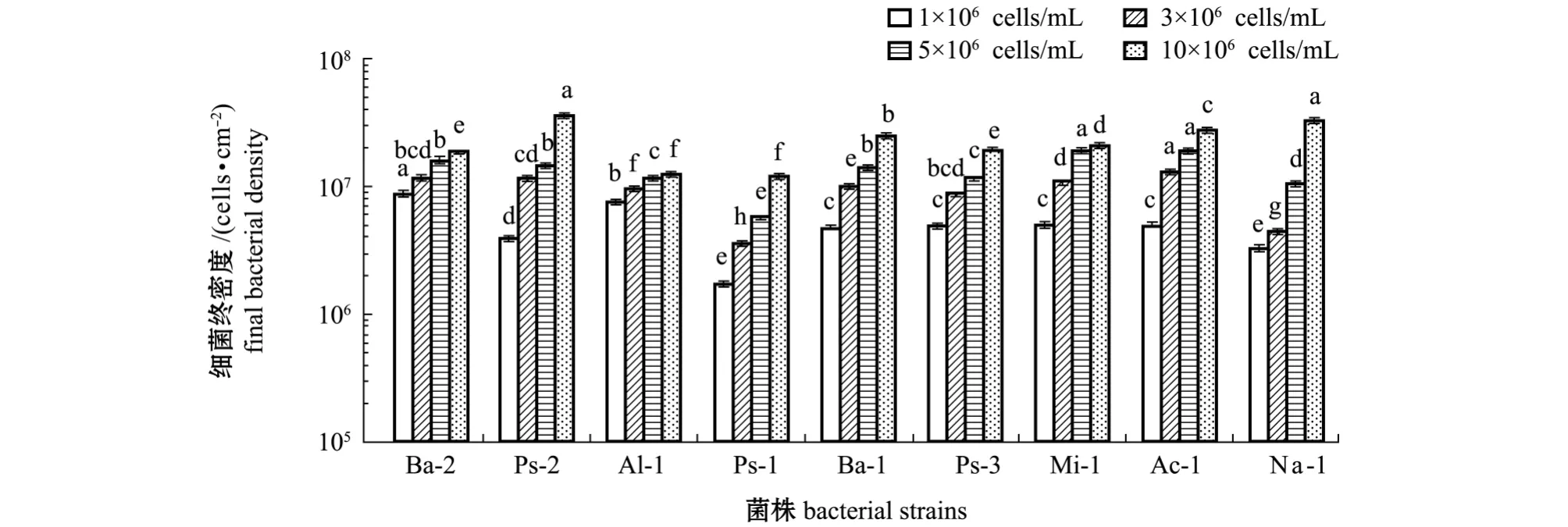
图3 不同初始细菌密度下形成微生物被膜的终密度变化 (n=30)Fig.3 Density of monospecific bacterial biofilms under different initial densities(n=30)
许多海洋无脊椎动物幼体选择在具有一定理化性质的附着基表面进行附着[5-6],附着基的材质、表面粗糙度、表面湿度、表面张力、微貌结构等特性对海洋无脊椎动物附着均有不同程度的影响[5]。然而,以往研究主要集中在附着基质表面性质与海洋无脊椎动物的附着关系,而关于附着基质表面形成微生物被膜的研究鲜有报道。海洋细菌能够通过形成微生物被膜而改变附着基表面的理化性质,从而在海洋无脊椎动物幼虫附着过程中发挥重要的调控作用[8-11]。本研究中首次证明,来源于低湿度表面的海洋细菌能够有效诱导厚壳贻贝稚贝的附着。
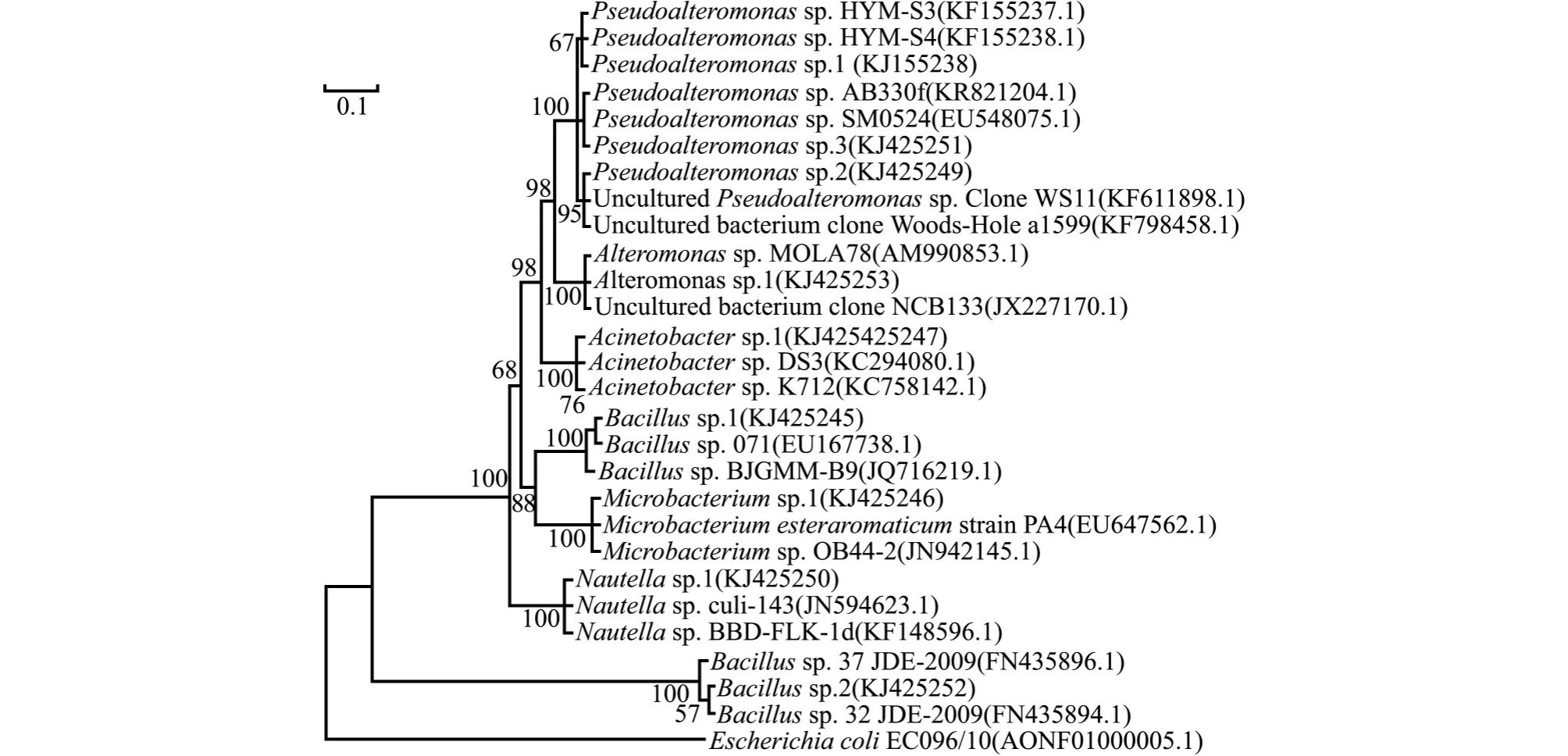
图4 细菌16S rDNA基因序列的系统进化树Fig.4 Phylogenetic tree of 16S rDNA gene sequences from bacterial isolates using the Neighbor-Joining method and the Jukes-Cantor model
附着细菌是海洋微生物被膜的重要构成生物之一。以往研究发现,细菌密度与一些海洋无脊椎动物幼虫附着相关。在自然微生物被膜中,Wang等[12]研究表明,微生物被膜中的附着细菌密度与厚壳贻贝幼虫的附着显著相关。在对单一菌株的研究中,Huang等[13]分析了细菌密度对微生物被膜形成的影响,并探讨了其对华美盘管虫Hydroides elegans幼虫附着的影响,研究结果表明,单一菌株形成微生物被膜的最终密度与细菌初始密度显著相关,且与该幼虫的附着变态显著相关。然而,Tran等[14]研究表明,尽管初始细菌密度影响所形成单一菌株微生物被膜的最终密度,但仅1株高诱导活性菌株的密度与鹿角杯形珊瑚Pocillopora damicornis幼虫附着显著相关,其他菌株的密度则与幼虫附着无相关性。本研究结果显示,初始细菌密度明显影响微生物被膜的最终密度,且5株海洋附着细菌的终密度与厚壳贻贝稚贝附着呈正相关,4株呈负相关,仅1株细菌的终密度与稚贝附着无相关性。由此可见,细菌密度与厚壳贻贝稚贝的附着有着密切的联系。本研究结果还表明,海洋细菌形成微生物被膜的诱导活性并非随细菌密度的升高而逐渐升高,而均在最适密度下活性达到最大,随后下降,这表明特定细菌存在一个阈值效应,且微生物被膜中细菌密度与诱导活性之间的线性关系取决于特定的菌株。本研究结果与Yang等[7]对细菌密度与厚壳贻贝幼虫附着关系的研究结果极为相似。研究表明,海洋细菌中的化学信号物质参与了贻贝幼虫的附着过程[7,15],而本研究中厚壳贻贝稚贝附着同样可能与特定菌株分泌的化学诱导信号物质有关,这需要进一步地研究证实。
海洋细菌种属也与海洋无脊椎动物幼体附着有密不可分的关系。Bao等[16]在研究交替单胞菌Alteromonas sp.1对地中海紫贻贝 Mytilus galloprovincialis幼虫附着变态时,发现此菌对紫贻贝幼虫有显著的诱导活性,且来源于该菌中的化学信号物质参与了幼虫的附着变态过程。本研究结果也表明,该菌属对厚壳贻贝稚贝具有诱导活性。由此推测,该菌对不同种属贻贝附着均有一定程度的诱导活性,这一菌属均可分泌不同化学信号物质来促进贻贝附着,然而其具体作用机理有待进一步研究。另外,本试验中同属于芽孢杆菌属的Bacillus sp.2和Bacillus sp.1对厚壳贻贝稚贝的诱导活性显著不同,而不同属的 Pseudoalteromonas sp.1和 Alteromonas sp.1对厚壳贻贝稚贝的诱导活性相似,此结果符合Yang等[7]的研究结论,即海洋无脊椎动物幼虫的附着变态与细菌种属无特定关联。但是假交替单胞菌属的3株细菌均表现出中等诱导活性,又与此结论相悖,所以这进一步证实了海洋细菌对厚壳贻贝稚贝附着的诱导作用与细菌种属无必然联系,可能与它们分泌的胞外代谢产物的种类以及形成微生物被膜的具体结构相关[15,17]。
附着基表面湿度能够影响细菌群落的构成。Huggett等[18]研究表明,低表面湿度附着基对附着其上的表面细菌群落有一定的影响,从而抑制华美盘管虫幼虫的附着。本研究中,9种海洋细菌均从低湿度表面形成的微生物被膜中分离所得,研究结果表明,细菌对厚壳贻贝稚贝附着的诱导活性都比较高且与表面湿度的关系不明显。这与Yang等[7]从自然微生物被膜和贻贝贝壳等不同表面分离的细菌对厚壳贻贝幼虫附着变态影响的研究结果一致。
综上所述,从低湿度附着基表面分离的海洋细菌形成单一菌株的微生物被膜能够有效促进厚壳贻贝稚贝的附着,附着率与细菌密度显著相关,但与细菌的种属无显著相关性。本研究成果对于今后阐明厚壳贻贝附着机制的研究具有重要的理论意义。
[1]常亚青.贝类增养殖学[M].北京:中国农业出版社,2007.
[2]常抗美,吴剑锋.厚壳贻贝人工繁殖技术的研究[J].南方水产,2007,3(3):26-30.
[3]李太武.海洋生物学[M].北京:海洋出版社,2013:172-210.
[4]Wahl M,Goecke F,Labes A,et al.The second skin:ecological role of epibiotic biofilms on marine organisms[J].Front Microbiol,2012,3:1-21.
[5]Dürr S,Thomason J C.Biofouling[M].Oxford(UK):Wiley-Blackwell,2010.
[6]Carl C,Poole A J,Sexton B A,et al.Enhancing the settlement and attachment strength of pediveligers of Mytilus galloprovincialis by changing surface wettability and microtopography[J].Biofouling,2012,28:175-186.
[7]Yang J L,Shen P J,Liang X,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to monospecific bacterial biofilms[J].Biofouling,2013,29:247-259.
[8]Ganesan A M,Alfaro A C,Brooks J D,et al.The role of bacterial biofilms and exudates on the settlement of mussel(Perna canaliculus)larvae[J].Aquaculture,2010,306:388-392.
[9]Huggett M J,Williamson J E,Kjelleberg E,et al.Larval settlement of the common Australian sea urchin Heliocidaris erythrogramma in response to bacteria from the surface of coralline algae[J].Oecologia,2006,149:604-619.
[10]Hadfield M G.Biofilms and marine invertebrate larvae:what bacteria produce that larvae use to choose settlement sites[J].Ann Rev Mar Sci,2011,3:453-470.
[11]Lau S C K,Thiyagarajan V,Qian P Y.The bioactivity of bacterial isolates in Hong Kong waters for the inhibition of barnacle(Balanus amphitrite Darwin)settlement[J].J Exp Mar Biol Ecol,2003,282(1/2):43-60.
[12]Wang C,Bao W Y,Gu Z Q,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to natural biofilms[J].Biofouling,2012,28(3):249-256.
[13]Huang S,Hadfield M G.Composition and density of bacterial biofilms determine larval settlement of the polychaete Hydroides elegans[J].Mar Ecol Prog Ser,2003,260:161-172.
[14]Tran C,Hadfield M G.Larvae of Pocillopora damicornis settle and metamorphose in response to surface-biofilm bacteria[J].Mar Ecol Prog Ser,2011,433:85-96.
[15]Chung H C,Lee O O,Huang Y L,et al.Bacterial community succession and chemical profiles of subtidal biofilms in relation to larval settlement of the polychaete Hydroides elegans[J].ISME J,2010,4:817-828.
[16]Bao W Y,Yang J L,Satuito C G,et al.Larval metamorphosis of the mussel Mytilus galloprovincialis in response to Alteromonas sp.1:evidence for two chemical cues[J].Mar Biol,2007,152:657-666.
[17]Scardino A J,Guenther J,de Nys R.Attachment point theory revisited:the fouling response to a microtextured matrix[J].Biofouling,2008,24:45-53.
[18]Huggett M J,Nedved B T,Hadfield M G.Effects of initial surface wettability on biofilm formation and subsequent settlement of Hydroides elegans[J].Biofouling,2009,25:387-399.
