两种降温模式的低温胁迫对刺参抗氧化酶活性及丙二醛含量的影响
2015-02-17沙飞常亚青丁君
沙飞,常亚青,丁君
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
刺参Apostichopus japonicus隶属于棘皮动物门Echinodermata、海参纲Holothuroidea、楯手目Aspidochirotida、刺参科 Stichopodidae,产于辽宁、山东、河北等北方沿海地区,是中国食用海参中质量最好的一种,其营养价值最高且药用价值广泛,占海参养殖总量的95%以上[1]。温度是影响刺参生长、摄食、繁殖发育和分布的重要因子之一[2],温度胁迫可造成机体自由基代谢紊乱,体内大量积累的自由基会损害机体细胞和组织正常的生理机能和免疫防御能力,进而提高对病原生物的易感性[3]。目前,对刺参耐受温度的研究主要集中在低温对刺参生理生态的影响和高温对刺参生理生化指标及夏眠的影响[4-7]。低温对刺参影响的研究中,在生理生化水平方面,已有关于降温对刺参可溶性蛋白、可溶性糖和非特异性免疫酶的研究报道[8-9];在分子水平方面,已通过抑制性消减杂交技术,成功构建了包含免疫、应激和营养运输相关基因在内的刺参低温骤降双向消减cDNA文库。
本研究中,将以机体内清除活性氧自由基的两种关键酶类超氧化物歧化酶 (Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)和脂类物质氧化应激的最终产物丙二醛 (Malondialdehyde,MDA)为测量指标,在先前研究的基础上,对缓降及骤降低温胁迫后的刺参再次进行低温处理,分析不同降温模式的温度胁迫下,刺参体腔液中抗氧化酶及氧化产物的变化情况,根据低温胁迫后的刺参抗氧化系统对低温环境的响应情况,推测其对低温环境的适应性,以期为增强刺参在低温环境下的生理生化调节能力及免疫防护提供理论依据,并为刺参耐低温品系的筛选提供参考。
1 材料与方法
1.1 材料
试验用刺参于2013年10月购于大连某养殖场,210头刺参皆为自然生长个体,规格为(107.48±23.28)g。
将刺参暂养于大连海洋大学农业部北方海水增养殖重点实验室,温度为16℃,每天换水1次,连续充气。暂养1周后,每天将水温降低1℃,降至8℃时,放入试验水槽中 (70 L白色方形槽)。用组合式冷库 (最低工作温度为-18℃,可容纳20个70 L白色方形水槽)控制试验所需水温。
1.2 方法
1.2.1 试验设计
(1)缓降低温胁迫试验。降温模式为温度从8℃缓慢降到0℃,降温路线为:8℃→6℃→4℃→2℃→0℃,每个梯度降温24 h,维持24 h。
(2)骤降低温胁迫试验。降温模式和降温路线同缓降,每个梯度降温1.5 h,维持12 h。
经过两种不同降温模式的低温胁迫后,将水温缓慢升至室温 (16℃),暂养恢复两周。将恢复后的刺参及对照组 (室温)刺参同时置于0℃试验水槽中进行对比试验,试验维持一周。试验期间不投饵料不换水。
1.2.2 样品的处理及测定 分别于低温胁迫前、低温胁迫结束、2周恢复试验结束和1周对比试验结束时抽取刺参体腔液,分装于200 μL灭菌离心管中,于液氮中迅速冷却后储存于超低温冰箱(-80℃)中,用于SOD、CAT酶活力和MDA含量的测定。刺参体腔液以3000 r/min离心10 min,取上清液,每个待测样品均设3个重复。SOD、CAT酶活力和MDA含量均采用试剂盒 (南京建成生物研究所)检测,使用 Epoch酶标仪 (美国Biotek公司)测定酶活力。
1.3 数据处理
利用Excel和SPSS 17.0软件对试验数据进行统计分析,组内5个不同处理时期之间的酶活力及MDA含量差异采用单因素方差分析 (One-Way ANOVA)和Duncan多重比较,对组间相同时期的酶活力及MDA含量差异进行t检验,显著性水平设为 0.05。
2 结果与分析
2.1 不同模式的低温胁迫后刺参体腔液中的CAT活力
缓降模式下,低温胁迫过程中刺参体腔液中CAT活力在各时期的变化整体呈先升高后降低的趋势。从图1可见:低温胁迫后较低温胁迫前刺参体腔液中CAT活力有所升高,但差异不显著 (P>0.05),恢复 2周后,CAT活力显著上升 (P<0.05),达到29.745 U/mL;经过1周0℃对比试验后,低温胁迫组 CAT活力又显著降低 (P<0.05),低于此时未经过低温胁迫的对照组CAT活力 (20.777 U/mL)。
骤降模式下,低温胁迫过程中刺参体腔液中CAT活力在各时期的变化也呈先升高后降低的趋势。从图1可见:刺参体腔液中CAT活力经过低温胁迫后显著升高 (P<0.05),恢复2周后,CAT活力略有上升,但差异不显著 (P>0.05);经过1周0℃对比试验后,低温胁迫组CAT活力下降,但差异不显著性 (P>0.05),略低于此时未经过低温胁迫的对照组CAT活力 (23.392 U/mL)。
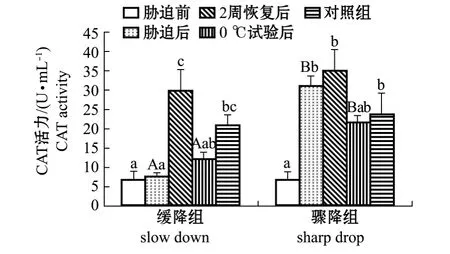
图1 不同模式的低温胁迫对刺参体腔液中CAT活力的影响Fig.1 Effects of different low temperature stress modes on CAT activity in coelomic fluid of sea cucumber Apostichopus japonnicus
缓降模式与骤降模式低温胁迫相比较,刺参在经过低温胁迫后,缓降组CAT活力显著低于骤降组 (P<0.05);经过1周0℃对比试验后,缓降组CAT活力仍显著低于骤降组 (P<0.05)。
2.2 不同模式的低温胁迫后刺参体腔液中的SOD活力
缓降模式下,低温胁迫过程中各时期刺参体腔液中SOD活性的变化整体呈先升高后降低再升高的趋势。从图2可见:低温胁迫后刺参体腔液中SOD活力略有升高 (P>0.05),恢复2周后,SOD活力略有降低 (P>0.05);经过1周0℃对比试验后,低温胁迫组 SOD活力有所升高 (P>0.05),低于此时未经过低温胁迫的对照组SOD活力(2.689 U/mL)。
骤降模式下,SOD活力在各时期呈现先降低后升高的趋势。从图2可见:低温胁迫后,刺参体腔液中SOD的活力下降到最低值 (0.401 U/mL),恢复2周后,SOD活力又有所升高 (P>0.05);经过1周0℃对比试验后,低温胁迫组SOD活力显著升高到最高值 (4.221 U/mL)(P<0.05),高于此时未经过低温胁迫的对照组SOD活力 (2.506 U/mL)。
缓降模式与骤降模式低温胁迫相比较,刺参在分别经过1周的0℃对比试验后,骤降组体腔液中SOD活力显著高于缓降组 (P<0.05)。
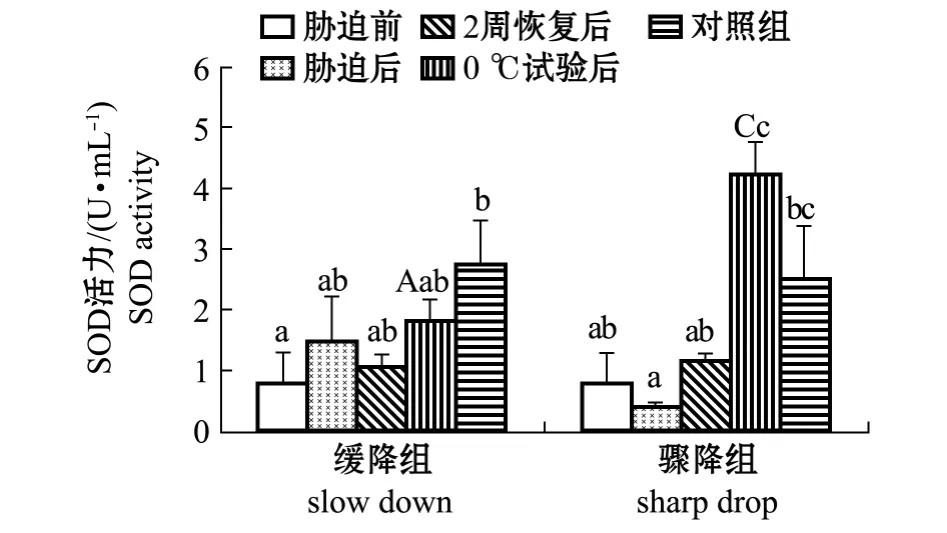
图2 不同模式的低温胁迫对刺参体腔液中SOD活力的影响Fig.2 Effects of different low temperature stress modes on SOD activity in coelomic fluid of sea cucumber Apostichopus japonnicus
2.3 不同模式的低温胁迫后刺参体腔液中的MDA含量
缓降模式下,刺参体腔液中MDA含量在不同时期的变化整体呈先升高后降低再升高的趋势。从图3可见:低温胁迫后,体腔液中MDA含量显著升高到最高值 (P<0.05),为0.922 nmol/mL,恢复2周后,MDA含量显著降低到最低值 (P<0.05),为0.328 nmol/mL;经过1周0℃对比试验后,低温胁迫组MDA含量又显著上升 (P<0.05),略低于此时未经过低温胁迫的对照组MDA含量 (0.879 nmol/mL)。
骤降模式下,刺参体腔液中MDA含量在各时期的变化也呈先上升后下降的趋势,与缓降模式相同。从图3可见:经过低温胁迫后,MDA含量显著上升到最高值 (P<0.05),为 0.782 nmol/mL,经过2周恢复后,MDA含量显著降低到最低值(P<0.05),为0.312 nmol/mL;经过1 周0 ℃对比试验后,低温胁迫组MDA含量略有上升,显著低于此时未经低温胁迫的对照组MDA含量 (0.854 nmol/mL)。
缓降模式与骤降模式低温胁迫相比较,刺参在分别经过1周的0℃对比试验后,其体腔液中MDA含量相比有显著性差异 (P<0.05)。

图3 不同模式的低温胁迫对刺参体腔液中MDA含量的影响Fig.3 Effects of different low temperature stress modes on MDA content in coelomic fluid of sea cucumber Apostichopus japonnicus
3 讨论
3.1 缓降及骤降低温胁迫对刺参体腔液中CAT、SOD酶活力的影响
SOD是体内活性氧自由基清除剂,可使细胞免受氧化伤害并防止机体衰老;CAT能够与过氧化氢体及线粒体结合,清除细胞代谢产生的H2O2,从而防止羟基自由基的产生。SOD及CAT都是棘皮动物重要的抗氧化酶。孔祥会等[10]对锯缘青蟹低温驯化的研究表明,锯缘青蟹鳃中CAT和SOD活性随驯化温度的降低而升高。本研究中,经缓降模式的低温胁迫后,刺参体腔液中CAT及SOD活力均有所增强,与前者研究结果相一致。有研究表明,机体在应对环境变化过程中会引发体内抗氧化酶的积极响应,以此应对自由基对机体的胁迫。本研究中,在2周恢复期后,缓降组CAT活力相对胁迫后显著提高 (P<0.05),SOD活力略微下降(P>0.05),但仍高于低温胁迫前。
骤降模式低温胁迫后,刺参体腔液中CAT活力相对胁迫前显著增加 (P<0.05),与缓降组同时期相比也有显著增加 (P<0.05),可能是由于缓降的每个温度梯度处理时间相对较长,当抗氧化酶难以抵御不断积累的氧自由基所导致的氧化损伤时,机体的抗氧化酶活力将会降低[11];骤降模式低温胁迫后,刺参体腔液中SOD活力相对胁迫前下降,分析其原因可能是SOD、CAT同为抗氧化酶类,当SOD被抑制后,CAT活力就会显著提高,两种抗氧化酶活力变化的不一致性与二者在功能上的相对独立性有关[12]。孙金辉等[13]报道了当温度从24℃ 骤降到18℃ 后,南美白对虾仔虾肌肉中的SOD酶活性急剧下降,与本研究结果一致。2周恢复期后,骤降组CAT活力仍维持在较高水平,SOD活力高于低温胁迫前。两种模式的低温胁迫对刺参体腔液中的抗氧化酶产生了一定的诱导效应,致使刺参体腔液中CAT、SOD酶活力在去除低温胁迫后的恢复期高于低温胁迫前[12]。
3.2 缓降及骤降低温胁迫对刺参体腔液中MDA含量的影响
MDA是生物体在逆境条件下发生膜脂质过氧化作用的产物之一,其含量代表膜脂过氧化作用的强弱,当机体遭受盐胁迫、低渗[14]和组织损伤[15]等逆境条件时,MDA含量都会在短时间内增多。本研究中,经缓降模式的低温胁迫后,刺参体腔液中MDA含量相对于低温胁迫前显著增加,说明低温胁迫对刺参抗氧化系统产生了一定的损伤,导致脂质过氧化物增多。2周恢复期后,MDA含量较低温胁迫后又显著下降,这与低温胁迫后,体腔液中CAT、SOD活力升高有关。
骤降模式低温胁迫后,刺参体腔液中MDA含量变化趋势与缓降模式相同。Park等[16]研究了温度应激对海洋观赏鱼Amphiprion melanopus抗氧化系统的影响,在28~20℃温度变化过程中,脂质过氧化物含量在暴露于低温环境时出现上升,与本研究结果一致。Kong等[17]研究认为,在5、10℃的低温条件驯化过程中,锯缘青蟹肌肉组织中的MDA迅速积累的原因是抗氧化酶活力在较低温度下出现下降,而本研究中仅骤降低温胁迫模式下SOD活力出现下降,这可能与低温处理时间不同有关。
3.3 不同降温模式的低温胁迫对刺参低温环境适应性的影响
CAT、SOD是反映生物对各种胁迫效应的重要指标,1周的0℃低温处理后,两种模式低温胁迫后的刺参体腔液中CAT活力相对于恢复期都有所下降,缓降模式比骤降模式下降得更明显;SOD活力相对于恢复期都有所升高,但骤降模式下SOD活力相对于缓降组升高更为显著;CAT与SOD同为抗氧化酶类并且协调作用共同分解氧化产物,经过骤降低温胁迫后,机体产生了一定的应激性,当再次遭遇温度骤降的情况下机体生成SOD较CAT更迅速,分解氧化产物的能力更强,从而保护机体免受恶劣环境的伤害。
MDA是环境胁迫作用与机体保护作用的综合反应[12],经包含CAT、SOD的刺参抗氧化系统共同作用后,两种模式的低温胁迫后刺参体腔液中MDA含量均低于对照组,说明两种模式的低温胁迫后刺参再次应对低温环境时,机体受损程度均有所降低,刺参对低温环境具备了一定的适应性。与恢复期相比,骤降组刺参体腔液中MDA含量相对于缓降组下降得更明显,表明骤降模式低温胁迫效果好于缓降模式,刺参对低温的适应性更强一些。研究表明,热历史能够改变刺参的耐热上限,这种改变与HSP70的表达模式有关[18]。本研究中,低温胁迫后的刺参对低温环境具有了一定的适应性,但该适应性是否长期稳定存在,并且这种适应性产生过程中,热激蛋白表达量及表达模式是否发生了相应的改变,还有待进一步的研究证明。
[1]廖玉麟.中国动物志 棘皮动物门 海参纲[M].北京:科学出版社,1997.
[2]An Z H,Dong Y W,Dong S L.A high-performance temperature control scheme:growth of sea cucumber Apostichopus japonicus at different modes of diel temperature fluctuation[J].Aquaculture International,2009,17(4):459-467.
[3]Sheng S L,Bin J I Y,Hua C A I Z,et al.The immunochemical variation of mitten hand crab Eriocheir sinensis after the increment of temperature[J].Oceanologia et Limnologia Sinica,2004,35(1):74-77.
[4]于明志,常亚青.低温对不同群体仿刺参幼参某些生理现象的影响[J].大连水产学院学报,2008,23(1):31-36.
[5]Wang Q L,Dong Y W,Qin C X,et al.Effects of rearing temperature on growth,metabolism and thermal tolerance of juvenile sea cucumber,Apostichopus japonicus Selenka:critical thermal maximum(CTmax)and hsps gene expression[J].Aquaculture Reasearch,2013,44(10):1550-1559.
[6]李霞,王霞.仿刺参在实验性夏眠过程中消化道和呼吸树的组织学变化[J].大连水产学院学报,2007,22(5):340-346.
[7]王天明,杨红生,苏琳.刺参呼吸树抗氧化防御酶类基因在夏眠期的表达特征[J].水产学报,2011,35(8):67-76.
[8]王晓燕,常亚青,丁君,等.降温对刺参免疫酶、可溶性蛋白及可溶性糖影响的初步研究[J].农学学报,2012,2(4):44-49.
[9]刘伟,常亚青,丁君.温度缓降和骤降对刺参“水院1号”和大连养殖群体非特异性免疫影响的初步研究[J].水产学报,2013,37(9):1342-1348.
[10]孔祥会,王桂忠,李少菁.低温驯化锯缘青蟹鳃抗氧化防护、ATPase及膜脂肪酸组成变化[J].水生生物学报,2007(1):59-66.
[11]强俊,杨弘,王辉,等.急性温度应激对吉富品系尼罗罗非鱼(Oreochromis niloticus)幼鱼生化指标和肝脏HSP70 mRNA表达的影响[J].海洋与湖沼,2012,43(5):943-953.
[12]赖廷和,何斌源,范航清,等.重金属 Cd胁迫对红树蚬的抗氧化酶、消化酶活性和 MDA含量的影响[J].生态学报,2011,31(11):3044-3053.
[13]孙金辉,徐赟霞,季延滨,等.温度骤降对南美白对虾仔虾抗氧化机能的影响[J].天津农学院学报,200(3):7-10.
[14]Xu Y J,Sun B.Effect of salinity stress on the growth,body composition and enzyme activities of juvenile Hippocsampus kuda[J].Oceanologia et Limnologia Sinica,2012,33(6):37.
[15]Zang Y Q,Tian X L,Dong S L,et al.Growth,metabolism and immune responses to evisceration and the regeneration of viscera in sea cucumber,Apostichopus japonicus[J].Aquaculture,2012,358/359(1):50-60.
[16]Park M S,Shin H S,Choi C Y,et al.Effect of hypoosmotic and thermal stress on gene expression and the activity of antioxidant enzymes in the cinnamon clownfish,Amphiprion melanopus[J].Animal Cells and Systems,2011,15(3):219-225.
[17]Kong X H,Wang G Z,Li S J.Effects of low temperature acclimation on antioxidant defenses and ATPase activities in the muscle of mud crab(Scylla paramamosain)[J].Aquaculture,2012,370/371(1):144-149.
[18]王青林.温度驯化对刺参(Apostichopus japonicus)生长及耐热性的影响及生理生态学机制[D].青岛:中国海洋大学,2012.
