煎炸油中总极性物质对细胞抑制和诱导凋亡的影响
2015-02-16李进伟蔡文辞刘元法
李进伟,蔡文辞,刘元法
(江南大学食品学院,江苏无锡 214122)
煎炸油中总极性物质对细胞抑制和诱导凋亡的影响
李进伟,蔡文辞,刘元法
(江南大学食品学院,江苏无锡 214122)
研究煎炸油中总极性物质(TPM)对细胞的生长抑制和诱导凋亡。结果表明:1.0mg/mL的TPM作用于HepG2细胞24、48、72h后,细胞增殖抑制率分别为9.8%、12.6%、16.1%;流式细胞仪结果显示,随着TPM浓度的增加,加药组细胞凋亡率逐渐增加,G0/G1期细胞数目逐渐减少,S期细胞数目逐渐增多,说明TPM对HePG2细胞增殖的抑制发生在S期。
煎炸油,总极性物质,HepG2细胞,细胞凋亡
煎炸油在加热煎炸油的过程中,由于高温、水分、空气(氧气)的存在,油脂分子发生许多复杂的氧化、水解、聚合反应,生成一些比正常的甘油三酯极性大的物质,即为煎炸油中的极性物质(TPM)。煎炸油中极性物质的增加会对人体健康产生不利影响,因此,越来越多的国家限制煎炸油中极性物质的含量,欧洲国家规定其含量不能超过25%[1]。国内对极性物质对人体健康研究相对较少,研究主要针对煎炸油本身的变化和煎炸油对人体的影响[2-5]。HepG2细胞在物质对人体肝细胞毒性实验体系中常被使用,因为HepG2细胞分化程度相对较高,与正常人体肝细胞在各方面都十分接近,有许多相同的功能与特点,生物转化代谢Ⅰ相和Ⅱ相酶都被较完整的保留,且较容易传代[6-7]。因此,本文通过研究煎炸油中极性物质对HepG2细胞抑制和和诱导凋亡影响,为进一步探索极性物质对人类健康的影响提供依据。
1 材料与方法
1.1 材料与仪器
煎炸专用油 上海益海嘉里有限公司;柱层析硅胶 青岛海洋有限公司;HepG2细胞 江南大学医药学院提供;噻唑蓝(MTT)、二甲基亚砜(DMSO) 美国Sigma公司;Hoechst 33258染色试剂盒、胰酶细胞消化液、细胞周期与细胞凋亡检测试剂盒 碧云天生物技术研究所;胎牛血清、RPM1640培养基 美国Gibco公司。
二氧化碳培养箱 无锡热电公司;M5酶标仪 美国Molecular Devices公司;倒置生物显微镜、FACS Calibur流式细胞仪 美国Becton Dickson公司;LSCM激光共聚焦显微镜 德国蔡司公司。
1.2 实验方法
1.2.1 极性物质的制备 将煎炸油放入煎炸容器中,(180±5)℃下加热40h,取出,冷却,利用传统硅胶柱层析法分离得到煎炸油中的极性成分[8],将其置于4℃备用。

表1 TPM对HepG2细胞周期的影响Table1 Effect of TPM on HepG2 cells cycle
1.2.2 细胞的培养 HePG2细胞用含10%胎牛血清的RPM 1640培养液在5% CO2、37℃条件下培养。
1.2.3 TPM对HepG2细胞的生长抑制实验 将对数期生长的HepG2细胞,加入0.25%的胰酶消化液将细胞消化,吹打分散并以细胞计数器计数。设置五个浓度,分别为0.05、0.25、0.50、1.00、2.00mg/mL,继续培养24、48、72h。对照组为100μL RPM1640培养液。然后按MTT标准方法处理细胞,用酶标仪在570nm波长下测定其吸光(OD)值。

1.2.4 Hoechst 33258染色法检测细胞形态变化实验 本实验极性物质浓度为0.05、0.50、2.00mg/mL,每个浓度设置三个重复。根据细胞凋亡-Hoechst染色试剂盒中步骤处理细胞,处理好样品之后,用激光共聚焦显微镜观察细胞形态,放大倍数为40倍。
1.2.5 TPM对HepG2细胞周期和凋亡的影响实验 本实验极性物质浓度为0.05、0.50、2.00mg/mL,每个浓度设置三个重复。根据细胞周期与细胞凋亡检测试剂盒中步骤处理细胞,用流式细胞仪检测细胞周期和细胞凋亡情况[9]。
2 结果和讨论
2.1 TPM对HepG2细胞的生长抑制评价
MTT法检测发现不同浓度TPM对HepG2细胞均有抑制作用,从图1可以看出:经不同浓度的TPM作用HepG2细胞24h后,随着TPM药物浓度的增加,细胞增殖抑制率也逐渐增大,TPM对HepG2细胞生长抑制影响呈剂量依赖性。用质量浓度相同的TPM作用HepG2细胞(24、48、72h)后对其细胞增殖抑制率进行比较,随着作用时间的延长,细胞增殖的抑制率也逐渐增长,1.0mg/mL的TPM作用HepG2细胞24、48、72h后,细胞增殖抑制率分别为9.8%、12.6%、16.1%,在相同浓度下,TPM对HepG2细胞生长抑制呈时间依赖性。这与一些学者研究结果相似,齐芳华发现华蟾素对HepG2细胞生长抑制影响呈剂量依赖性和时间依赖性[10];Liu发现黄曲霉毒素对HepG2细胞生长抑制影响呈剂量依赖性和时间依赖性[7]。
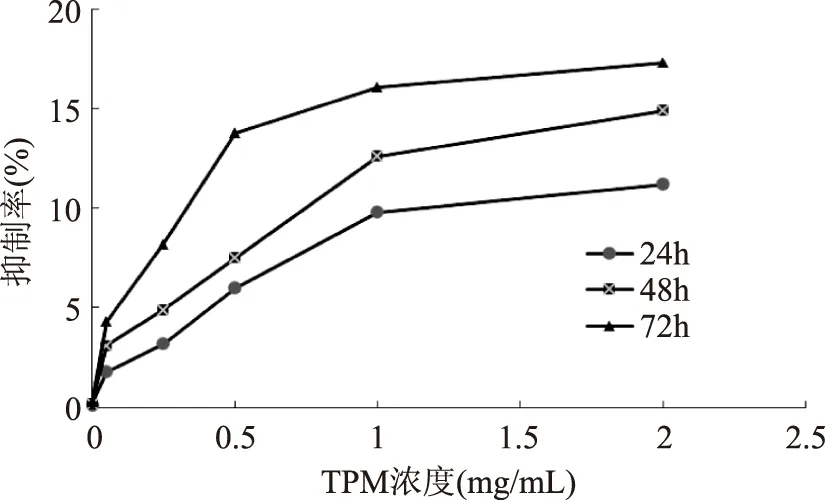
图1 不同浓度 TMP对HePG2细胞生长的抑制曲线Fig.1 The HePG2 cells growth inhibition curves by different concentrations TMP
2.2 TPM对HepG2细胞形态的影响
细胞形态学观察是判断细胞凋亡的一个典型的指标和基本参数,通过观察细胞的这些变化可以判断出细胞是否发生凋亡。未经TPM处理的细胞染色后在激光共聚焦显微镜下呈现正常的蓝色,且细胞大小均一,细胞核质均匀,细胞核呈现均匀的蓝色荧光;经不同浓度的TPM处理48h后,用Hoechst 33258荧光染色后在荧光显微镜下观察,可见细胞形态发生变化,低剂量组的细胞形状变大,中剂量组可见细胞核皱缩且部分细胞核碎裂,高剂量组可见细胞核呈现浓染,核质皱缩。
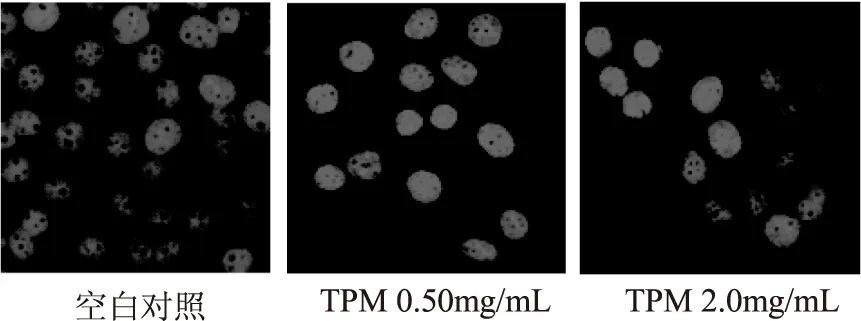
图2 TPM对HepG2细胞凋亡的影响(Hoechst 33258荧光染色,×40)Fig.2 Effect of TPM on HepG2cells apoptosis (Hoechst 33258 staining,×40)
2.3 TPM对HepG2细胞周期的影响
经不同TPM处理的HepG2细胞,流式细胞仪分析细胞周期结果见表1。与空白对照组比较,细胞随着TPM浓度的增加,G0/G1期细胞数目逐渐减少,S期细胞数目逐渐增多,并且随着药物浓度和作用时间的增加,这种现象更加明显,说明煎炸油中TPM对HePG2细胞增殖的抑制发生在S期,且具有浓度依赖性。
2.4 TPM对HepG2细胞凋亡的影响
TPM对HepG2细胞凋亡的影响见表2,由表2可知,TPM作用HepG2细胞24h后,浓度从0.05mg/mL增大到2.00mg/mL时,细胞的凋亡率由0.78%增加到4.82%;TPM作用HepG2细胞48h后,浓度从0.05mg/mL增大到2.00mg/mL时,凋亡率由1.25%增加到5.99%;当TPM浓度相同时,随着TPM处理HepG2细胞时间的增加,细胞的凋亡率也不断增加。随着TPM浓度的增加及作用时间的延长,活细胞比例逐渐减少,发生凋亡和坏死的HepG2细胞数目逐渐增加,这表明TPM具有诱导HepG2细胞凋亡的作用。这与一些学者研究结果相似,Bonsi和Renzulli等研究表明在培养细胞中加入一定浓度黄曲霉毒素对HepG2细胞有很强的毒性,细胞凋亡大幅度增加[10-11]。
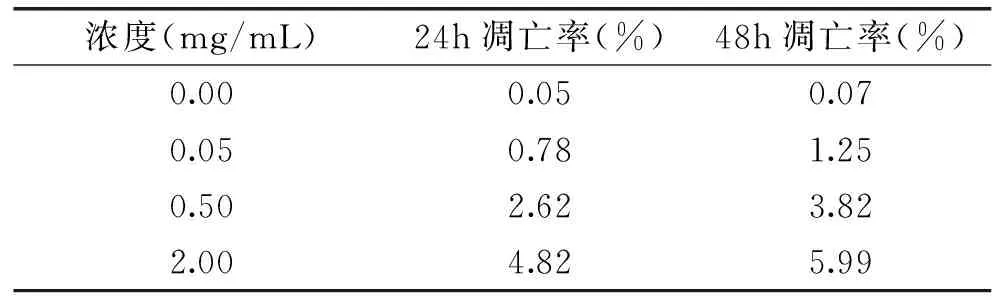
表2 TPM对HepG2细胞凋亡的影响Table2 Effect of TPM on HepG2 cells apoptosis
3 结论
煎炸油中TPM对HepG2细胞生长抑制影响呈剂量依赖性,在相同浓度下,TPM对HepG2细胞生长抑制呈时间依赖性。
煎炸油中煎炸油中TPM对HePG2细胞增殖的抑制发生在S期,且具有浓度依赖性。TPM具有诱导细胞凋亡的作用。
[1]徐生庚,裘爱泳. 贝雷油脂化学与工艺学[M]. 北京:中国轻工业出版社,2001,514-520.
[2]David R O,Gonzalez J,Benedi J. Thermally oxidized palm olein exposure increases triglyceride polymer levels in rat small intestine[J]. European Journal of Lipid Science and Technology,2010,112(9):970-976.
[3]穆昭. 煎炸油加热过程品质变化与评价[D]. 无锡:江南大学,2008.
[4]Billek C. Chemistry of Deep-Fat Frying Oils[J]. Lipid Science,2000,102(11):587-593.
[5]Marquez R,Dobarganes C. Nutrition and Pranctical Applications[J]. Journal of the American Oil Chemists Society,2007,84(5):56-59.
[6]Hrboticky N,Zimmer B,Weber P C. α-linolenic acid reduces the lovastatin-induced rise in arachidonic acid and elevates cellular and lipoprotein eicosapentaenoic and docosahexaenoic acid levels in HepG2cells[J]. Journal of nutritional biochemistry,1996,8:465-471.
[7]Liu R,Jin Q,Huang J,et al.Invitrotoxicity of aflatoxin B1 and its photo degradation products in HepG2cells[J]. Journal of Applied Toxicology. 2012,32(4):276-281.
[8]Anton K,Bianca R,Bea S. Comparison of different methods to determine polar compounds in frying oils[J]. European Food Research and Technology,2001,213:377-380.
[9]张燕,左国庆,汤为学. 奥沙利铂诱导人肝癌细胞株HepG2凋亡及其机制探讨[J]. 重庆医科大学学报,2004,29(6):745-748.
[10]齐芳华,李安源,赵林,等. 华蟾素诱导人肝癌细胞株 HepG2凋亡及其作用机制[J]. 药学学报,2010,45(3):318-323.
[11]Bonsi P,Palmery M,Agusti-Tocco G. Aflatoxin B1 cytotoxicity in neurons in culture. ATLA[J],Alt Lab Anim,1996,24:533-540.
[12]Renzulli C,Galvano F,Pierdomenico,et al. Effect of rosmarinic acid against aflatoxin B1 and ochratoxin-A-induced cell damage in a human hepatoma cell line(HepG2)[J]. J Appl Toxicol,2004,24:289-296.
Effect of the total polar components of frying oil on inhibition and induction of cell
LI Jin-wei,CAI Wen-ci,LIU Yuan-fa
(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The total polar components(TPM)of frying oil was investigated for its inhibition rate and induction of apoptosis of cell line HepG2. After treated with TPM of 1.0mg/mL for 24,48,72h,the inhibition rate of HepG2 cells were 9.8%,12.6%,16.1%,respectively. In the same time,with the increase of drug concentration,cell apoptosis rate increased. TMP could reduce the cell population in G0/G1phase and increase the cell population in S phase,which indicated that the inhibition of cell proliferation with TPM treatment may be occurred in S phase.
frying oil;total polar components;HepG2 cell;cell apoptosis
2014-08-07
李进伟(1972-),男,博士,副教授,主要从事脂质科学方面研究。
“十二五”国家科技计划课题(2011AA100806-3);国家自然基金(31171703);江苏省产学研创新项目(BY20120460)。
TS201.4
A
:1002-0306(2015)09-0358-03
10.13386/j.issn1002-0306.2015.09.070
