血清SP-A、SP-D在特发性肺间质纤维化疾病进展过程中的临床意义
2015-02-16尹虹雷尹世琦林庆艳崔晓媛唐正梁
尹虹雷 尹世琦 刘 涛 林庆艳▲ 崔晓媛 唐正梁
1.黑龙江省医院南岗院区呼吸内科,黑龙江哈尔滨150001;2.黑龙江省电力医院内二科,黑龙江哈尔滨150002
血清SP-A、SP-D在特发性肺间质纤维化疾病进展过程中的临床意义
尹虹雷1尹世琦2刘 涛1林庆艳1▲崔晓媛1唐正梁1
1.黑龙江省医院南岗院区呼吸内科,黑龙江哈尔滨150001;2.黑龙江省电力医院内二科,黑龙江哈尔滨150002
目的研究血清SP-A、SP-D浓度在特发性肺间质纤维化(idiopathic pneumonia fibrosis,IPF)患者疾病发展过程中的临床意义。方法将受试者分为4组,A组为肺泡炎症组(ground-glassopacity,GGO),B组为网格类型组(parenchymal collapse-opacity,PCO),C组为蜂窝肺组(honeycomb lung),D组为正常对照组,每组各18例受试者。采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测4组受试者血清SP-A、SP-D表达水平。进一步将A组中18例受试者按其HRCT显像分为阶段1(累及2个肺区),阶段2(累及2~4个肺区),阶段3(累及4个肺区以上)。结果4组受试者血清SP-A、SP-D的表达水平运用单因素方差分析比较,差异有统计学意义。当患者HRCT显示为GGO时,其病变占肺面积的大小不同,血清中SP-A的表达水平与病变范围密切相关,差异具有统计学意义。结论SP-A、SP-D伴随IPF病程进展而变化,联合监测是判断疾病严重程度的有价值的无创性指标之一。
特发性肺间质纤维化;SP-A;SP-D;无创检测;病情评估
间质性肺病(interstitial lung diseases,ILDs)是一类异质性疾病,其致病原因较多,可继发于感染、免疫、放射损伤等多种致病原因,但其中60%以上ILDs患者病因未知,总体统称为特发性肺间质纤维化(IPF);IPF诊断时多已是晚期,自诊断建立到死亡的中期生存时间不足3~5年[3]。目前,临床上缺乏特异性诊断和治疗措施。近年来ILDs的诊断呈逐年上升趋势,欧洲和北美国家该病患病率为2.8~9.3/(10万人·年)[1],与胃癌、肝癌、睾丸癌和宫颈癌的发病率相当。且诊断后5年存活率仅为55%[2]。早期诊断、早期治疗是决定患者预后及转归的关键。早期诊断尤为重要。2011年3月,在特发性肺间质纤维化(IPF)诊治循证指南中强调根据高分辨CT(higher solution computed tomog raphy,HRCT)的UIP(usual interstitialpneumonia,UIP)型特点可作为独立的IPF诊断手段,具备UIP典型HRCT表现者不必行病理活检[4],早期间质性肺病患者的HRCT可表现为磨玻璃样阴影,随着病变进展逐渐出现特异性的结节状、网格状阴影,最终发展至不可逆的蜂窝样改变,但早期需常规进行结缔组织病的相关血液化验以除外其他疾病的可能。
1 资料与方法
1.1 临床资料
所有受试者均为2008年11月~2014年8月间在黑龙江省医院南岗院区呼吸科住院治疗的IPF患者。根据其HRCT显示病变严重程度分为A组(肺泡炎症组)、B组(网格状类型)、C组(蜂窝样囊肿)。每组均随机选取18例测试者。A组中,男9例,女9例,年龄46~86岁,平均年龄(68.72±10.7)岁;B组中,男11例,女7例,年龄49~82岁,平均年龄(68.44± 9.14)岁;C组中,男10例,女8例,年龄48~80岁,平均年龄(68.94±9.26)岁。D组:健康体检者18例,包括男9例,女9例,年龄49~83岁,平均年龄为(66.22± 10.4)岁。D组的18例外周静脉血标本均选自2008年11月~2014年8月在黑龙江省医院南岗院区体检科体检的健康人群。四组间的性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。其中,磨玻璃样改变可能反映肺泡炎症(即肺泡炎),肺泡内肉芽组织,或小叶间和肺泡间隔的纤维化。网状类型反映了肺泡管、间隔或肺泡腔的纤维化,但也可能同时存在炎性成分。蜂窝样囊肿,表明肺泡壁不可逆的破坏和纤维化。将双肺分成6个区,即上肺野、中肺野、下肺野;气管隆突以上为上肺野,气管隆突水平至下肺静脉水平为中肺野,下肺静脉以下为下肺野[5],协助评定疾病累及范围。进一步将A组中18例按其HRCT显像病变累及范围分为阶段1(累及2个肺区)、阶段2(累及2~4个肺区)、阶段3(累及4个肺区以上)。
1.2 入组标准
54例IPF患者均符合2011年3月发表的新的IPF诊治循证指南;均已除外其他免疫系统疾病、肺炎及恶性肿瘤疾病等。
1.3 排除条件
本实验IPF患者入选者均按照诊断路径严谨筛选入组。4组72例受试者均从不吸烟。
1.4 样本采集
所有受试者均于清晨取外周静脉血标本3 mL各1份,取样后室温静置30min,3500 r/min离心10min,分离血清,于-70℃冰箱保存。测定前将血清标本置于室温复融,混匀,再次离心,取上清液测定。采用ELISA测定血清标本中的肺表面活性物质脱辅基蛋白A、D(pulmonary surfactant protein A and D,SP-A、SP-D)浓度,操作严格按照说明书操作进行。实验过程中避除反复融冻。
1.5 观察指标
SP-A、SP-D试剂盒(西唐生物制品有限公司),应用ELISA法测定。SP-A、SP-D值测定:严格按照试剂说明书操作予以标准品的稀释与加样、温育、配液、洗涤、加酶、温育、洗涤、显色、终止及测定。测定应在加终止液后15min以内进行。
1.6 统计学分析
所有实验所得数据均应用SPSS15.0统计学软件处理,计量资料以(x±s)表示,测得的血清SP-A、SP-D浓度比较采用单因素方差分析,F≥F0.01表示差异具有统计学意义。
2 结果
2.1 各组SP-A、SP-D的血清表达水平比较
IPF患者无论是处于肺泡炎症、网格类型时,外周静脉血中SP-A、SP-D的表达水平均明显高于D组健康对照受试者。在IPF病程初期即肺泡炎症为主时,血清SP-A、SP-D的表达水平均明显高于D组。根据数据统计,我们发现随诊肺泡炎症消退,肺组织纤维化出现及进展,血清SP-A、SP-D表达水平出现变化,SP-A表达呈下降趋势,SP-D表达水平则随着纤维化程度进行性加重呈上升趋势,B组血清SP-A、SP-D表达水平仍高于D组;在蜂窝肺时血清SP-A、SP-D表达水平仍高于D组。予以统计学处理,算得F值分别为24.92和59.25,查方差分析表F0.01(3,17)=8.67,即得出血清SP-A、SP-D的表达水平与D组相比,差异具有统计学意义。血清SP-A、SP-D表达水平伴随IPF病程进展而变化,具有统计学差异,故联合监测是判断疾病严重程度有价值的无创性指标之一。见表1。
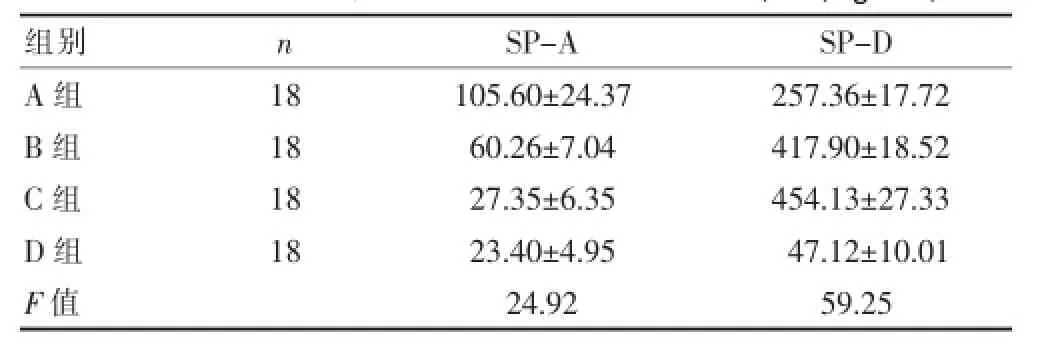
表1 各组SP-A、SP-D的血清表达水平比较(x±s,ng/m L)
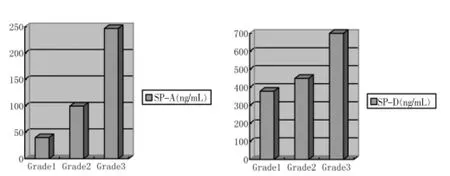
图1 A组中不同病变范围阶段SP-A、SP-D表达水平比较
2.2 A组(GGO)中不同病变范围阶段SP-A、SP-D表达水平比较
由表2、图1可见,病变累及范围大,则肺泡-毛细血管屏障损害较多,则释放入血的肺组织内富含的生物学标志物,直观发现外周静脉血SP-A、SP-D的表达水平要较病变范围小的受试者要高;病变累及范围小,则受试者外周静脉血中SP-A、SP-D的表达水平要较病变范围小的受试者要低。予以统计学处理,发现Grade1、Grade 2及Grade 3受试者血清中SPA、SP-D表达水平相比较,算得F值分别为26.8和18.4,查方差分析表F0.01(2,17)=19.4,即得出血清SP-A的表达水平与患者病变范围呈正相关,病变范围大则血清SP-A较病变范围小的患者表达增高,差异具有统计学意义;而血清SP-D的表达水平升高与患者病变范围大小无明显相关性,差异不具有统计学意义。通过本实验,我们获知,当患者HRCT显示为肺泡炎症(GGO)时,其病变占肺面积大小不同,则其外周静脉血中SP-A、SP-D表达水平亦不相同,且血清SP-A的表达水平与病变范围呈正相关。但由于样本数过小,故未予以施行统计学比较。有可能在一定程度上提示HRCT显示出的病变累及范围大小也可在一定程度上决定患者将来疾病转归,即可在一定程度上指导用药剂量及疗程。

表2 A组中不同病变范围SP-A、SP-D的血清表达水平比较(x±s,ng/m L)
3 讨论
IPF是一组侵袭肺泡壁为主并包括肺泡周围组织及其周边支撑结构病变的疾病的总称。随着疾病的不断进展,渐进性出现刺激性咳嗽及活动气短、低氧血症、呼吸困难等临床特征。发病率、死亡率逐年上升,给家庭和社会带来严重的社会负担和经济负担。从IPF的诊断建立到死亡的平均生存时间为3~5年[3]。老年人预后更差[6]。迄今为止,尚未发现治疗IPF的理想药物,因此,早发现、早诊断、早评估、早干预及早治疗在有效控制、延缓IPF发生发展过程中具有重要的临床意义。通过国内外大量学者的大量研究,目前普遍认为IPF发病始动于肺泡上皮损伤,导致上皮细胞修复异常、免疫功能失调和纤维增生/纤维化/基质重塑[7,8],而生物标志物作为一类反映机体健康或疾病状态的特殊物质,贯穿于肺泡上皮损伤、免疫功能失调和纤维增生/纤维化/基质重塑,即IPF的整个发生发展过程。相对于HRCT肺、肺活检等检测手段,生物学标志物检测在IPF疾病的发生发展过程中具有操作方便、安全、准确等优点,且可通过对相关生物标志物的动态监测,加强对IPF患者的临床管理,进行疾病高风险人群筛查、疾病活动性判断和疾病预后判断,并且协助疾病治疗甚至优化肺移植治疗[9,10]。良好的生物学标志物有利于制定临床研究方案、评估临床疗效等[11]。近年来,国内外众多学者致力于寻找可以在临床上指导IPF诊断的特异指标,如肌钙蛋白提示急性心肌损伤如此诊断IPF的特异指标。
SP-A、SP-D主要成分是二棕榈酰磷脂,是Ⅱ型肺泡上皮细胞分泌的肺泡表面活性物质的主要成分。具有明确的脏器特异性。肺泡Ⅱ型上皮细胞负责合成、储存并分泌肺表面活性物质(pulmonary surfactant,PS),在肺泡表面形成单分子层膜,降低肺泡表面张力,稳定正常肺泡内压,防止肺泡萎陷。当细菌、病毒等因素导致肺病感染或疾病情况产生肺部损伤时,以单层分子垂直排列于肺泡液-气液面的SP-A、SP-D的含量均会随着肺部内环境的改变而变化,是阻碍病原体的第一道防线。在IPF的发病中发挥着重要作用[12-15]。大量炎症介质破坏Ⅱ型肺泡上皮细胞超微结构,从而使SP-A、SP-D的分泌减少[16]。肺泡表面活性蛋白,包括本实验中检测的SP-A、SP-D均以剂量依赖方式下调多种促炎细胞因子及炎性介质的合成与释放从而抑制炎症反应[17],进一步消耗肺组织中SP-A、SP-D,故随着间质性肺病的发生发展,肺组织中的肺泡表面蛋白含量渐进性减少,而其对促炎因子、炎症介质的抑制作用也渐进性减弱,从而促动肺组织炎性病变继续进展进一步导致肺泡-毛细血管屏障损害渐进性发展,则肺组织内富含的生物学标志物,包括SP-A、SP-D大量释放入血[18]。通过本实验研究,我们还发现GGO表象为主的患者群中,病变累及范围大,则肺泡-毛细血管屏障损害较多,则释放入血的肺组织内富含的生物学标志物,包括外周静脉血SP-A、SP-D的表达水平要较病变范围小的受试者要高;病变累及范围小,则受试者外周静脉血中SP-A、SP-D的表达水平要较病变范围小的受试者要低。那么从另一个角度,也可以表述为当患者IPF诊断确立时,通过其HRCT显示出的病变累及范围大小也可在一定程度上决定患者将来疾病转归,即可在一定程度上指导用药剂量及疗程。但由于样本数过少,故不具有代表性,未予以统计学比较。有待进一步大样本实验予以验证。IPF是一种原因不明的慢性进展性纤维化型间质性肺炎,炎性病变贯穿整个疾病,血清SP-A、SP-D的表达水平均呈高水平表达,且随着疾病的进展而出现表达水平的差异。从而得出结论,检测患者外周血中SP-A、SP-D的表达水平就可判断肺损伤程度,即可判断间质性肺纤维化的严重程度,可帮助临床医生结合患者的HRCT的影响学表象推断患者目前纤维化的分期,并可在一定程度上预测患者预后,协助临床医生对患者的病情变化进展予以掌握。Kinder等[19]在一项含82例肺外活检确诊IPF患者的研究里分析发现,SP-A的基础表达浓度每增加49μg/L,1年内病死率的风险增加3.3倍。通过本实验研究,我们得知,无论是在间质性纤维化的起始初期、纤维化进展过程中以及纤维化的终末期均可检测到不同高表达水平的SP-A、SP-D。和目前国内外的大量研究报道相符合。但Song等[20]研究报道,SP-A应用到临床预后模型(包括年龄、FVC、FVC变化等量)中时,并不能明显提高预后判断。
综上所述,IPF的发生发展机制是近年国内外的学者的研究热点,通过大家共同努力,我们对其发病机制、早期临床表现及临床预后均可有所判断,其中IPF相关的生物学标志物的研究也得到了很大进展。SP-A、SP-D作为肺泡Ⅱ型上皮细胞分泌自产的专属肺脏的脏器特异性标志物,在早期发现、诊断、评估、干预等方面具有其特异性,通过本实验研究我们得知通过检测患者外周血中SP-A、SP-D的表达水平可以联合HRCT准确有效反应IPF的发生、发展及一定程度上预测预后。但由于本实验样本例数较小,研究次数少,缺乏动态监测,那么本实验所得数据是否可以指导临床医生准确判定IPF的发生发展过程中各阶段分期的界定分界点还有待进一步研究予以证实。
[1]Hucthinson J,Fogarty A,Hubbard R,et al.Global incidence andmortality of idiopathic pulmonary fibrosis:A systematic review[J].Eur Respir J,2015.[Epub ahead ofprint].
[2]Nho RS.Current concept for the pathogenesis of idiopathic pulmonary fibrosis[J].Clin Res Pulmonary,2013,(1):1006-1008.
[3]ATSand ERS.American Thoracic Society European Respiratiory Societyinternationalmultidisc iplinary consensus classification of the idiopathic interstitial pneumonia[J]. Am JRespir Cirt Care Med,2002,165(2):277-304.
[4]Raghu G,Collard HR,Egan JJ,et al.An official ATS/ ERS/ALAT statement:idiopathic pulmonary fibrosis:Evidence-based guidelines for diagnosis and management[J]. Am JRespir Cirt Care Med,2011,183:788-824.
[5]Oda K,Ishimoto H,Yatera K,et al.High-resolution CT scoring system-based grading scale predicts the clinical outcomes in patients with idiopathic pulmonary fibrosis[J]. Respir Res,2014,15:10.
[6]Raghu G,Chen SY,Yeh WS,et al.Idiopathic pulmonary fibrosis in US medicare beneficiaries aged 65 years and older:Incidenceprevalence,and survival,2001-11[J].Lancet Respir Med,2014,2(7):566-572.
[7]King TE,Pardo A,Selman M.Idiopathic pulmonary fibrosis[J].Lancet,2011,378(9807):1949-1961.
[8]Chan AL,Rafii R,Louie S,et al.Therapeutic update in idiopathic pulmonary fibrosis[J].Clin Rev Allergy Immunol,2013,44(1):65-74.
[9]Cieehitto G,SanguinettiCM.Idiopathic pulmonary fibrosis:The need for early diagnosis[J].Multipdiscip Respir Med,2013,8(1):53.
[10]裴祥,孙铁英.特发性肺纤维化生物标志物在临床应用中的研究进展[J].中华结核和呼吸杂志,2015,38(7):527-532.
[11]Vij R,Noth I.Peripheral blood biomarkers in idiopathic pulmonary fibrosis[J].Transl Res,2012,159(4):218-227. [12]Selman M,Lin HM,Montano M,et al.Surfactant protein A and B genetic variants predispose to idiopathic pulmonary fibrosis[J].Hum Genet,2003,113(6):542-550.
[13]Nogee LM,Dunbar AE,Wert SE,et al.A mutation in the surfactant protein C gene associated with familial interstitial lung disease[J].N Engl JMed,2001,334(8):573-579.
[14]Ono S,Tanaka T,Ishida M,et al.Surfactant protein C G100S mutation causes familial pulmonary fibrosis in Japanese kindres[J].Eur Respir J,2011,38(4):861-869. [15]Maitra M,Wang Y,Gerard RD,et al.Surfactant protein A2 mutations associated with pulmonary fibrosis lead to protein instability and eddoplasmic reticulum stress[J].J Biol Chem,2010,285(29):22103-22113.
[16]Mclntosh JC,Swyers AH,Fisher JH,etal.Surfactantprotein A and D increase in response to intratracheal lipopolysacchride[J].Am JRespir Cell Mol Biol,1996,15(4):509-519.
[17]McCormack FX,Whitsett JA.The pulmonary collections,SP-A and SP-D,orchestrate innate immunity in the lung[J]. Chin Invest,2002,109(6):707-712.
[18]Samukawa T,Hamada T,Uto H,et al.The elevation of serum napsin A in idiopathic pulmonary fibrosis,compared with KL-6,surfactant protein-A and surfactant protein-D[J].BMC Pulm Med,2012,12:55-62.
[19]Kingder BW,Brown KK,McCormack FX,et al.Serum surfactant protein-A is a strong predictor of earlymortality in idiopathic pulmonary fibrosis[J].Chest,2009,135(6):1557-1563.
[20]Song JW,Do KH,Jang SJ,etal.Blood biomarkersMMP-7 and SP-A:Predictors of outcome in idiopathic pulmonary fibrosis[J].Chest,2013,143(5):1422-1429.
Clinical significance of serum SP-A and SP-D in disease developm ent of idiopathic pneumonia fibrosis
YIN Honglei1YIN Shiqi2LIU Tao1LINQingyan1CUIXiaoyuan1TANG Zhengliang1
1.Department of Respiration Medicine,Heilongjiang Hospital Nangang Division,Harbin 150001,China;2.Second Department of Internal Medicine,Heilongjiang Electric Power Hospital,Harbin 150002,China
ObjectiveTo explore the clinical significance of serum SP-A and SP-D in disease development of idiopathic pneumonia fibrosis(IPF).M ethodsThe subjectswere divided into four groups,group A was ground-glass opacity group(GGO),group B was parenchymal collapse-opacity group(PCO),group C was honeycomb lung group,and group D was healthy control group,each with 18 subjects.The expression levels of serum SP-A and SP-D were detected by enzyme linked immunosorbent assay(ELISA).The 18 subjects in group A were further divided into stage 1(involving 2 lung regions),stage 2(involving 2 to 4 lung regions),and stage 3(involving more than 4 lung regions)based on their HRCT image.Resu ltsCompared by one-way analysis of variance,the serum SP-A and SP-D expression levels in four groups showed significant difference.When the HRCT indicating GGO,the occupied region of lesion on lungwas various and the expression level of serum SP-A was closely related to the lesion size,which was statistically significant.ConclusionThe levels of SP-A and SP-D change along with the development of IPF disease course.Combined monitoring is a valuable noninvasivemethod to judge the severity of disease.
IPF;SP-A;SP-D;Noninvasive detection;Disease assessment
R563.9
A
1673-9701(2015)36-0013-04
2015-10-12)
黑龙江省科技计划项目(GC08C422)▲
