麦麸中四种蛋白的Osborne法提取分离及性能研究
2015-02-15严汪汪钟振声
孙 媛,蔡 迪,向 琴,严汪汪,钟振声
(华南理工大学化学与化工学院,广东广州 510640)
麦麸中四种蛋白的Osborne法提取分离及性能研究
孙 媛1,蔡 迪2,向 琴2,严汪汪2,钟振声*
(华南理工大学化学与化工学院,广东广州 510640)
麦麸蛋白是植物蛋白的一种,通过研究麦麸蛋白的组成及性质以应用于食品工业。用Osborne法分离提取出清蛋白、球蛋白、醇溶蛋白和谷蛋白4种蛋白,考马斯亮蓝法测定等电点。实验表明:清蛋白、球蛋白、醇溶蛋白和谷蛋白的相对含量分别是48.06%、25.12%、18.70%,8.12%;等电点依次为4.0、5.0、5.8、5.2。电镜表观发现,清蛋白和球蛋白分子均连接紧密,清蛋白表面细致多层,局部有孔;球蛋白表面疏松,表面孔较少。醇溶蛋白和谷蛋白分子连接松散,醇溶蛋白呈不规则的球状,谷蛋白表面平滑,分子团多。功能性质测定结果表明:四种蛋白中球蛋白的持水性和持油性最大,分别为5.00g/g和2.40g/g;醇溶蛋白的起泡性、起泡稳定性和乳化力最强,分别为376%、71%和75%。因此,球蛋白适宜作为添加剂应用在肉制品中,醇溶蛋白适宜作为添加剂应用在奶制品和蛋糕等食品配方中。
麦麸蛋白,等电点,功能性质
小麦麸皮是小麦加工过程中的副产物,我国每年小麦加工过程中麦麸产生量超过2000万t,但其中85%以上都被直接作为辅料用于酿造和饲料行业,经济价值不高[1]。经研究,麸皮中含有较丰富的蛋白质、碳水化合物、膳食纤维等功能成分[2-4],若能够全部被充分利用,将具有很高的经济效益和社会效益。
目前对植物蛋白的提取研究主要是碱法、酶法、超声辅助法和Osborne法等。管骁[5]等人用碱溶酸沉法制备燕麦浓缩蛋白,蛋白提取率达46.73%,纯度为74.36%;陈凤莲[6]等人对比木瓜蛋白酶、碱性蛋白酶和碱法分离麦麸中的蛋白质,得出碱性蛋白酶最优的结论;金梅[7]等人利用α-淀粉酶和超声波结合的方法,通过响应面法优化提取条件从小麦麸皮中分离制备蛋白质,蛋白质得率为71.37%;R.S.F. DASILVA[8]等人尝试先用糖酶去除细胞壁,然后碱溶以得到更多蛋白质,最后提取率为38.5%。张敏[9]等人和冯明珠[10]等人分别用Osborne法探究米糠和燕麦麸中四种蛋白的提取和功能性质。
小麦麸皮中蛋白质含量在20%左右(干基计),其中含有清蛋白、球蛋白、醇溶蛋白和谷蛋白。本文采用Osborne法逐级分离出麦麸中四种蛋白,分别对其理化性质和功能性质进行探究,为麦麸蛋白的精细高值利用提供依据。
1 材料与方法
1.1 材料与仪器
小麦麸皮 广州华汇公司;考马斯亮蓝R-250 上海伯奥生物科技有限公司;Tris 北京鼎国生物技术有限公司;其他试剂 均为分析纯。
Scientz-10N 冷冻干燥机 宁波新芝生物科技公司;岛津UV-2450紫外可见分光光度计 杭州瑞析科技有限公司;JEOL 6300F扫描电子显微镜 日本日立公司;FJ300-SH数显高速分散均质机 上海标本模具厂;KDN-103F自动定氮仪 上海纤检仪器公司;TG16-WS台式高速离心机 湖南湘仪实验室仪器公司;T.G.L-16gR型高速冷冻离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 麦麸蛋白的分离操作 将麦麸在45℃低温下烘干至恒重,粉碎后过40目筛,取筛下物作为实验样品。按照如下Osborne流程[9]依次提取麦麸中的清蛋白、球蛋白、醇溶蛋白和谷蛋白。
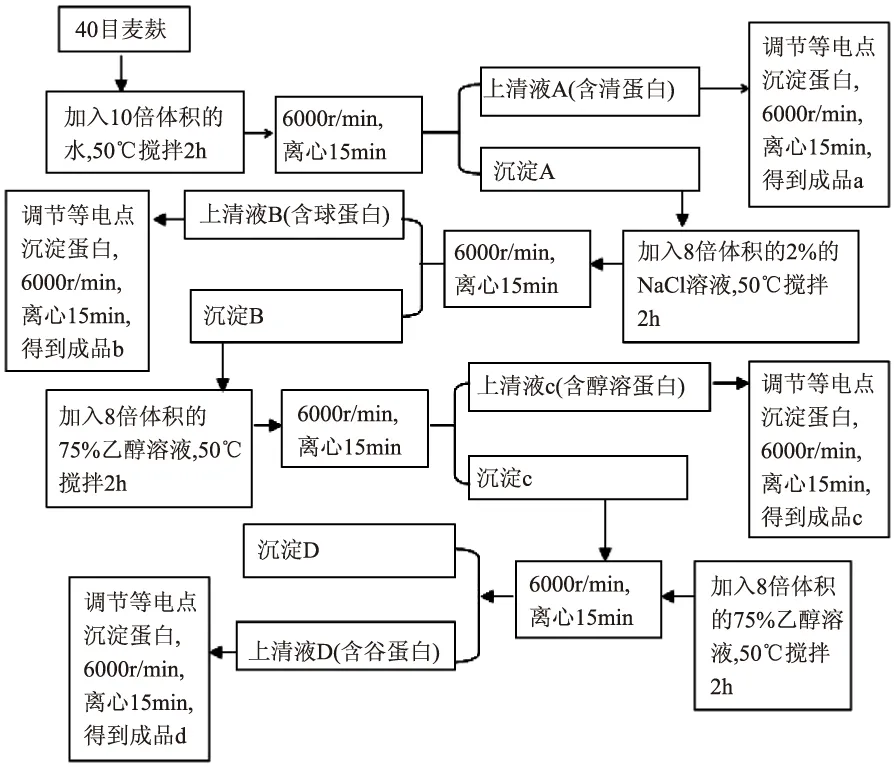
图1 Osborne法提取麦麸中四种蛋白工艺流程图Fig.1 Extraction of four proteins from wheat bran by Osborne
1.2.2 提取蛋白前后麦麸全成分分析方法 蛋白质含量测定,凯氏定氮法(GB/T5009.5-2010)[11];碳水化合物测定,酶解滴定法(GB/T5009.9-2003)[12];脂肪测定,索氏抽提法(GB/T5009.6-2003)[13];膳食纤维测定,酶-重量法(AACC-32-07)[14];灰分测定,灼烧法(GB/T5009.4-2010)[15];水分测定[16],直接干燥法(GB/T5009.3-2010)。
蛋白提取率(%)=原料蛋白含量-去蛋白后蛋白含量/原料蛋白含量×100
1.2.3 四种分离蛋白理化性质测定
1.2.3.1 等电点测定 通常测定蛋白质等电点的方法有双缩脲法、福林酚法、考马斯亮蓝(G-250)法和BCA法。其中考马斯亮蓝法[17]测定时间最短,灵敏度高,重现性好,线性关系好,因此本文选用此方法进行蛋白质等电点的测定[18]。
取9份10mL蛋白溶液并编号,依次调节pH到3~11,8000r/min离心15min,取上清液,分别测定其在595nm处的吸光度大小[17]。根据蛋白质在等电点处溶解度最小的原理,吸光度最小的pH即为蛋白粗略等电点。然后以粗等电点为中心,0.2为单位向前后扩散再取4个点,按照同样的方法测定吸光度,最终测得吸光度最小的pH即为该蛋白质的等电点。
A=kC+b
其中:A为吸光度;C为蛋白溶液浓度,g/L;k,b为常数。
1.2.3.2 表观形态观察 样品过100目筛,取筛下物用双面胶黏在样品座上。把样品座置于离子溅射仪中,在样品表面蒸镀1层10~20nm厚的铂金膜后,在不同放大倍数下进行电镜观察并拍摄照片。
1.2.4 四种分离蛋白功能性质测定
1.2.4.1 吸水性 取0.25g样品与25mL蒸馏水于离心管混匀,50℃水浴中搅拌20min使充分溶解,4000r/min下离心15min,弃去上清液后称沉淀质量[19]。按下式计算:

1.2.4.2 持油性 取0.25g样品与25mL花生油于离心管混匀,50℃水浴中搅拌20min使充分溶解,4000r/min下离心15min,弃去上清液后称沉淀质量。按下式计算:

1.2.4.3 起泡性及起泡稳定性 配制蛋白含量约为1%的蛋白溶液:取蛋白样品0.50g,溶于50mL 0.05mol/L(pH8.0)的Tris-HCL溶液。调溶液pH7,在10000r/min下均质2min,置于250mL量筒中,分别在0min和10min时读数,根据产生的起泡顶端与液面的距离即可读出泡沫的体积,mL。


1.2.4.4 乳化性及乳化稳定性 乳化力:取1.2.4.3配制的蛋白溶液,调溶液pH7,按体积比4∶1加入花生油12.5mL,10000r/min下均质1min,静置1min后取乳化层10mL到离心管,3000r/min离心30min读体积,mL。乳化稳定性:将以上离心管在80℃水浴加热30min再读数,mL。


2 结果与讨论
2.1 Osborne分离法的选用

表1 提取蛋白前后麦麸的成分变化(%,干基计)Table1 Changes of composition before and after protein extraction(%,dry basis)
注:*各个项目是分别测定的,分别带入误差,所以合计含量出现±5%的总误差尚可接受。

表2 100g麦麸中分离的四种麦麸蛋白质量、纯度及分布Table2 Distribution of quality and purity of four proteins in 100g wheat bran
Osborne分离法的原理是根据各种蛋白质在不同溶剂中溶解度不同的性质,利用最简单的溶液/沉淀分离手段将可溶性蛋白与不溶性蛋白进行分离。尽管该方法发明已经有100多年历史,尚有改进的余地,而且蛋白质的总回收率也不高,但是可以将清蛋白(Albumin)、球蛋白(Globulin)、醇溶蛋白(Prolamin)和谷蛋白(G1utelin)四种组分逐一分离开来。本文主要目标是研究麦麸中四种蛋白的功能特性,暂时不考虑蛋白质的提取率问题,所以选择采用最经典的Osborne分离法得到四种麦麸分离蛋白样品,没有对Osborne分离法进行改进。
2.2 提取蛋白前后麦麸的成分变化
由表1可知,提取蛋白后碳水化合物和纤维含量相对提高,油脂和灰分百分比下降。蛋白提取率为21.64%。提取率较低是因为本文分离得到的蛋白只取在等电点下析出的沉淀蛋白,在等电点下仍有一部分蛋白质溶解在溶液中没有被回收。
2.3 四种麦麸蛋白含量分析
由表2可以看出,从麦麸中分离得到的清蛋白、球蛋白、醇溶蛋白和谷蛋白质量依次减小,以谷蛋白为参照,清蛋白、球蛋白和醇溶蛋白的含量分别是6倍、3倍和2.3倍。造成上述差别的原因除了各种蛋白含量不一致外,Osborne分离法的操作具有局限性。清蛋白和球蛋白属于可溶性蛋白,在水或在稀盐溶液中溶解比较完全,界面清晰,与其他固体杂质分离比较干净,收率较高,得到的蛋白纯度分别达到67.73%和73.95%;而醇溶蛋白和谷蛋白属于不溶性蛋白,即使在稀酸或稀碱溶液中也不能完全溶解,与其他固体组分分离不彻底,在等电点沉淀后离心得到的产物呈流动状,冷冻干燥后仍不结实,所以收率低,得到的蛋白纯度也分别只有30.58%和57.58%。通过实验可以初步认为麦麸蛋白以水溶性蛋白为主,麦麸资源开发应该充分考虑水溶性蛋白的特性和利用领域。
2.4 各分离蛋白的理化性质
2.4.1 等电点曲线 由于蛋白质表面离子化侧链的存在,蛋白质带净电荷。由于这些侧链都是可以滴定的,对于每个蛋白都存在一个pH使它的表面净电荷为零即等电点。
如图2所示,清蛋白、球蛋白、醇溶蛋白和谷蛋白在pH 4.0,5.0,5.8和5.2处吸光度最小,因此可以推断它们的等电点依次为4.0,5.0,5.8和5.2。实验以牛血清蛋白为参比,因四种蛋白提取液中蛋白质浓度不同,为简化操作,等电点的测定相对独立,同时为保证每种蛋白质溶液的浓度在标准蛋白的浓度范围里,4种蛋白质的离心上清液取样量不同,即图2中四条曲线的吸光度大小与真实含量无关,相互之间不具可比性。

图2 四种麦麸蛋白的等电点曲线Fig.2 Four wheat bran proteins’isoelectric point curve
2.4.2 表观结构形态 四种蛋白的扫描电镜图如图3,由图可以看出,清蛋白和球蛋白分子均连接紧密,清蛋白表面细致多层,呈山脊状,局部有孔,这会影响到其吸附性;球蛋白表面疏松,局部隆起,表面孔较少。和清蛋白和球蛋白不同,醇溶蛋白和谷蛋白分子连接松散,这可能造成它们和另两种蛋白可溶性与不可溶性区别的原因。醇溶蛋白呈不规则的球状,局部较为细致,连接成较大的分子基团,谷蛋白表面平滑,分子团多。蛋白质的表面形态主要影响其功能性质如持水持油性,乳化性质等,研究蛋白的表面形态可以对其性质做出一定的解释和依此提出一些可行的利用方案。

图3 四种蛋白的扫描电镜图Fig.3 Scanning electron micrographs of the four proteins
2.5 四种分离蛋白功能性质评价
2.5.1 吸水性 蛋白质的吸水性是用来衡量蛋白质吸附水的能力大小的指标。以大豆分离蛋白(SPI)为对照,由图4可知,球蛋白的吸水性最强,是5.00g/g;清蛋白与大豆分离蛋白的吸水性相近,分别为3.99g/g和3.77g/g;醇溶蛋白和谷蛋白吸水性较小,分别为1.90g/g和1.74g/g。在食品加工业中来说,蛋白质的吸水性大小非常重要,吸水性好的蛋白质应用广泛,添加到食品中可以使口感更细腻。
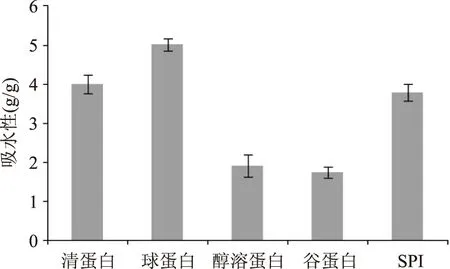
图4 四种蛋白的吸水性Fig.4 Absorbent of the four proteins

图5 四种蛋白的持油性Fig.5 Oil retention of the four proteins
2.5.2 持油性 持油性是指蛋白质保持油的能力,蛋白质持油性在肉制品、奶制品等食品配方和加工中起着很重要的作用。与持水性一样,以大豆分离蛋白为对照,由图5可知,大豆分离蛋白(SPI)的持油性比麦麸蛋白好,为3.08g/g;麦麸四种蛋白中,球蛋白的持油性最好(2.40g/g),清蛋白次之(2.09g/g),谷蛋白与清蛋白的持油性相差不大(1.93g/g),最小的是醇溶蛋白(0.942g/g)。球蛋白、清蛋白和谷蛋白的持油性高,可以作为持油替代品应用于食品生产。
2.5.3 起泡性 由图6可知,醇溶蛋白的起泡性远远高过其他蛋白,达到376%,是清蛋白的1.9倍,球蛋白的3.1倍,谷蛋白的3.5倍,是原料的3.8倍,是参照物蛋清的8.2倍。醇溶蛋白的起泡稳定性高达71%,超过蛋清的稳定性52%。综合可知,醇溶蛋白的起泡性和起泡稳定性都是最好的,比参照物蛋清要高出很多,因此醇溶蛋白可以作为一种起泡剂。

图6 不同蛋白的起泡及起泡稳定性Fig.6 Foaming and stability of different proteins
2.5.4 乳化性及乳化稳定性 图7表明,醇溶蛋白的乳化性最好,其次是谷蛋白,原料麦麸的乳化性也有53.5%,高于参照物蛋清的乳化力26%。清蛋白的乳化稳定性最好,其次是谷蛋白,醇溶蛋白和球蛋白的乳化稳定性相同,略低于蛋清。综合可知,醇溶蛋白和谷蛋白是比较好的两种乳化剂。
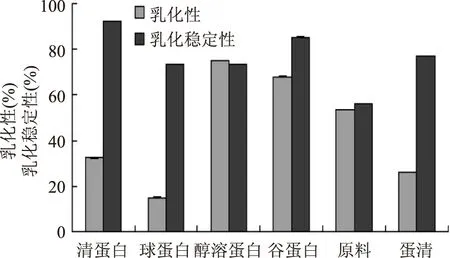
图7 四种蛋白的乳化及乳化稳定性Fig.7 Emulsification and stability of four proteins
3 结论
3.1 麦麸清蛋白、球蛋白、醇溶蛋白、谷蛋白的等电点依次为4.0,5.0,5.8,5.2。在回收蛋白总量中,以上四种蛋白的相对比例分别是48.06%、25.12%、18.70%,8.12%。对比燕麦麸、米糠等,不同谷物之间同类蛋白的等电点也略有差异,这与其氨基酸组成及结构密切相关。Osborne分离法的麦麸蛋白提取率仅为21.64%,其他谷物提取率也在20%~30%,采用Osborne法分离回收麦麸蛋白不是一种好的选择,但是这种方法为分步提取谷物蛋白提供了研究价值[10,19-20]。
3.2 清蛋白和球蛋白分子均连接紧密,清蛋白表面细致多层,呈山脊状,局部有孔;球蛋白表面疏松,局部隆起,表面孔较少;醇溶蛋白和谷蛋白分子连接松散,呈不规则的球状,这可能造成它们和另两种蛋白可溶性与不可溶性区别的原因。四种蛋白性能各异,球蛋白的持水性和持油性最大,分别为5.00g/g和2.40g/g,适宜作为添加剂应用在肉制品中;醇溶蛋白的起泡性、起泡稳定性和乳化力最强,分别为376%、71%和75%,适宜作为添加剂应用在奶制品和蛋糕等食品配方中。
[1]江晖,何珣. 小麦麸皮功能性成分的研究进展[J]. 安徽农业科学,2011,02:834-835.
[2]王菁莎,王颉,刘景彬,等. 小麦麸皮的加工利用现状[J]. 纤维素科学与技术,2005,02:59-65.
[3]史建芳,胡明丽. 小麦麸皮营养组分及利用现状[J]. 现代面粉工业,2012,02:25-28.
[4]安艳霞,李水莲,王亚平. 小麦麸皮的功能成分及加工利用现状[J]. 粮食流通技术,2011,02:41-43.
[5]管骁,姚惠源,陈正行. 碱提酸沉法制备燕麦麸浓缩蛋白的工艺及其改进[J]. 粮食与饲料工业,2006,01:22-27.
[6]陈凤莲,方桂珍. 不同方法分离小麦麸皮中蛋白质的研究[J]. 粮食加工,2009,34(4):28-35.
[7]金梅,赵瑞昌,姜东,等. 响应面法优化麦麸蛋白超声波-酶法提取工艺[J]. 中国粮油学报,2010,08:6-9,14.
[8]N. WASZCZYNSKYJ,C.S.RAO,R.S.F.DASILVA.Extraction of Proteins from Wheat Bran:Application of Carbohydrases[J].Cereal Chem,1980,58(4):264-266.
[9]张敏,周梅,王长远. 米糠4种蛋白质的提取与功能性质[J]. 食品科学,2013,34(1):18-21.
[10]冯明珠,何聪芬,赵华,等. 燕麦麸蛋白质的Osboren分类及SDS-PAGE电泳分析[J]. 食品工业科技,2007,01:77-79.
[11]GB/T5009.5-2010,食品中蛋白质的测定[S]. 北京:中华人民共和国卫生部,2010.
[12]GB/T5009.9-2003,食品中淀粉的测定[S]. 北京:中华人民共和国卫生部,2003.
[13]GB/T5009.6-2003,食品中脂肪的测定[S]. 北京:中华人民共和国卫生部,2003.
[14]GB/T5009.88-2008,食品中膳食纤维的测定[S]. 北京:中华人民共和国卫生部,2008.
[15]GB/T5009.4-2010,食品中灰分的测定[S]. 北京:中华人民共和国卫生部,2010.
[16]GB/T5009.3-2010,食品中水分的测定[S]. 北京:中华人民共和国卫生部,2010.
[17]王多宁,赵雁武,田芙蓉. 考马斯亮蓝微盘比色法测定蛋白质含量[J]. 第四军医大学学报,2001,06:528-529.
[18]陈钰. 马铃薯淀粉废水中的蛋白回收及表征[D].华南理工大学,2010.
[19]王艳玲. 米糠中四种蛋白的提取工艺及特性研究[D].哈尔滨:东北农业大学,2013.
[20]乔宁. 绿豆(Vigna radiata)蛋白的提取及其功能性质研究[D].天津:天津商业大学,2014.
Extraction and characterization of four proteins from wheat bran by Osborne
SUN Yuan1,CAI Di2,XIANG Qin2,YAN Wang-wang2,ZHONG Zhen-sheng*
(Chemistry and Chemical Engineering,South China University of Technology,Guangzhou 510640,China)
Wheat gluten is a kind of plant protein,studying the composition and properties of wheat gluten so as to be applied to the food industry. Four proteins including albumin,globulin,prolamin and glutenin were extracted from wheat bran by the Osborne method,with Coomassie brilliant blue measuring isoelectric points. Experimental results showed the relative contents of albumin,globulin,prolamin and glutenin were 48.06%,25.12%,18.70%,8.12%,and the isoelectric points were 4.0,5.0,5.8,5.2,respectively. The electron microscopy showed both albumin and globulin molecules were closely connected. Albumin surface meticulous and multilayer,with holes locally. Globulin surface loose and less holes. Prolamin and glutenin molecules were loosely connected. Prolamin appeared irregular globular,while glutenin surface smooth with many molecules. Functional properties showed globulin possessed both the highest waterbinding capacity(5.00g/g)and the best holding oil capacity(2.40g/g),while prolamin held the strongest foaming capacity(376%)and stability(71%),and the highest emulsibility(75%). Therefore,globulin was suiTableas additives in meat products,and Prolamin was suiTableas additives in dairy and cake recipe.
wheat bran proteins;isoelectric point;functional properties
2014-06-16
孙媛(1990-),女,硕士,主要从事精细化学品的提取和表征方面的研究。
*通讯作者:钟振声(1955-),男,学士,教授,主要从事有机精细化学品的合成、提取和分析表征方面的教学、研究和技术开发工作。
TS201.2
A
:1002-0306(2015)09-0136-05
10.13386/j.issn1002-0306.2015.09.021
